18045例无创产前筛查游离胎儿DNA比例分析*
代 鹏,赵干业,胡 爽,刘 宁,孔祥东
(郑州大学第一附属医院妇产科遗传与产前诊断中心,郑州 450052)
1997年Lo等发现孕妇外周血浆中存在游离胎儿DNA(cell-free fetal DNA,cffDNA),为无创产前检测(non-invasive prenatal screening,NIPS)提供了新思路,包括胎儿染色体非整倍体、染色体微缺失/重复综合征以及单基因遗传病[1-3]。研究显示,血浆游离胎儿DNA比例(fetal DNA fraction,FF)是NIPS应用胎儿遗传疾病检测的重要参数[4],因此FF的准确估算尤为重要。孕妇的孕周、体重等因素可影响FF含量,如FF过少,则无法正确反映cffDNA在各染色体上的分布情况,进而影响NIPS检测结果的准确性,导致假阴性发生[5-6]。当然,FF较高并不意味胎儿发育良好,FF异常增高可能预示不良妊娠结局,如自发性早产[7-8]。本研究对18045例NIPS的游离FF进行分析,并结合孕妇的年龄、孕周、体质量指数(body mass index,BMI)以及高风险样本的FF,探讨FF的影响因素及其与染色体异常疾病的相关性。
1 资料与方法
1.1 资料来源 回顾分析2020年1月至2020年12月在郑州大学第一附属医院遗传与产前诊断中心自愿选择行NIPS的18045例孕妇的临床资料、FF以及高风险孕妇的妊娠结局。孕妇因唐筛异常(39.1%,7052/18045)、超声异常(11.1%,2008/18045)和高龄妊娠(16.7%,3022/18045)选择NIPS排除染色体异常,其他孕妇(33.1%,5963/18045)自愿选择NIPS。排除接受细胞治疗者、肿瘤患者、移植手术者和1年内异体输血者。本研究获得医院医学伦理委员会批准(2018-016),孕妇均签署知情同意书。
1.2 NIPS检测 采集孕妇外周血10mL保存在无创专用采血管;提取母体血浆游离DNA(cell-free DNA,cfDNA),使用10ng cfDNA构建文库,建库过程无需PCR扩增。文库定量后,利用基因测序仪(Nextseq CN500,美国)进行高通量测序,利用相关算法实现胎儿染色体疾病分析,并设置空白对照和阳性对照,结果采用Z值评分,正常范围为-3~3,Z>3或<-3为高风险。NIPS筛查高风险孕妇要求行穿刺术-染色体核型分析或全基因组拷贝数变异分析(CNV-seq)排除胎儿染色体异常。NIPS提示低风险结果,孕妇需定期进行超声诊断等相关检查。随访高风险孕妇的产前诊断和妊娠结局。
1.3 cffDNA比例计算方法 根据测序数据中DNA片段的分布情况和Y染色体片段所占比例,计算血浆中FF[9]。
1.4 侵入性产前诊断 常规消毒,超声辅助引导下行羊膜腔穿刺术。CNV-seq分析:提取样本DNA 1~1.5μg;将DNA打断、扩增,构建基因组文库;利用Nextseq CN500测序平台测序和分析数据。染色体核型分析:羊水细胞1600r/min离心10min,在沉淀物加入羊水培养基转移到细胞培养瓶,置37℃、5%CO2培养箱培养7d,更换培养液,继续培养至10~12d观察羊水细胞生长状态。生长良好的细胞加入秋水仙素,经37℃低渗、固定、制片、烤片、胰酶消化、G显带,利用染色体核型分析系统(MetaSystems Ikaros,德国蔡司)采集与分析染色体中期分裂相。核型按照人类细胞遗传学国际命名体制ISCN2020进行描述与诊断。
1.5 统计学处理 采用SPSS21.0软件。P<0.05为差异有统计学意义。
2 结 果
2.1 研究人群资料 收集了18045例孕妇的年龄、孕周、BMI、单胎/双(多)胎和妊娠方式等临床资料,见表1。从表1可以看出,孕妇孕周跨度较大,最大孕周36+4周,不符合国卫办妇幼发[2016]45号要求。临床上,若检测中心NIPS报告周期短,且孕妇强烈要求行NIPS,可考虑为因超声软指标异常的孕晚期孕妇行NIPS,排除胎儿染色体异常,减轻孕妇的焦虑心理。
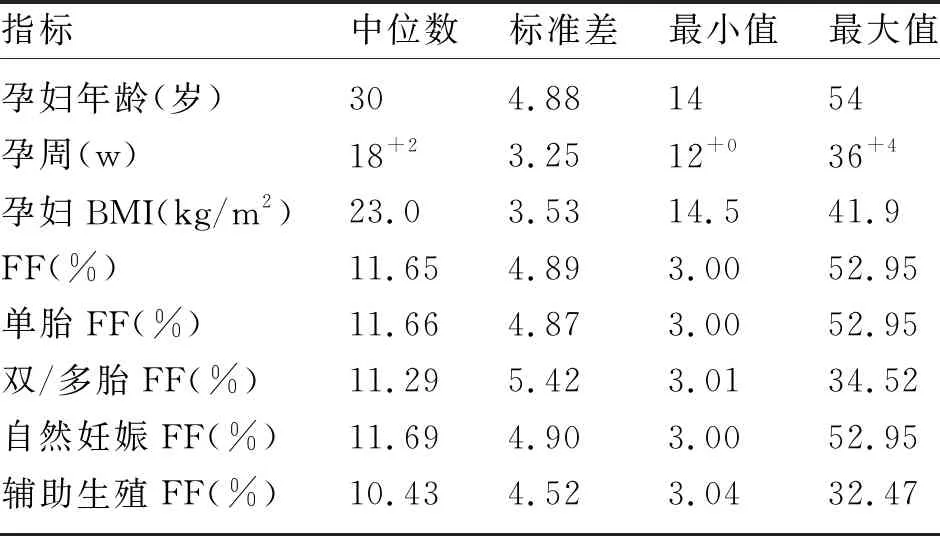
表1 18045例妊娠孕妇特征和胎儿比例
2.2 游离胎儿DNA比例分布 18045例妊娠游离FF的最小值和最大值分别为3.00%和52.95%,中位数11.65%(表1)。按分布例数>100例进行统计,FF主要分布在4%~25%。18045例妊娠孕妇中,单胎妊娠17363例,双/多胎妊娠682例;自然妊娠17104例,辅助生殖妊娠941例。单胎妊娠胎儿FF的最小值和最大值分别为3.00%和52.95%,中位数11.66%,平均值为12.32%;双/多胎妊娠胎儿FF的最小值和最大值分别为3.01%和34.52%,中位数11.29%(表1),平均值为11.82%。单胎和双/多胎妊娠胎儿FF之间存在差异(P<0.05)。自然妊娠胎儿FF的最小值和最大值分别为3.00%和52.95%,中位数11.69%(表1),平均值为12.35%;辅助生殖妊娠胎儿FF的最小值和最大值分别为3.04%和32.47%,中位数10.43%,平均值为11.26%。自然和辅助生殖妊娠胎儿FF之间存在差异(P<0.05)。
2.3 游离FF与孕妇年龄、孕周和BMI的关系 游离FF与孕妇年龄呈明显负相关(R2=0.8783,P<0.05),与孕周呈明显正相关(R2=0.9291,P<0.05),见图1A、B。随着孕妇年龄的增大,孕妇的BMI也明显增大(图1C)。孕妇BMI与游离FF均呈负相关(R2=0.8936,P<0.05)(图1D)。将大于1000例孕周的BMI进行分组(BMI≤21kg/m2,21~31kg/m2和BMI>31kg/m2),结果显示,除孕19周外,游离FF随着孕妇BMI的增大而逐渐减少,差异有统计学意义(P<0.05)。孕19周游离FF随着孕妇BMI增大而逐渐减少,BMI<21kg/m2组与其他两组均有统计学意义(P<0.05),21~31kg/m2组与BMI>31kg/m2组相比无统计学意义(P>0.05)。见表2。

图1 FF与孕妇年龄、孕周和BMI的关系

表2 不同孕周BMI分组与FF的关系
2.4 游离胎儿DNA比例与NIPS高风险胎儿的关系 行NIPS检测的18045例孕妇中,400例胎儿为高风险(表3),其中310例行产前诊断,确诊129例,总体阳性预测值(positive predictive values,PPVs)为41.61%,未做产前诊断或失访90例。低风险胎儿的游离FF(平均值为12.28%)与高风险胎儿的游离FF(平均值为13.17%)、真阳性胎儿的游离FF(平均值为13.90%)均存在差异(P<0.05);真阳性胎儿的游离FF(平均值为13.90%)与假阳性胎儿的游离FF(平均值为12.64%)之间存在差异(P<0.05),见图2。

表3 NIPS提示高风险胎儿的产前诊断

图2 NIPS提示不同风险胎儿的游离FF比较
18045例孕妇中,NIPS提示T21、T18和T13高风险分别为84、9例和7例,行产前诊断分别有77、6和6例,确诊分别有56、5和2例。随着T21、T18和T13的胎儿游离FF增加,Z值也增加,呈现正相关,但系数率分别为0.2313、0.3621和0.4173(图3)。由于样本例数的限值,进一步比较了T21真阳性胎儿的游离FF与Z值相关性(图3B),二者的相关性较T21高风险样本(图3A)提高,系数率为0.6555,提示胎儿染色体异常与游离FF呈一定的相关性。
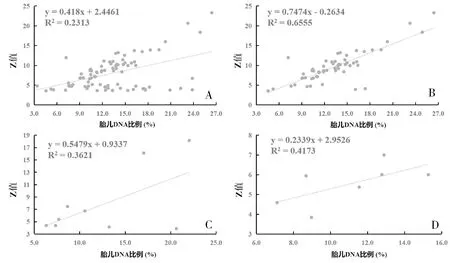
图3 NIPS提示T21、T18和T13高风险胎儿的Z值与FF的关系
微缺失综合征组的高风险样本(FF平均值12.73%)与真阳性样本(FF平均值15.84%)以及真阳性样本(FF平均值15.84%)与假阳性样本(FF平均值10.86%)之间差异显著(P<0.05)(图4A)。微重复综合征组的高风险样本、真阳性样本和假阳性样本之间没有差异(图4B)。SCAs组的真阳性样本(FF平均值13.90%)与假阳性样本(FF平均值11.39%)之间差异显著(P<0.05)(图4C)。
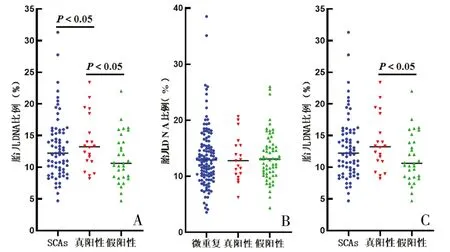
图4 NIPS提示微缺失综合征、微重复综合征和SCAs高风险胎儿的FF差异比较
3 讨 论
孕妇血浆游离DNA包括孕妇自身游离DNA和cffDNA,而cffDNA仅是其中一小部分,其影响因素很多,如孕妇年龄、孕周、孕妇体质量指数以及异常染色体等[4]。本研究结果显示,FF主要分布范围是4%~25%;FF与孕周呈正相关,与孕妇年龄和BMI呈负相关;异常胎儿的FF高于低风险胎儿的FF,且差异显著,与相关报道相符[10-11]。
自然妊娠情况下,双/多胎妊娠的概率约为1.1%。近年来,随着医源性促排卵药物、避孕药的使用和辅助生殖技术的应用,双/多胎妊娠比例增高。研究显示,无论是双绒毛膜妊娠还是单绒毛膜妊娠,胎儿的FF都低于单胎妊娠,但总FF高于单胎妊娠胎儿FF[12]。基于SNP技术的NIPS分析显示,双绒毛膜和单绒毛膜妊娠胎儿的组合FF分别比单卵妊娠胎儿高35%和26%[13]。也有研究显示,双胎妊娠的FF低于单胎妊娠[14-15]。本研究中,双/多胎妊娠682例,辅助生殖妊娠941例,单胎FF高于双/多胎,与Sarno等研究结果一致[14];自然妊娠胎儿FF高于辅助生殖妊娠胎儿,与Talbot等研究结果一致[16],但也与相关报道存在差异,可能原因包括:(1)本研究纳入妊娠孕妇人群复杂,不是单一类型孕妇[17];(2)结合单胎和双胎妊娠,多元逻辑回归分析表明,FF随着胎臀长度、PAPP-A、MOM和游离β-hCG MoM增加而增加,随孕妇年龄和BMI增加而降低[14];(3)辅助植入胚胎导致孕周计算发生不同或胚胎在孕妇体内生长发育速度与同期大小的自然妊娠胚胎不一致[18-19]。因此,双胎和辅助生殖妊娠胎儿的孕妇选择NIPS时,应推迟于单胎和自然妊娠胎儿的孕周。
本研究结果显示,T21、T18和T13的PPVs较低,尤其T21的PPVs为72.73%。许多因素如胎儿分数、限制性胎盘镶嵌(confined placental mosaicism,CPM)、母体拷贝数变异、母体恶性肿瘤、双胞胎消失、检测程序、分类算法(Z值评分)和测序平台都可能影响NIPS检测染色体异常的PPVs[17,20]。CPM可能是导致NIPS假阳性的主要原因之一[21]。一部分假阳性是由于标本Z值波动达到阈值,如T21的3
本研究显示,FF与孕妇孕周呈正相关,与孕妇BMI、年龄呈负相关,与先前研究相同[6,22-24]。Wang等[25]发现,妊娠21周以后,FF快速增加。最近研究报道,FF在妊娠20周后增加了10倍,且随着孕周增加而增加。原因是随着孕妇孕周增加,胎盘体积增大,胎盘滋养层细胞凋亡增多,释放到孕妇外周血液中的DNA片段增加,导致FF增加[26]。FF与孕妇BMI呈负相关的可能原因是孕妇体重增大导致其血液循环体系稀释了血浆中cffDNA,同时血液中相对增多的凋亡脂肪细胞增加了血浆中母亲游离DNA含量,导致cffDNA比例下降。FF与孕妇年龄的关系各研究结果不同,Hou等研究显示FF与孕妇年龄呈负相关[10],也有研究表明FF与孕妇年龄没有相关性[27]。本研究结果与Hou等[10]类似,孕妇BMI与年龄呈正相关,可能原因是随着年龄增加,孕妇的生理机制发生了变化,如体重增加,各种新陈代谢谱的改变,细胞凋亡增加等,导致FF下降[28-29]。综上,对于高龄和高BMI的孕妇选择合适孕周进行NIPS检测,且要关注FF,同时建议孕妇进行产前遗传咨询,控制体重,帮助提高NIPS的准确性。
本研究显示,高风险组胎儿FF与低风险组FF存在差异,真阳性组FF与低风险组和假阳性组FF存在差异,且T21、T18和T13的FF与Z值呈正相关,研究结果与相关文献报道一致[30]。关于NIPS提示异常与正常胎儿FF的差异存在不同研究结果。Kinnings等研究显示,与整倍体样本相比,T21阳性样本的FF整体上升,而T18和T13阳性样本的FF下降[6]。Rava等研究显示,与整倍体胎儿相比,21-三体胎儿的母体血浆中FF较高,18-三体、13-三体或X-单体母体血浆中FF较低[27]。研究显示,与整倍体样本相比,T21样本在妊娠16周后FF相对增加,而T18和T13样本的FF在妊娠21周和18周后相对下降[6],这可能是临床上T21筛查的敏感性和特异性接近100%的原因。本研究中,NIPS提示微重复综合征高风险胎儿的例数(119/18045)大于微缺失综合征高风险胎儿(74/18045),但微缺失综合征的PPVs(40.63%)高于微重复综合征的PPVs(23.46%)。根据两组FF差异的比较,猜测微缺失综合征PPVs高于微重复综合征PPVs的可能原因是微缺失导致单倍剂量不足,微重复导致三倍剂量敏感,但单倍剂量不足比三倍剂量敏感在剂量敏感性上对机体的影响更大[31-32]。此外,在临床中,微缺失更有可能是致病性,而微重复一般难以解释,比微缺失使用更大的阈值[31-32]。
本研究从不同角度比较了游离FF的差异,高风险胎儿FF高于低风险胎儿。孕妇血浆cffDNA水平受母体和胎儿特征的共同影响。临床实践中,应根据孕妇特征以及FF进行NIPS的遗传咨询,如孕妇为双/多胎或辅助生殖妊娠,建议适当推迟孕周行NIPS,确保结果的准确性。

