染色体微阵列分析技术在复发性自然流产遗传学诊断中的应用*
李一鸣,周 冉,孟露露,夏政怡,焦 娇,胡 平,许争峰,王 艳
[南京医科大学附属妇产医院(南京市妇幼保健院)产前诊断中心,南京 210004]
自然流产是妊娠早期最常见的并发症,发生率约为15%,其中80%发生在妊娠前三个月[1-2]。自然流产按流产次数可分为偶发性自然流产(sporadic abortion,SA)和复发性自然流产(recurrent miscarriage,RM)。2019年美国生殖医学学会(American Society for Reproductive Medicine,ASRM)将RM定义为两次或两次以上的临床妊娠丢失[3],其发生率约为5%[4-5]。RM病因复杂,主要包括遗传、母体、环境及男方因素等,其中胚胎染色体异常是最常见的原因,约占30%~57%[6]。2019年ASRM指南推荐RM行遗传学检查,通过对流产物进行胚胎遗传学检查,可明确RM的遗传学病因,减轻患者心理负担,并为遗传咨询和下一次妊娠风险评估提供重要信息[3]。
传统的G显带染色体核型分析是RM遗传学检测的金标准,可检出多倍体、异倍体、嵌合体和大部分染色体大片段结构异常,但无法发现10Mb以下的染色体拷贝数异常(copy number variations,CNVs),且存在检测周期长、母体细胞污染(maternal cell contamination,MCC)和培养失败率高等局限性[7]。荧光原位杂交技术(fluorescence in situ hybridization,FISH)无需细胞培养,但仅能对几条特定染色体行异倍体检查,检测能力有限[8]。近年来,随着高分辨率分子遗传学检测技术的发展,染色体微阵列分析(chromosomal microarray analysis,CMA)在临床上已被广泛应用于自然流产病例的遗传学病因检测[7]。该技术可在全基因组水平内同时检测染色体数目异常、大片段结构异常、染色体微缺失微重复和单亲二体(uniparental disomy,UPD)等,具有分辨率高、检测周期短、成功率高和通量高等优势。张等[9]研究显示,CMA相较于传统核型技术,在早期流产胚胎中能额外检测出4.3%的致病性微缺失/微重复(CNVs<10Mb)。既往RM遗传学研究样本量较小(51~777例)[6,8],且侧重于评估异倍体与RM的相关性[10],微缺失/微重复与RM的相关性报道较少,并且关于流产次数与胚胎染色体异常率的关系存在争议[11-12]。本研究采用CMA技术对1355例RM病例行胚胎遗传学检查,评估CMA技术在RM遗传学诊断中的应用价值,并进一步探讨流产次数与胚胎染色体异常率的关系以及复发性(≥2次)致病性微缺失/微重复与RM的相关性。
1 资料与方法
1.1 研究对象 选取2011年8月至2021年9月在南京医科大学附属妇产医院就诊的1355例RM病例,采用新鲜流产绒毛行CMA检测。RM定义为2次及以上的自然流产。患者平均年龄为30.9岁(21~44岁),平均孕周为9.5周(6~14周)。患者行CMA检测前均已签署知情同意书,本研究获得南京市妇幼保健院医学伦理委员会批准。
1.2 方法 采用组织提取试剂盒(QIAGEN公司,德国)从流产绒毛样本中提取基因组DNA。采用HumanCytoSNP-12芯片(Illumina,美国)和CytoScan750K芯片(Affymetrix,美国)对绒毛DNA进行CMA检测,按标准实验方法进行操作[13]。CMA检出MCC的绒毛标本进一步行荧光定量聚合酶链反应(quantitative fluorescent polymerase chain reaction,QF-PCR)检测确定胚胎绒毛与母体蜕膜的比例。MCC比例超过30%为重度MCC,重度MCC病例排除在外。根据美国医学遗传学和基因组学学会(American College of Medical Genetics and Genomics,ACMG)和临床基因组资源机构(ClinGen)制定的CNVs致病性评估指南[14],将CNVs分为以下5类:致病性CNVs、可能致病性CNVs、临床意义不确定的CNVs(variant of uncertain significance,VOUS)、可能良性CNVs和良性CNVs。可能良性和良性CNVs不予报告。
1.3 统计学处理 采用SPSS 23.0统计软件,计数资料以例数和频率(%)表示,采用卡方检验或Fisher确切概率法进行组间统计学比较,采用二元logistic回归矫正母亲年龄,分析胚胎染色体异常检出率与既往流产次数的关系。P<0.05为差异有统计学意义。
2 结 果
2.1 临床特征 排除14例(1.0%,14/1355)重度MCC病例,共1341例RM病例纳入最终研究。1341例RM病例中,<35岁组1096例(81.7%,1096/1341),35~39岁组184例(13.7%,184/1341),≥40岁组61例(4.5%,61/1341);流产2次968例(72.2%,968/1341),3次294例(21.9%,294/1341),≥4次79例(5.9%,79/1341)。
2.2 总体致病性染色体异常的频率及分布 RM病例中总体致病性染色体异常检出率为60.6%(813/1341),其中异倍体44.5%(597/1341)、多倍体8.4%(113/1341)、大片段结构异常(>10Mb)为5.0%(67/1341)、致病性微缺失/微重复(<10Mb)为1.9%(25/1341)、UPD为0.8%(11/1341)。RM病例致病性染色体异常的频率及分布,见表1。

表1 RM病例致病性染色体异常的频率及分布
2.3 染色体数目异常及UPD 本研究共发现染色体数目异常710例(52.9%,710/1341),包括单个异倍体564例(42.0%,564/1341),多个异倍体33例(2.5%,33/1341),多倍体113例(8.4%,113/1341)。单个异倍体中以常染色体三体最常见(81.4%,459/564),其次是X染色体单体(17.0%,96/564),常染色体单体(1.2%,7/564)和性染色体三体(0.4%,2/564)相对少见。33例多个异倍体病例中,包含双重三体22例,三重三体3例(1例49,XX,+14,+18,+20、1例49,XX,+7,+13,+16和1例49,XX,+6,+10,+21),四重三体1例(50,XXX,+2,+7,+9),单体合并三体5例(1例46,X,+7、1例46,X,+18、1例46,X,+8、1例46,X,+9和1例47,XXX,-13,+15),1例48,XXXY和1例48,XY,+16,+16。113例多倍体中,检出三倍体91例(6.8%,91/1341),亚三倍体8例(0.6%,8/1341),超三倍体10例(0.7%,10/1341),四倍体4例(0.3%,4/1341)。本研究还检出11例全基因组UPD(0.8%,11/1341)。
2.4 致病性CNVs 共检出92例致病性CNVs,其中大片段结构异常67例(5.0%,67/1341),致病性微缺失/微重复25例(1.9%,25/1341),CNVs片段大小从0.24Mb至91.89Mb不等。CNVs在染色体中的分布见图1,除14号染色体外,其余染色体均检出致病性CNVs,其中6号和8号CNVs最常见。大片段结构异常在8号和6号染色体最常见,致病性微缺失/微重复在16号和22号染色体最常见。67例染色体大片段缺失/重复中,检出“末端缺失/重复”15例(1.1%,15/1341),“中间缺失/重复”5例(0.4%,5/1341),“末端缺失+末端重复”21例(1.6%,21/1341),“多个缺失和(或)重复”26例(1.9%,26/1431)。67例大片段异常病例中,42例进行了双亲溯源检查,发现8例平衡易位:母系遗传3例,包括t(8;16)(q22;q12),t(11;17)(q21;q23),t(2;8)(q32;q21.2);父系遗传5例,包括t(5;10;18)(q31;q23;q21),t(11;15)(p15;q24),t(4;10)(q35;q26),t(1;6)(q42;p23),t(13;20)(q12;p12),其余均为新发变异。25例致病性微缺失/微重复中,检出“末端微缺失/微重复”7例(0.5%,7/1341),“中间微缺失/微重复”16例(1.2%,16/1341),“多个微缺失和/微重复”2例(0.2%,2/1341),其中15例行双亲溯源检查,发现4例遗传自双亲之一:3例(病例12、13和24)为母系遗传,1例(病例17)为父系遗传,其余11例为新发变异,见表2。本研究共检出5个重复出现(n=2)的致病性微缺失/微重复(15q11.2、19p13.3、22q13.2q13.33微缺失和17p13.3、22q11.1q11.21微重复),见表3。
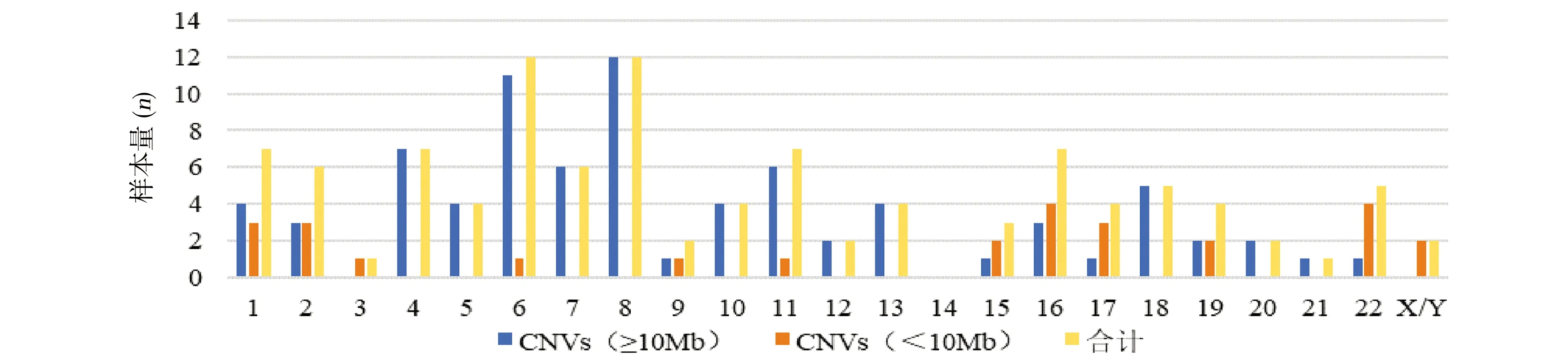
图1 RM病例中不同染色体CNVs分布情况

表2 25例致病性微缺失/微重复CMA结果

表3 RM病例中复发性微缺失/微重复
2.5 年龄和流产次数与胚胎染色体异常的关系 年龄<35岁组、35~39岁组以及≥40岁组胚胎染色体异常检出率分别为57.6%、70.7%和85.2%,35~39岁组以及≥40岁组胚胎染色体异常检出率均明显高于<35岁组(P<0.01);母亲年龄<35岁组、35~39岁组以及≥40岁组胚胎异倍体检出率分别为39.8%、62.5%和75.4%,35~39岁组以及≥40岁组胚胎异倍体检出率均明显高于<35岁组(P<0.01);多倍体、CNVs≥10Mb、CNVs<10Mb、UPD在不同年龄组间差异均无统计学意义(P>0.05)。不同类型胚胎染色体异常检出率在母亲年龄35~39岁组和≥40岁组间均无明显差异。母亲年龄与胚胎染色体异常的关系见表4。

表4 母亲年龄与胚胎染色体异常的关系[n(%)]
孕妇流产2次、3次和≥4次组病例的胚胎染色体异常率分别为62.6%、56.5%和51.9%;矫正母亲年龄后,流产2次组病例的染色体异常率显著高于流产次数3次、≥4次组(P<0.05)。孕妇流产2次组异倍体检出率显著高于流产次数3次组(46.4% vs 38.8%,P<0.01),而多倍体、CNVs≥10Mb、CNVs<10Mb、UPD在不同流产次数组间差异均无统计学意义,见表5。

表5 自然流产次数与胚胎染色体异常的关系[n(%)]
3 讨 论
本研究旨在探讨CMA在RM遗传学诊断中的应用价值。本研究中RM病例的总体染色体异常检出率为60.7%,与既往报道相符(50%~70%)[2,11]。本研究中最主要的染色体异常类型为异倍体,检出率为44.5%,其次分别是多倍体(8.4%)、致病性大片段缺失/重复(≥10Mb)(5.0%)和致病性微缺失/微重复(<10Mb)(1.9%)。在异常染色体类型中占比最小的是UPD,检出率为0.8%。本研究中RM胚胎不同类型染色体异常频率与程丹等[15]研究报道相近。CMA技术检测分辨率高、实验周期短、检测成功率高、通量高,在RM病因学研究中具有重要临床价值,能为再次生育提供完善、精准的遗传学信息。
染色体数目异常是RM最常见的原因,并以异倍体最多见。本次研究的异倍体和多倍体的频率(44.5%和8.4%)与其他大规模研究报道(37.7%和8.2%)基本一致[16]。异倍体病例中,16号染色体三体最常见,占染色体数目异常的15.6%(111/710)。其余异倍体异常主要集中在X染色体单体和22号染色体三体,这与Pylyp等[17]报道基本一致。除19号染色体外,其余所有染色体都检出了异倍体。目前普遍认为,生殖细胞减数分裂长期停滞、暴露于环境污染物等情况下,卵母细胞易错误分离并将异倍体传递给下一代。异倍体的发生大多是因配子形成中偶发的分离错误,因此异倍体流产患者相比染色体正常流产患者预后更好[13]。三倍体是RM最常见的多倍体类型,检出率为6.8%,超三倍体、亚三倍体、四倍体相对少见,检出率分别为0.7%、0.6%和0.3%。当出现双雄受精、双雌受精、核内复制及核内有丝分裂等异常配子情况时,就会导致多倍体的发生。此外,本研究还检出11例全基因组UPD(0.8%),与Finley等[18]研究(0.8%)一致。
染色体大片段结构异常是RM的重要遗传学病因[18]。本研究中致病性大片段结构异常的检出率为5.0%,高于Kowalczyk等[16]研究中的3.2%,可能与不同研究中RM定义不同有关。染色体“末端缺失+末端重复”通常提示胚胎存在染色体不平衡易位,考虑双亲之一可能是平衡易位携带者。本研究中67例大片段异常中,42例进行了双亲溯源检查,发现8例病例遗传自双亲之一,其余均为新发变异。既往文献报道,夫妇之一为平衡易位携带者,下一次妊娠流产的发生率为55.6%,活产率为42.9%[19]。为避免再次流产或生育染色体结构异常患儿,建议平衡易位携带者夫妇下一次妊娠行胚胎植入前遗传学诊断(preimplantation genetic test,PGT)或自然受孕后孕中期行介入性产前诊断。RM病例行胚胎流产物CMA检测可为再次妊娠提供精准的风险评估及遗传咨询。
RM与特定微缺失/微重复的相关性尚未明确。本研究中致病性微缺失/微重复的发生率为1.9%,略高于Zhu等[7]研究中的1.2%。25例致病性微缺失/微重复RM病例中,4例是遗传性的(3例为母系遗传,1例为父系遗传)。Xp22.31微缺失(病例24)可导致X连锁鱼鳞病(X-linked ichthyosis,XLI),与位于X染色体短臂的类固醇硫酸酯酶基因(STS)缺失、突变有关,通常出生后3个月内开始发病,患者全身皮肤干燥、粗糙,覆盖褐色鳞片。本病为X染色体连锁隐性遗传方式,几乎全部见于男性,在男性新生儿中的发病率为1/2000~1/9500[20],女性为携带者极少发病。XLI女性携带者的男性后代中有50%为患者,女性后代有50%为携带者。其余2例16号染色体微缺失(病例13,16p13.11微缺失;病例12,16p11.2微缺失)病例的母亲表型均正常,考虑可能与不完全外显有关[21]。16p13.11区段缺失可导致“16p13.11微缺失综合征”,可引起神经功能障碍如智力发育迟缓、自闭症、多动症、精神分裂症、癫痫和学习困难,以及脑皮质发育异常等临床表型,该微缺失外显率约为13.1%[21]。16p11.2区段缺失可导致末端型16p11.2微缺失综合征(BP2-BP3),包含关键基因(SH2B1,ATP2A1,CD19),该综合征常见的临床表型包括智力低下、自闭症、癫痫,以及少见的表型如肥胖、半椎体等,该微缺失的外显率约62.4%[21]。对于携带不完全外显的致病性CNVs的夫妇,考虑到尽管可以在孕中期进行介入性产前诊断,但仍无法确定胎儿出生后是否外显发病,通常建议携带者夫妇下次妊娠选择PGT避免该CNVs的传递。值得关注的是,本研究还发现5个重复出现(n=2)的致病性微缺失/微重复(15q11.2、19p13.3、22q13.2q13.33微缺失和17p13.3、22q11.1q11.21微重复)。既往多篇研究在RM病例中检测发现了15q11.2、19p13.3微缺失和17p13.3、22q11.1q11.21微重复[12,22]。本研究进一步表明以上微缺失微重复可能与RM相关。此外,本研究首次发现,22q13.2q13.33微缺失可能与RM相关。22q13区段(包含关键致病基因SHANK3)的微缺失可导致Phelan-McDermid综合征,临床表现为发育迟缓、男性生殖器异常、肌张力低下、语言障碍、中度至重度智力低下、自闭症等[23],该微缺失导致RM的致病机制还需进一步研究。上述微缺失/微重复与RM的相关性还需进一步大规模研究以及功能实验来证实。
此外,本研究还发现,母亲年龄≥35岁的胚胎染色体异常率明显高于<35岁者(74.3% vs 57.6%,?偅iP<0.01),染色体异常率在母亲年龄35~39岁和≥40岁两组间并无显著差异。异倍体检出率在<35岁组、35~39岁组和≥40岁组分别为57.6%、70.7%和85.2%,提示异倍体的发生随着母亲年龄增加而增加,这与高龄孕妇卵母细胞核心囊成分表达减少、线粒体功能障碍和重组失败概率增加从而导致异倍体发生率增加有关[17]。然而RM病例中多倍体、CNVs≥10Mb、CNVs<10Mb、UPD的检出率在不同年龄组中无显著差异,这提示母体年龄可能并不是多倍体、CNVs≥10Mb、CNVs<10Mb、UPD这些异常类型的独立危险因素,这与沈晔等[24]研究报道结果相符。
胚胎染色体异常率与流产次数的相关性目前存在争议。Sheng等[12]认为,胚胎染色体异常率与流产次数无明显相关性。Ogasawara等[11]研究报道,胚胎染色体异常率随既往流产次数的增加而减小。虽然既往流产次数分组不同和胚胎染色体异常的分类不同可能是导致结论不一致的原因,但是既往研究并未矫正母亲年龄因素可能是主要因素。目前普遍认为胚胎染色体异常率随着母亲年龄增加而增加[6,11],母亲年龄作为混杂因素降低结论可信度。本研究中,矫正母亲年龄后,流产2次组病例的染色体异常率显著高于流产次数3次和≥4次组。孕妇流产2次组异倍体检出率显著高于流产次数3次组,而多倍体、CNVs≥10Mb、CNVs<10Mb、UPD的发生率似乎与流产次数无关。综上,本研究认为,随着既往流产次数增多,胚胎染色体异常率会降低,这可能与随着流产次数增多,其他原因在RM中起到的作用逐渐增大,胚胎染色体随机异常原因占比逐渐减小有关[11]。
综上所述,CMA技术具有分辨率高、检测周期短、成功率高和通量高等优势,对RM遗传学病因的评估具有重要价值,能为再次生育提供精准的风险评估及妊娠方式选择等遗传咨询。本研究发现5个RM相关的复发性致病性微缺失微重复,其中22q13.2q13.33微缺失是新发现的可能与RM相关的致病性微缺失,再次证实CNVs在RM的发病机制中起着重要作用,为RM的病因学研究提供了新的思路。

