妊娠期糖尿病孕妇孕中期糖脂代谢指标与大于胎龄儿的相关性研究
赵胡英,潘石蕾
(1.深圳市宝安区妇幼保健院产科,深圳 518101;2.南方医科大学珠江医院妇产科,广州 510282)
妊娠期糖尿病(gestational diabetes mellitus,GDM)是指妊娠前糖代谢正常,妊娠期才出现的糖尿病[1]。GDM是最常见妊娠并发症之一,对母儿有近期和远期的不良影响,大于胎龄儿(large for gestational age,LGA)是GDM常见的不良妊娠结局之一。LGA是指出生体重大于同性别、同胎龄儿平均体重第90百分位数,其结合胎龄考虑,能更全面地反映新生儿出生体重情况及其出生后相关的近期临床结局。研究表明,LGA增加孕妇剖宫产、产后出血、肩难产和产道裂伤的风险,同时增加子代远期超重或肥胖、糖尿病、成年期代谢综合征等风险[2-3]。目前用于评估LGA的方法主要通过孕晚期超声测量,但预测时间晚、可干预时间短。本研究通过探讨GDM孕妇孕中期糖脂代谢与LGA的相关性,寻找其发生LGA的可能危险因素,改善母婴结局。
1 资料与方法
1.1 资料与方法 选取2021年2月1日至2022年1月31日于深圳市宝安区妇幼保健院产检并分娩的GDM孕妇2114例,按新生儿出生体重分为LGA组(229例)和非LGA组(1885例)。纳入标准:临床资料完整;孕24~28周于本院行75g口服葡萄糖耐量试验,诊断为GDM。GDM诊断标准:空腹血糖≥5.1mmol/L,服糖后1h血糖≥10mmol/L,服糖后2h血糖≥8.5mmol/L。排除标准:(1)年龄<18岁或>40岁,多胎妊娠或妊娠结局为引产、流产、死胎的孕妇;(2)有甲状腺疾病、高血压疾病、自身免疫性疾病(如系统性红斑狼疮、抗磷脂综合征)及严重内外科疾病;(3)临床资料不完整。
1.2 分组标准 按2020年发布的《中国不同出生胎龄新生儿出生体重、身长和头围的生长参照标准及曲线》标准[4]将新生儿体重分为LGA组和非LGA组。
1.3 观察指标 一般资料包括孕妇年龄、孕次、产次、孕前BMI、GDM诊断孕周、分娩孕周、学历水平、巨大儿史、GDM史、不良孕产史、GDM家族史;临床资料包括空腹血糖、服糖后1h血糖、服糖后2h血糖、糖化血红蛋白(HemoglobinA1c,HbA1C)、总胆固醇、甘油三脂(Triglyceride,TG)。

2 结 果
2.1 一般资料 2114例GDM孕妇中分娩LGA新生儿229例,发生率10.83%。LGA组的孕妇年龄、孕前BMI、孕次、产次、巨大儿史发生率均高于非LGA组,差异有统计学意义(P<0.05)。两组的分娩孕周、学历水平、GDM史、不良孕产史、GDM家族史比较,差异无统计学意义(P<0.05)(表1)。
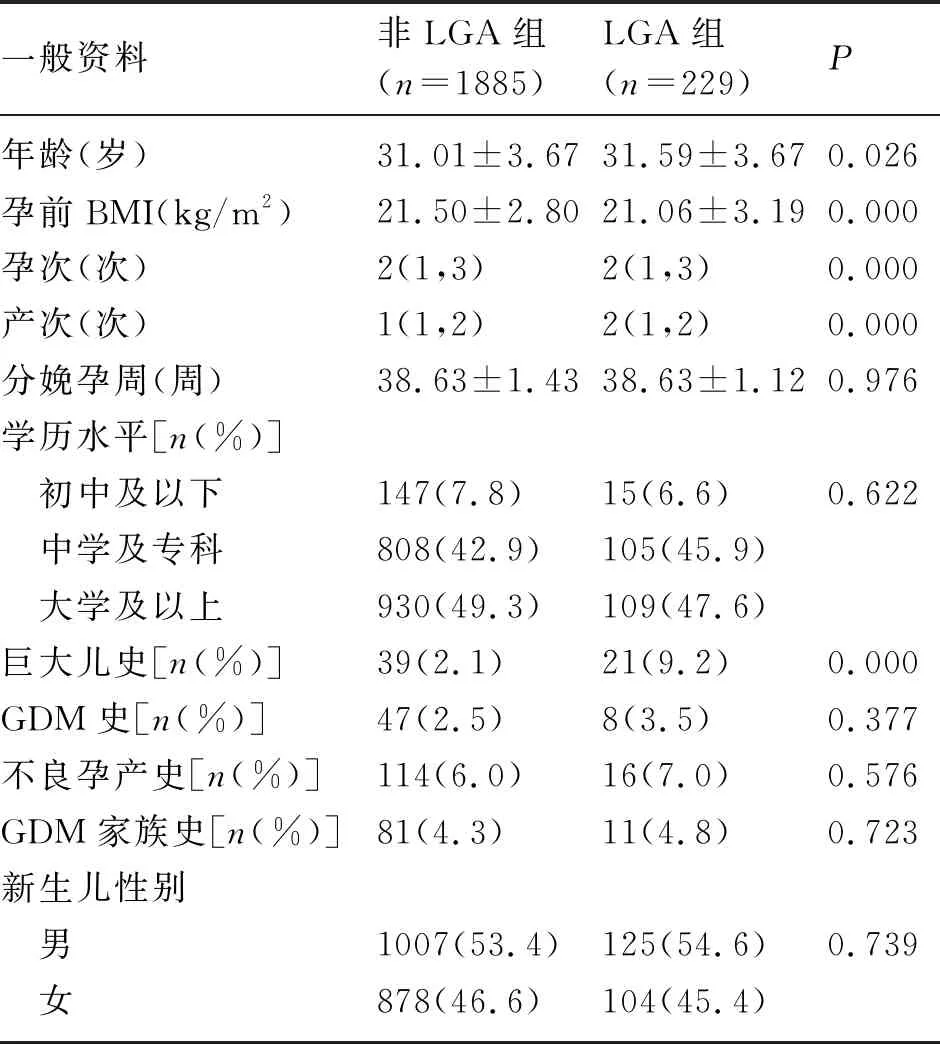
表1 孕妇一般资料比较
2.2 孕中期糖脂代谢指标 LGA组和非LGA组的空腹血糖、TG及HbA1C比较,差异有统计学意义(P<0.001);两组的服糖1h血糖、服糖2h血糖、总胆固醇比较,差异无统计学意义(P>0.05)。见表2。

表2 孕中期糖脂代谢指标比较
2.3 LGA高危因素分析 将LGA作为因变量,纳入孕前BMI、年龄、孕次、产次、巨大儿分娩史、空腹血糖、HbA1C、TG作为自变量,二元logistic回归多因素分析结果显示,孕前BMI、产次、巨大儿分娩史、空腹血糖、TG是LGA发生的高危因素(OR>1,P<0.05)(表3)。

表3 LGA的多因素logistic回归分析
2.4 孕中期空腹血糖及甘油三脂对大于胎龄儿的预测价值 ROC曲线分析孕中期空腹血糖及甘油三脂预测大于胎龄儿的相关性价值,曲线下面积分别为0.624(95%CI为0.586~0.662,P=0.000)及0.597(95%CI为0.559~0.634,P=0.000)。见图1。
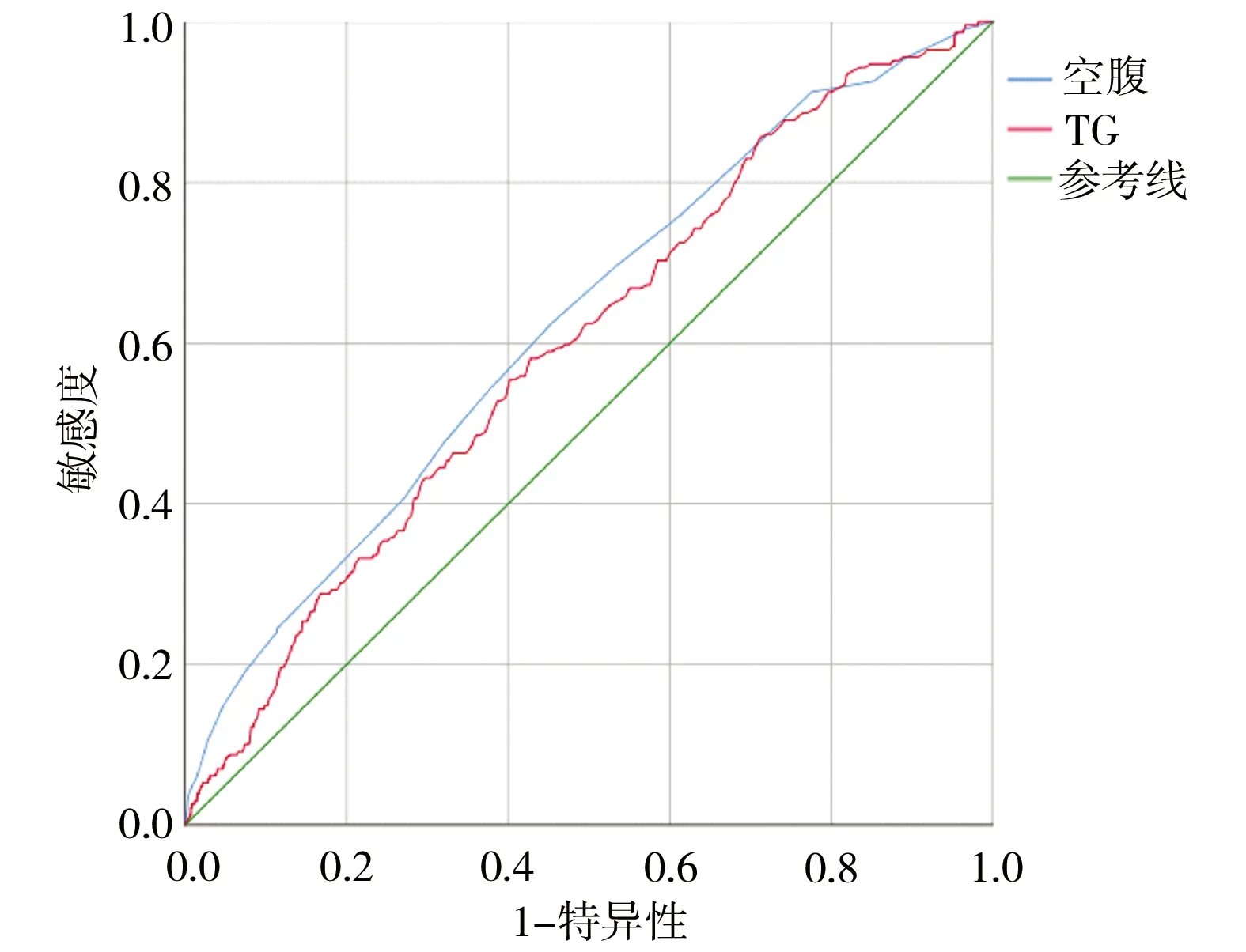
图1 空腹血糖及TG预测大于胎龄儿的ROC曲线
3 讨 论
近年来,GDM孕妇发生率逐渐增长。meta分析结果显示,GDM孕妇分娩巨大儿的风险是非GDM孕妇2.81倍,分娩LGA儿的风险是非GDM孕妇的1.87倍[5]。2011年对全国14个省101723例单胎新生儿调查发现,巨大儿发生率为7.3%,其中北方地区高于南方地区。2010年广州市对6562例产妇的调查发现,巨大儿发生率为2.9%,LGA发生率为8.2%[6]。本研究2114例GDM孕妇中分娩巨大儿86例,发生率4.07%;分娩LGA新生儿229例,发生率10.83%。
高血糖和不良妊娠结局研究(the hyperglycaemia adverse pregnancy outcome study,HPAO)发现,妊娠24~28周的OGTT值与LGA相关,但OGTT各时间点血糖值对新生儿出生体重的影响程度尚不明确。研究发现,GDM孕妇空腹血糖和OGTT 1h血糖水平可预测LGA[7]。但更多证据支持空腹血糖升高与LGA的强相关性[8]。这一现象可用胰岛素抵抗机制来解释。肝脏是维持血糖恒定的关键器官,主要受胰岛素调节。肝细胞发生胰岛素抵抗时,夜间过量分解肝糖原和糖异生,产生过多葡萄糖导致空腹高血糖。胰岛素抵抗也导致胰岛素水平升高,研究表明孕妇胰岛素抵抗是巨大儿的独立预测因素。孕妇高血糖通过胎盘可引起胎儿高血糖,刺激胎儿胰岛素分泌增加,导致胎儿高胰岛素血症。大量的葡萄糖在胎儿体内被代谢,导致脂肪和蛋白质的储存增加,促使胎儿生长加速[9-10]。
HbA1C可反映近2~3个月平均血糖水平,较血糖稳定,但不能反映每天血糖的动态变化。2022年ADA指南建议,妊娠中、晚期无低血糖风险孕妇HbA1C控制在6%以内,可减少LGA、子痫前期、早产等不良结局的发生率[11]。研究认为,孕妇HbA1C持续高水平与不良妊娠结局相关,单一时期升高无明显相关性[12]。本研究中两组间HbA1C水平差异有统计学意义(P<0.05),孕中期HbA1C并不是LGA的独立危险因素。可能是因本研究2114例孕妇中HbA1C>6%仅有20例,样本量不足,且没有动态比较孕早期及孕晚期的HbA1C水平。
在妊娠期由于雌激素的影响,可发生生理性血脂水平增高。脂肪组织分泌多种蛋白质激素、细胞炎性因子来调节机体的能量代谢。孕期母体的TG和TC可被胎盘吸收、代谢并以各种形式运输到胎儿体内,这两种脂质在一定范围内升高有利于胎儿的发育和生长,然而脂质水平过高导致胎儿过度生长。并且GDM孕妇胰岛B细胞功能受损发生了胰岛素抵抗,而血脂增高亦可导致胰岛素抵抗,二者叠加胰岛素抵抗明显加重。Khaire等[13]报道,产妇TC水平与新生儿出生体重呈正相关。研究表明,孕妇足月TG水平与较高出生体重呈正相关,是新生儿出生体重的独立预测因子,但孕妇TC水平与出生体重无关[14]。本研究发现,LGA组孕妇的TC、TG水平高于非LGA组,而仅TG组间差异有统计学意义(P<0.05)。多因素logistic回归中,TG水平仍是LGA的独立危险因素。美国一项纳入54371例孕妇的前瞻性队列研究[15]显示,有巨大儿分娩史的妇女再次发生巨大儿的风险更高,复发率为23.2%(95%CI为21.2%~25.2%),且先前巨大儿婴儿数量与再次发生巨大儿风险呈正相关。本研究多因素logistic回归分析显示,巨大儿分娩史是LGA最主要的危险因素(OR=3.516,95%CI为1.957~6.318)。虽然这一因素无法控制,但其有助于LGA的预测。
综上所述,预测LGA较困难,其价值主要在于预防与分娩相关的并发症。孕中期空腹血糖及TG与LGA发生相关,但单一指标对LGA的预测意义价值不高;巨大儿分娩史是LGA最主要的危险因素,有助于LGA的预测,但这一因素无法控制。有待进一步研究以寻找妊娠早中期较为敏感的指标预测LGA。

