中药熏蒸在老年性骨质疏松病理性骨折椎体成形术后的快速康复治疗中的应用
周油山 邱 林 何忠明
(江西省大余县人民医院外二科,江西 大余 341500)
随着年龄的增长人体内的骨量会逐渐降低,骨结构发生负面变化导致骨头变脆,骨折发生率增高,患上老年性骨质疏松这一种代谢性骨病[1]。据统计,该病的主要发病人群为老年人,多发生脊椎压缩性骨折,仅北美地区每年发生脊柱性骨折的患者便约有16万例[2]。目前常用椎体成形术(Percutaneous Vertebroplasty,PVP)来治疗骨质疏松性椎体压缩性骨折,但由于治疗对象的年龄普遍较大且伴随骨质疏松,因此术后仍有残留疼痛、康复速度慢的现象。快速康复外科(Fast Tract Surgery,FTS)[3]是指将麻醉、护理和外科等领域的最新研究成果结合在一起,形成一套经过临床实践证实的行之有效的围术期护理措施,可以促进术后快速康复。中药熏蒸是将热药蒸气作为治疗因子的化学、物理综合疗法,可直达病灶,且对脾胃刺激小,在临床中被广泛应用[4]。基于此,我院提出中西医结合治疗发挥各自优势,在PVP术后将FTS结合中药熏蒸以促进患者术后恢复,现将相关结果报告如下。
临床资料
1 一般资料:将我院2019年1月-2020年6月收治的老年性骨质疏松病理性骨折PVP术后的患者80例作为研究对象。根据随机数字表法将研究对象分为2组,即对照组40例、观察组40例。对照组患者进行基于FTS的常规治疗,观察组在接受相同常规治疗的同时加以自拟中药熏蒸治疗。观察组40例,男22例,女18例;年龄53-70岁,平均年龄为(60.5±10.5)岁;体质指数18-27 kg/m2,平均为(21.82±2.44)kg/m2;累及节段:L120例,L218例,L32例。对照组40例,男20例,女20例,年龄54-69岁,平均年龄为(59.5±8.5)岁;体质指数18-28 kg/m2,平均为(21.88±2.47)kg/m2;累及节段:L121例,L218例,L31例。2组患者年龄、性别等一般资料比较,差异不显著(P>0.05)。本研究通过医院伦理委员会审核批准。(1)纳入标准:①符合研究症状的诊断标准[5],经体格检查、骨密度测定、影像学检查等确诊;②无神经受损病症;③腰背部疼痛明显;④患者及家属均知情同意,并签署知情同意书;⑤患者对治疗所用的手术无禁忌证。(2)排除标准:①患严重肝肾功能病者;②合并严重消化系统疾病患者;③脑血管疾病、颅内占位性病变;④病理性骨折;⑤凝血功能障碍、全身感染等。
2 方法:2组均接受常规护理。包括术后心电监测、观察患者生命体征、腿部功能锻炼、预防并发症、预防切口感染护理等。对照组在常规护理基础上采取FTS治疗。(1)术后3天-2周:①俯卧位锻炼:患者取俯卧位进行锻炼背部肌肉,同时缓慢抬高左上肢及右下肢,尽量使左肩部及右髋部抬离床面,保持10秒左右,相同方法锻炼右上肢及左下肢,双侧锻炼各完成10次/组,每次锻炼5组。②仰卧位锻炼:患者取仰卧位锻炼腰、腿部肌肉,患者双上肢平放于身体两侧,保持头部上肢躯干不离开床面,屈髋屈膝并抬高,在空中进行蹬自行车运动,保持动作缓慢有力、节奏均匀,10次/组,每次锻炼5组。(2)术后1个月:①俯卧位锻炼:患者取俯卧位进行锻炼,屈膝、屈肘,以膝、肘4点支撑于床面,尽量保持上臂、大腿与床面垂直,缓慢抬高下肢及小腿离开床面,保持10秒左右后缓慢放下,10次/组,每次锻炼5组。②直立位锻炼:患者取站立位,抬头、挺胸、收腹,身体保持直立,身体重心置于左腿,缓慢屈膝、屈髋,抬高右腿,保持10秒左右后缓慢放下,相同方法锻炼对侧下肢,双侧锻炼各完成10次/组,每次锻炼5组。训练过程中动态评估患者腰部及双下肢功能,并适当增加训练时长及频次,可增至每次训练30-45分钟,4-5次/w。观察组在上述治疗基础上增加中药熏蒸治疗。中药方为:海桐皮15g、制乳香8g、透骨草15g、制没药8g、花椒15g、川芎15g、红花8g、威灵仙15g、白芷15g、小茴香10g、防风10g、乌药10g、艾叶15g,对于腰部疼痛严重患者可加桑寄生10g。将以上药物放入1000 ml纯净水中浸泡、煮沸,并使用科瑞KR-xZ-2008熏蒸治疗机对患者的骶部进行熏洗,具体操作为:暴露患者腰部,并铺盖治疗巾后开始熏蒸,调整熏蒸仪药液温度为85℃-100℃,蒸汽温度为40℃-44℃,可根据患者自身情况调整,以全身出汗为宜。熏洗每天1次,每次30-40分钟,每1-2周为1疗程。2组患者出院后进行门诊随访。
3 观察指标及疗效评价标准:(1)疼痛程度。术后24小时、7天时对2组患者使用视觉模拟评分法(visual analogue scale,VAS)[6]进行评分,将痛觉量化为0-10之间的数字,0为无痛,10为无法忍受的剧烈疼痛。(2)腰椎功能。对2组患者在出院、术后3个月使用Oswestry功能障碍指数(Oswestry disability index,ODI)[7]和日本腰椎矫形外科学会(Japanese Orthopaedic Association,JOA)[8]评价患者腰椎功能,ODI量表包括疼痛、生活自理、负重、步行、坐、站立、睡眠、社会生活等方面,总分45分。ODI评分越低,腰椎功能障碍越轻。JOA量表包括运动、感觉、膀胱功能等方面,总分29分。JOA评分越高,腰椎功能障碍越轻。(3)骨折区软组织疼痛康复情况。按照不同疗程阶段分析骨折区软组织疼痛、肿痛修复情况,分组为3-4周、5-6周、7-8周、9-10周、12-13周、≥14周。统计2组患者骨折区软组织疼痛康复时间在6周内的恢复率。(4)生活质量。对2组患者术前、术后3个月使用健康状况调查问卷(Short Form 36 Health survey Questionnaire,SF-36)[9]评估生活质量,选取该量表中生理职能、躯体疼痛、一般健康状况、社会功能、精神健康维度,均采用百分制计分,得分与患者生活质量呈正比。(5)术后并发症发生情况。术后3个月,比较2组患者深静脉血栓、神经根粘连、神经根水肿等不良反应发生率,总发生率=发生不良反应例数/总例数×100%。
4 统计学方法:采用SPSS22.0统计学软件对本研究数据进行处理分析,计数资料包括骨折区软组织疼痛康复情况、术后并发症发生情况等,用(n,%)表示,用x2检验;计量资料包括患者资料、疼痛评分、腰椎功能评分等,用(±s)表示,用t检验。以P<0.05为差异具有统计学意义。
5 结果
5.1 2组患者治疗前及术后24小时、7天的疼痛评分比较:2组患者治疗前VAS评分无显著差异;术后24小时、7天观察组VAS评分均显著低于对照组,差异显著,P<0.05。见表1。
表1 2组治疗前及术后24小时、7天的疼痛评分比较( ±s,n=40)

表1 2组治疗前及术后24小时、7天的疼痛评分比较( ±s,n=40)
注:a表示与术前比较P<0.05
组别 疼痛情况(分)术前 术后24小时 术后7天观察组 8.45±1.38 5.35±0.97a 1.68±0.53a对照组 8.47±1.41 6.34±1.23a 3.44±1.17a t 0.064 3.997 8.666 P 0.949 <0.001 <0.001
5.2 2组患者出院时、术后3个月的腰椎功能比较:2组患者术前ODI评分无统计学意义。观察组出院时及术后3个月后ODI评分低于对照组,差异显著,P<0.05;观察组出院时及术后3个月后JOA评分高于对照组,差异显著,P<0.05。见表2。
表2 2组患者出院时、术后3个月时的腰椎功能比较( ±s,分,n=40)
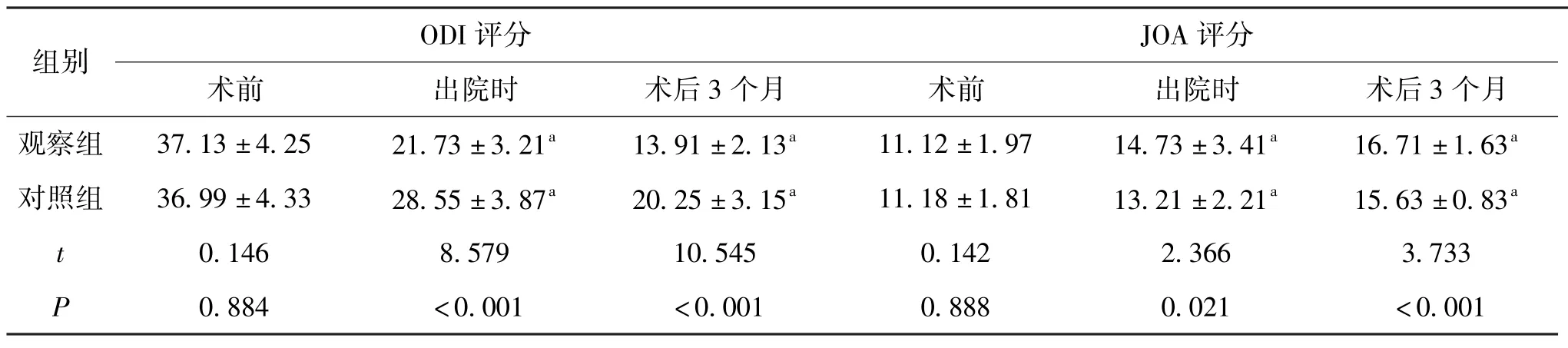
表2 2组患者出院时、术后3个月时的腰椎功能比较( ±s,分,n=40)
注:a表示与术前比较P<0.05
组别 ODI评分 JOA评分术前 出院时 术后3个月 术前 出院时 术后3个月观察组 37.13±4.25 21.73±3.21a 13.91±2.13a 11.12±1.97 14.73±3.41a 16.71±1.63a对照组 36.99±4.33 28.55±3.87a 20.25±3.15a 11.18±1.81 13.21±2.21a 15.63±0.83a t 0.146 8.579 10.545 0.142 2.366 3.733 P 0.884 <0.001 <0.001 0.888 0.021 <0.001
5.3 2组患者骨折区软组织疼痛康复情况比较:观察组6周内的恢复率为82.50%,高于对照组的30.00%,差异显著,P<0.05。见表3。
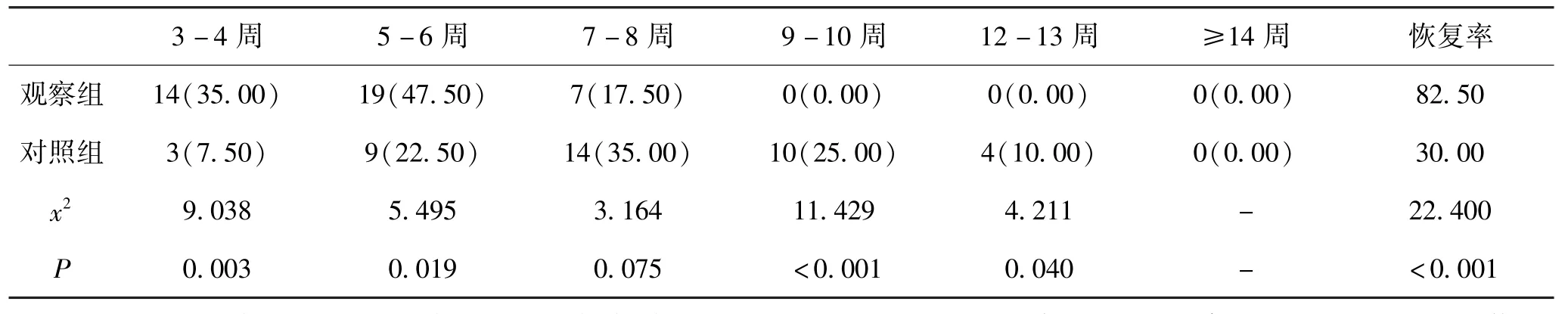
表3 2组患者骨折区软组织疼痛康复情况比较(n,%,n=40)
5.4 2组患者生活质量比较:2组患者术前SF-36量表各维度评分无统计学意义。观察组术后3个月SF-36量表各维度评分高于对照组,差异显著,P<0.05。见表4。
表4 2组患者生活质量比较( ±s,分,n=40)
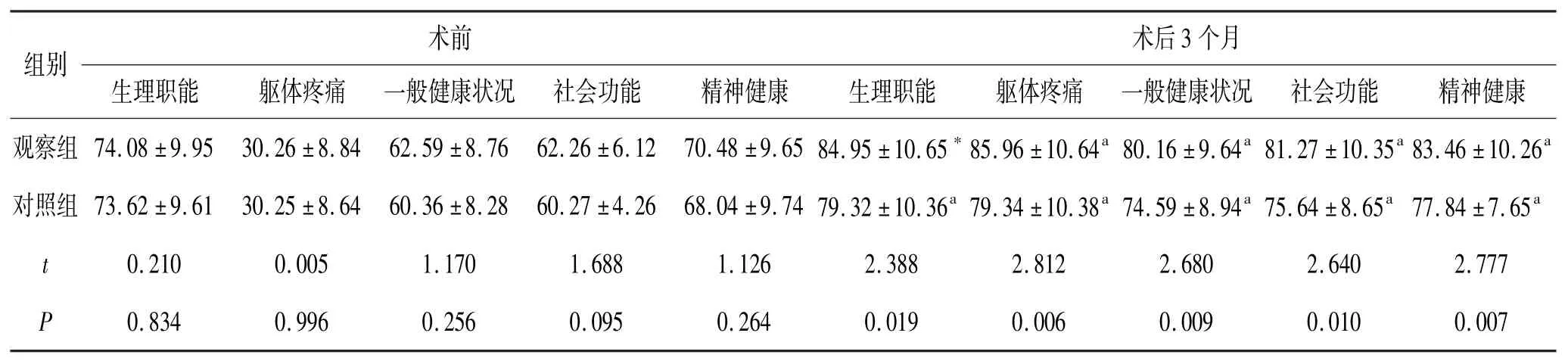
表4 2组患者生活质量比较( ±s,分,n=40)
注:a表示与术前比较P<0.05
术前 术后3个月组别生理职能 躯体疼痛 一般健康状况 社会功能 精神健康 生理职能 躯体疼痛 一般健康状况 社会功能 精神健康观察组 74.08±9.95 30.26±8.84 62.59±8.76 62.26±6.12 70.48±9.65 84.95±10.65*85.96±10.64a 80.16±9.64a 81.27±10.35a 83.46±10.26a对照组 73.62±9.61 30.25±8.64 60.36±8.28 60.27±4.26 68.04±9.74 79.32±10.36a 79.34±10.38a 74.59±8.94a 75.64±8.65a 77.84±7.65a t 0.210 0.005 1.170 1.688 1.126 2.388 2.812 2.680 2.640 2.777 P 0.834 0.996 0.256 0.095 0.264 0.019 0.006 0.009 0.010 0.007
5.5 2组术后并发症发生情况比较:观察组3个月内并发症总发生率为5.00%,低于对照组的20.00%,差异显著,P<0.05。见表5。
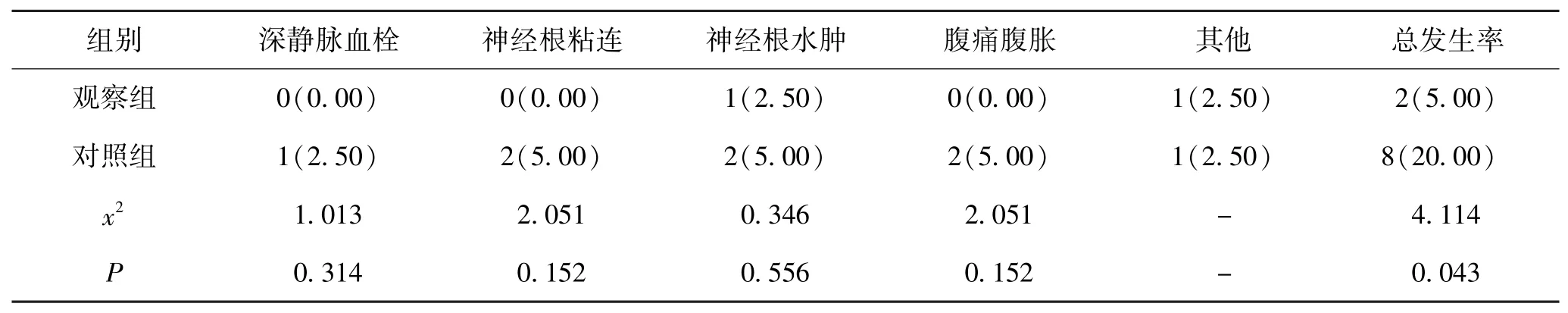
表5 2组术后并发症发生情况比较(n,%,n=40)
讨 论
骨质疏松病是病理性骨折的主要原因,为骨科临床较为多见的疾患之一,老年、营养不良和内分泌等因素均可引起全身性骨质疏松,导致胸、腰椎压缩性骨折,肱骨颈、肱骨上段骨折较为多见[10]。椎体压缩性骨折治疗主要以病情为基础制定方案,PVP为其常用的治疗手段,适合大部分手术患者,联合术后FTS治疗,可促进患者康复。骨质疏松症在中医研究范畴内被归属在“骨痹”“痹症”范围,发病的原因与患者年老力衰、阳虚肾亏有关,又由于患者出现骨质的超微结构破坏、骨头脆性增加现象又称作骨萎[11]。目前已有研究证明针灸、推拿等中医康复疗法可以促进局部血液运行、运气活血、促进局部肌肉组织内炎症消退的作用[12]。中药熏蒸治疗骨质疏松性骨折是中西医联合式治疗方法,借助蒸汽热力,将皮肤作为入口将治疗有效成分缓慢渗透入患病处,浸入经脉穴络,达到调气和血、疏经通络的治疗效果[13]。
将本院自制的中药熏蒸药方用于观察组后发现,接受熏蒸治疗的患者疼痛改善效果明显优于对照组,说明中药熏蒸能有效改善老年性骨质疏松病理性骨折患者PVP术后的疼痛症状。分析原因为组方中海桐皮具有祛风湿、通经络、散瘀止痛的功效,红花联合透骨草具有止痛活血、舒筋解痉的功效,联合同功效的防风等药物一同治疗,有效缓解术后疼痛,便于进一步护理治疗[14]。此外本研究进一步研究发现,相较于对照组,观察组患者出院时及术后3个月ODI评分更低,JOA评分更高,提示中药熏蒸能有效改善老年性骨质疏松病理性骨折患者PVP术后的腰椎功能。分析原因为中药熏蒸通过蒸汽直接作用患者椎体部位及其对应穴位,热疗作用联合药力作用,加速患者椎体骨折部位血液循环,减轻局部的水肿以及疼痛,促进患者腰椎功能提高。中药熏蒸有利于增加椎体部位血液循环,从而发挥加速骨代谢的作用,提高患者骨密度以及骨强度,达到促进患者腰椎功能早期康复的效果。同时中药熏蒸时有效成分通过水蒸气的形式通过毛孔进入患者血液循环中,更有利于发挥该中药组方中海桐皮、制乳香、白芷、红花、艾叶等功效,提高其利用率,从而达到活血化瘀、舒筋解痉、驱寒增阳等疗效,有利于患者术后尽早开始康复锻炼,帮助提高其锻炼耐受力,进而提高康复效果,最终达到促进患者腰椎功能康复的目的[15]。本研究发现,观察组患者6周内骨折区软组织疼痛情况恢复率明显高于对照组,观察组术后3个月SF-36量表各维度评分高于对照组,说明中药熏蒸能有效帮助PVP术后的患者进一步降低腰椎功能障碍,缩短住院时间,促进早期快速康复,提高患者术后生活能力,有明显的社会效益和经济效益。分析原因为本院的熏蒸药方中的制乳香具有祛瘀浊、促新生,收敛生肌功效,同时制没药亦具有活血止痛、消肿生肌的功效,与组方中同具有生肌活血作用的白芷、红花、艾叶等其他药物共同治疗,促进患者患处修复,从而更早地接受康复训练,更早达到出院标准。中医学五行相生理论中“滋补肾水以生养肝木(水生木)”,肾与肝互为因果[16],在治疗过程中的重要性不可忽视。药方中的乌药能够补气止痛、驱寒增阳,小茴香亦能够温中补虚、养胃平气,联合其他药物内调患者肝肾之气,为患者术后的生活能力提高提供帮助。且本研究发现观察组3个月内并发症总发生率低于对照组,说明中药熏蒸能有效帮助PVP术后的患者进一步促进早期快速康复,减少术后并发症发生率,提高患者术后生活能力。PVP术中发生神经根反应性水肿和神经根微小损伤,术后早期开始中药熏蒸有利于加速椎体局部血液循环,减轻其神经根水肿。组方中制乳香、制没药、白芷、红花、艾叶同用具有舒经活络、消肿生肌等功效,能起到改善患者术后运动功能的作用,从而提高患者锻炼效果,减少术后深静脉血栓、神经根粘连的发生率。其次,中药熏蒸,药物未通过胃肠道吸收,避免药物对胃肠道的刺激,且药方中小茴香具有温中补虚、养胃平气的功效,从而减少患者腹痛腹胀的发生率[17]。
综上所述,老年性骨质疏松患者腰椎骨折行PVP术后用中药熏蒸治疗,能减轻患者术后疼痛、提高腰椎功能,同时能促进患者早期快速康复,提高生活质量,减少术后并发症发生率,值得临床应用与推广。
——硫酰氟熏蒸应用技术

