构建模型 突破电解质溶液图像题
景建宏
(福建省福州格致中学 350001)
1 构建模型解答概念相关的图像题
高中化学部分电解质溶液图像题给出新概念,要求学生基于对新概念的理解运用所学进行解题.解答该类习题应抱着必胜的信念,尤其应认真读图构建对应模型,把握相关物质相关参数变化的因果关系,以迅速找到解题的切入点.
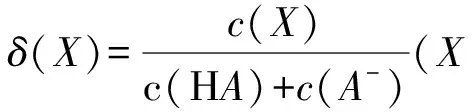

图1
A.HA对应的曲线为δ2
B.升高温度,a点向左移动
C.pH为5时,溶液中HA的浓度大于A-的浓度
D.HA的电离常数数量级为10-4

溶液pH增大,HA的电离程度不断增大,平衡时HA的组成分数不断减小,而A-的组成分数不断增大,因此曲线δ2对应A-.由HA的电离吸收热量,升高温度,其电离程度增大,平衡时HA的组成分数减小,因此,a点向左移动.由图可知pH为4.76时HA和A-浓度相等,则pH=5时,HA的浓度小于A-的浓度.a点时δ2为0.5,HA和A-浓度相等,结合pH=4.76,容易计算出HA的电离常数为10-4.76,数量积为10-5.综上分析只有B项正确.
2 构建模型解答加水稀释图像题
加水稀释是对电解质溶液的常见操作,尤其对于若电解质溶液而言,加水稀释会引起相关离子浓度发生变化.在解答与之相关的图像题时应注重把握加水稀释弱电解质电离变化规律,厘清体积变化与离子数目增大的快慢关系.必要情况下,构建针对性模型,以提高解题正确率.
例2向0.1 mol/L的乙酰水氧酸(用HA表示)不断加水稀释.加入水的体积和溶液pH的变化如图2所示,其中该温度下HA的Ka=4×10-4,lg2=0.3,则( ).

图2
A.x=1.7
B.稀释前,HA的电离度为2×10-1.5×100%
C.未加水时溶液中有:c(HA)>c(H+)>c(A-)>c(OH-)
D.加水过程中始终存在c(HA)+c(A-)=0.1mol/L


3 构建模型解答电导率图像题
电导率这一概念常出现在电解溶液图像题中,解答该类问题的关键在于对电导率这一概念的准确理解,把握影响电导率的因素.其中:离子种类、离子总量、溶液温度都会给电导率带来影响.解答与之相关的图像类问题应注重构建相关模型,更好地掌握溶质的电离以及离子的变化规律.
例3电导率可衡量溶液导电能力的大小.常温下,分别将相同体积的NaOH、CH3COOH溶液加水稀释.溶液电导率和加入水的体积变化曲线如图3所示,则( ).

图3
A.曲线Ⅰ表示NaOH溶液加水稀释过程
B.溶液pH:c C.溶液中水的电离度:a=c D.a、b两点溶液混合后的溶液中c(Na+) 该题结合电导率设问,考查强弱电解质在加水稀释后离子的变化关系.为提高解题效率,可构建如下模型:加水稀释会促进弱电解质的电离,但是相对于加入水体积的变化,离子的浓度仍是减小的.在比较混合溶液中离子浓度大小时,若溶质之间发生反应,则分析反应后的溶质,并结合物料守恒思想进行分析. 加水稀释CH3COOH进一步电离,相对来说电导率下降慢,而NaOH溶液的电导率下降快.CH3COOH溶液显酸性,NaOH溶液显碱性.而NaOH溶液加水稀释,溶液中H+浓度增加,pH降低,因此,溶液pH:c>b>a.a、c两点电导率强度相等,结合水的电离常数易得两点水的电离程度相等,而加水稀释水的电离程度增大,水的电离度a=c 酸碱中和滴定是高中化学的重要知识点.滴定过程中如其中一种物质是弱电解质,则需要分析其电离情况.部分习题给出滴定物质以及溶液pH图像要求学生分析相关问题.解答该类习题为使学生对滴定过程有更为全面地认识,迅速找到解题切入点,应结合图像构建相关模型. 例4室温下将0.1mol/L的NaOH溶液逐滴滴入20mL 0.1mol/L的HA溶液中(Ka=1.0×10-5).滴入NaOH溶液的体积和溶液pH的变化如图4中曲线①所示,则以下说法不正确的是( ). 图4 A.a点pH>5 B.水的电离程度:c>b>a C.实验可使用酚酞作指示剂 D.将HA改为20mL 0.1mol/L的盐酸,则滴定曲线如② 该题属于酸碱滴定图像习题,考查学生对滴定过程以及弱酸电离、水解规律地灵活应用.可构建如下模型:弱酸溶液抑制水的电离,因NaOH溶液的滴入其浓度变小,对水的抑制程度变小,直到溶质为NaA,A-发生水解,进而促进水的电离. 根据构建的电离平衡模型以及电离平衡常数的概念,由Ka=1.0×10-5可知A-的水解常数为1×10-9,a点溶液中NaA和HA的浓度相等,其中HA的电离强于A-水解,A-浓度大于HA的浓度,则c(H+)<1×10-5,则对应的pH大于5.HA电离会抑制水的电离,a点至c点时,HA浓度逐渐变小,其中在c点时HA和NaOH刚好全部反应,溶质为NaA,A-水解促进水的电离,因此,水的电离程度c>b>a.滴定终点溶液呈碱性,能够使用酚酞作指示剂.若将HA改为20mL 0.1mol/L的盐酸,起初溶液pH变化缓慢,在达到终点才会发生明显变化,因此,不能使用曲线②表示.综上分析D项是不正确的. 高中化学电解质溶液图像类的习题有时会涉及到浓度比值类的问题.解答该类问题需要运用一定的数学知识,构建相关参数与物质浓度之间的关系.同时,运用电解质溶液离子浓度变化规律进行解答. 例5常温下,向相等pH、体积的HA、HB两种弱酸溶液中滴加等浓度的NaOH溶液.溶液的pH和粒子浓度比值的关系如图5所示,则( ). 图5 A.c(HA)>c(HB) B.水的电离程度:a>b C.将NaOH溶液滴加到HB溶液至pH=7,c(B-)=100c(HB) D.常温下HB的电离常数为10-4 该题综合考查数学以及电解溶液离子浓度规律.解答该题可构建以下模型:若离子浓度比值的对数为0,表明两种离子浓度的大小是相等的.弱酸溶液溶液中OH-是由水电离的.弱碱溶液中溶液中H+是由水电离的. 高中化学有关电解质溶液习题中有时会给出温度以及pH图像,要求学习者分析相关问题.解答该类问题应牢固记忆相关概念以及相关参数计算公式.同时,为防止在解题中走弯路,应注重构建对应模型,迅速厘清相关参数之间的关系. 例6实验中测得升高温度0.1mol/L的NaHCO3溶液(忽略水的挥发)的pH变化曲线,如图6所示,下列判断正确的是( ). A.c(OH-):a B.取a点溶液滴加0.1mol/L CaCl2等体积混合,生成白色沉淀,两溶液混合时有:c(Ca2+)·c(CO32-) 图6 该题难度一般,考查学生对Kw影响因素的理解以及有关离子浓度大小关系的比较.解答该题可构建如下模型:Kw仅可温度有关,温度越高,Kw越大.比较离子浓度大小关系时应注重运用电荷守恒、物料守恒等.4 构建模型解答滴定图像题

5 构建模型解答粒子浓度比值类图像题


6 构建模型解答温度与pH图像题





