血清中睾酮测定的能力验证研究
高飞,胡泽斌,于婷,董喆,黄杰
NIFDC-PT-319 血清中睾酮测定能力验证计划是国家药品监督管理局项目,依据 ISO/IEC 17043:2010《合格评定能力验证的通用要求》运作,该计划由中国食品药品检定研究院负责组织及实施。
睾酮的分子式组成为 C19H28O2,是由 19 个碳原子构成的类固醇类荷尔蒙,分子量为 288.4。在人体循环系统中,大约 97% 的睾酮结合在人血浆蛋白中。其中,血液中的睾酮有 60% 与性激素结合球蛋白相结合,38% 与白蛋白相结合,2% 为游离状态[1]。睾酮的水平对于人类胚胎发育、男性性腺的发育[2]、骨髓的造血功能及骨密度[3]等起到重要作用。在临床中,血清中睾酮的测定主要被用于女性内分泌失调[4-5]或者男性性功能障碍的辅助诊断[6],其检测的方法包括参考方法(如同位素稀释质谱法)和常规测定方法(如化学发光法)。
目前,我国已有多个睾酮检测试剂盒获得了国家药品监督管理局的上市批准并应用于临床检验。同时,基于体外诊断试剂注册检验、国家监督抽验等检验的发展,国内多个医疗器械检验机构也已开展睾酮检测的项目。因此,中国食品药品检定研究院组织实施了血清中睾酮测定能力验证计划。通过本计划,可客观评价相关实验室睾酮检测的能力。
1 材料与方法
1.1 材料
1.1.1 样本来源 本次能力验证样本有 3 份,为中国食品药品检定研究院研制,均为通过收集外观清澈透明,无溶血、黄疸、乳糜的临床血清,混合后分装得到。其中 1 份真正的能力验证样本的浓度为 3.67 ng/ml,并采用参考方法定值,并经过均匀性和稳定性分析,另外 2 份样本为干扰样本,浓度分别为 0.22 ng/ml 和 1.79 ng/ml。
1.1.2 试剂与仪器 睾酮测定试剂盒分别为吉林迪瑞医疗科技股份有限公司、四川迈克生物股份有限公司和深圳市亚辉龙生物科技股份有限公司产品;睾酮质控品来自美国国家标准与技术研究所;睾酮校准品为广州市达瑞生物技术股份有限公司产品。
化学发光测试仪为深圳市亚辉龙生物科技股份有限公司产品;超高效液相色谱串联质谱系统为美国 Waters 公司产品;全自动化学发光免疫分析仪为吉林迪瑞医疗科技股份有限公司和四川迈克生物股份有限公司产品;ADVIA®Centaur XPT 全自动化学发光免疫分析仪为德国 Siemens公司产品。
1.2 方法
1.2.1 参加者报名 全国范围内的相关实验室通过登录能力验证服务平台进行自愿报名(平台网址为:http://223.71.250.33/Login.aspx)。共有 6 家实验室报名参加本能力验证项目,来自全国 4 个省(自治区)、直辖市的医疗器械检验所/食品药品检验机构和企业实验室,详见表1。其中检验机构 1 家(占 16.7%);企业实验室 5 家(占 83.3%)。6 家实验室中 5 家采用商品化试剂盒,检测方法为化学发光法,1 家为实验室自建高效液相色谱串联质谱法。参加实验室所分配的样本编号和浓度信息见表2。

表1 实验室分布情况
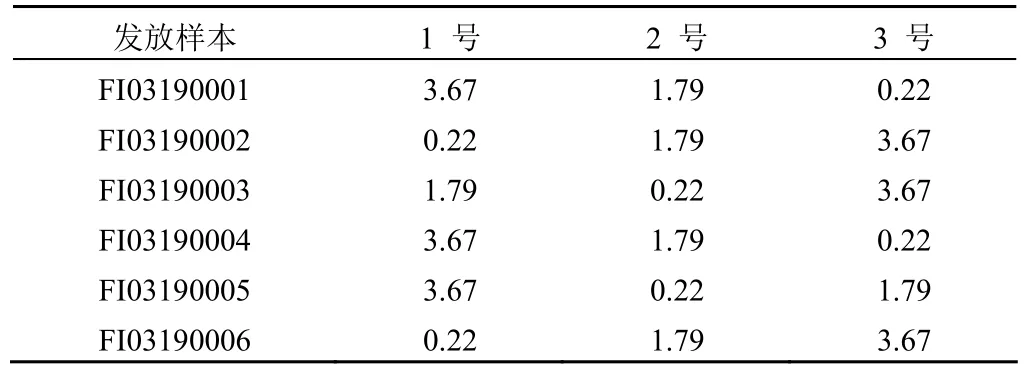
表2 参加考核实验室分配样本编号及浓度(ng/ml)信息
1.2.2 检测步骤 参加者收到样品后需按照以下步骤进行检测:①实验前取出样品,恢复至室温(20 ~ 25 ℃)后充分混匀待测;②检测方法可采用参考方法或商品化试剂盒;③检测仪器应在仪器校准合格有效期内;④试剂配套的校准品和质控品应检测通过;⑤每份能力验证样本应重复测定不少于 5 次并计算均值(保留 2 位小数)、测定值的变异系数(CV,%)及相对偏差(真正样本的实测值与标示值比值)。
1.2.3 结果反馈 实验室收到样品后的 14 个工作日完成实验并在平台上提交结果报告。同时将以下报送材料邮寄至联系人,并务必向联系人提交完整的电子版报送材料。报送材料包括:①结果报告单(加盖公章);②原始试验记录(必须含试剂盒、校准品、检测仪器等关键信息以及检测人员/负责人联系方式);③原始数据汇总表;④原始数据打印结果或截屏或复印件等(务必在结果数据旁用签字笔标注清楚结果所对应的样本信息);⑤如采用商品化试剂盒,需提供试剂盒说明书,及试剂盒批号和有效期等信息。
1.2.4 防止串通措施 随机赋予每个参加实验室一个代码,最终的结果报告中均使用该代码。每个代码均代表一份随机组合的样本。
2 结果
2.1 不同单位对能力验证样本的检测结果
全部实验室均按要求如期提交了结果报告,有效数据 6份。变异系数及相对偏差的检测结果见表3、表4 和表5。
2.2 结果分析
1 份真正样本的血清睾酮标示值为(3.67 ± 0.16)ng/ml(k= 2)。根据判定原则,测定值与标示值的相对偏差应在 ± 30.0% 范围内,且 3 份样品的测定结果的 CV 值均应不高于 10.0%,才认为结果满意。
全部数据中,4 家实验室的 1 份真正样本血清睾酮测定值与标示值的相对偏差结果满足要求,其余 2 家(单位代码分别为:227 和 435)的相对偏差结果均不在范围内,如表4 所示。其中,代码为 227 的实验室采用的实验方法为高效液相色谱串联质谱法,代码为 435 的实验室采用的实验方法为化学发光法;6 家实验室测定结果的 CV 均满足要求,除 1 家实验室的 3 号样本 CV 值超过 9.0% 外,其余样本的 CV 值均小于 5.0%,真正样本的 CV 值在0.8% ~ 4.0% 之间,表明重复性整体结果满意(表3)。最终获得结果满意的实验室为 4 家,满意率为 66.7%,结果不满意的实验室为 2 家,不满意率为 33.3%(表5)。
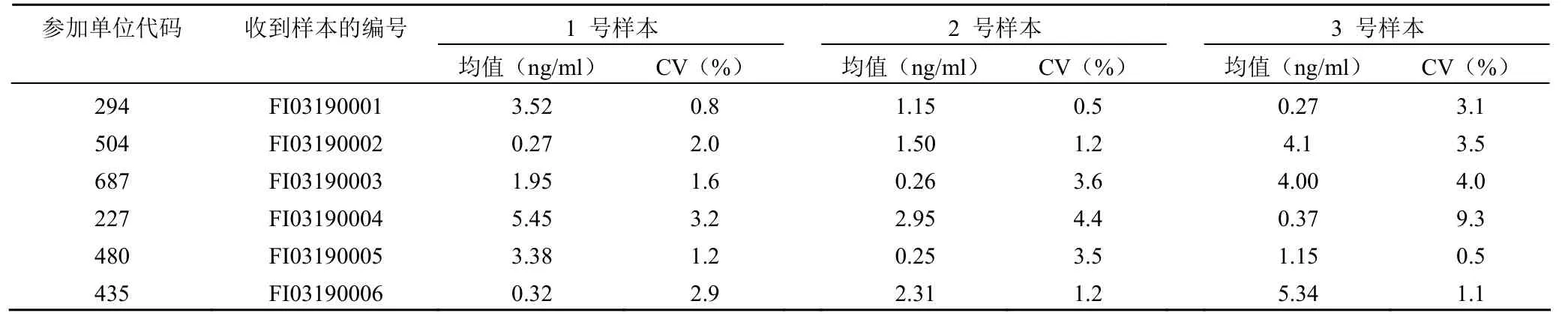
表3 各参加实验室血清睾酮测定均值与 CV 值结果汇总

表4 各参加实验室血清睾酮测定均值与靶值的相对偏差结果汇总

表5 血清中睾酮测定能力验证结果表
本次能力验证的目的是考察各参加实验室对血清中睾酮的检测能力,通过提交的数据和原始记录等对结果中存在的部分问题进行如下可能性分析:
⑴未按照作业指导书进行实验操作
单位代码分别为 227 和 435 的两家实验室没有按照《NIFDC-PT-319 血清中睾酮测定能力验证作业指导书》进行实验操作;作业指导书中明确要求“实验前将所有样品恢复至室温,充分混匀后检测”,而单位代码为 435 的实验室提供的原始数据中并没有将检测样本恢复至室温这一项进行记录且最终报送的结果为不满意。
⑵实验操作过程是否规范
单位代码为 227 的实验室 3 号样本的检测结果分别为 0.319、0.371、0.372、0.410、0.397 ng/ml。可以清楚地看到,5 次结果间波动比较明显,导致 CV 超过 9.0%。对于产生这种实验结果的原因,是仪器参数需优化,还是操作人员的操作误差所致,均需要实验室去查找原因进行分析。对于可能的原因,实验室应当及时发现并排查,以明确是随机误差还是系统误差所导致的 CV 值较大。
⑶未重视标准化研究的重要性
部分实验室检测所使用的检测方法既没有与国际上已有的血清睾酮同位素稀释质谱法进行方法学的互换研究,也没有基于上述测量原理对企业的样本进行赋值和溯源;而对于睾酮这类血清含量偏低、基质复杂、干扰物质较多的非肽激素类物质而言,建立一套标准化的基于国际或国内参考测量程序的检测方法尤为重要。
3 讨论
化学发光免疫分析的方法用于血清中睾酮的测量是目前国内常用的睾酮检测方法。根据国家临床检验医学溯源联合委员会(JCTLM)列表,目前国际上已有的血清睾酮参考方法主要有 3 种,分别由德国临床化学会 H1(DGKL)[7]、比利时根特大学[8]和美国疾病控制与预防中心(CDC)[9]建立,检测原理均为同位素稀释质谱法。本次能力验证所采用的真正样本正是基于此测量原理进行赋值。
在血清睾酮的测定中,如何准确测量复杂基质中的微量物质是难点之一,而国际上所采用的特异性的同位素稀释质谱法在进一步优化反应条件后可达到减少同分子量化合物对分析影响的结果。因此,建议部分实验室参考国际参考测量程序优化各自的检测方法。
综上所述,建议各实验室应重点关注以下方面:①定期确认实验仪器的参数及性能指标是否满足不同样本的检测需求,定期采用效期内的试剂对仪器进行校准;②采用国际或国家标准物质对各自的试剂盒或自建方法进行准确度的实验,并进行结果分析;③加强标准化研究,在建立方法时应尽量基于参考测量程序以便使样本的赋值具有可溯源性;④建议结果不合格的实验室参加测量审核。

