粪菌移植治疗炎症性肠病的临床效果观察
许建勇
炎症性肠病是一类特定的肠道慢性疾病,主要包括克罗恩病和溃疡性结肠炎,可导致胃肠道病变,并可累及口腔、肛门部位,症状包括腹痛、腹泻、发热和体重减轻,严重者可能导致血性腹泻、血便、贫血,患者罹患肠癌的风险更大,需尽早干预治疗。克罗恩病、溃疡性结肠炎的发病原因并不明确,目前相关理论涉及自体免疫性疾病、遗传学、肠道菌群改变、环境因素等。粪菌移植是将健康人粪便中菌群分离、移植到患者胃肠道内的特殊治疗方式,近年来该疗法逐渐成熟,受到了基础和临床医学的高度关注。粪菌移植可重建和纠正异常的肠道菌群,有助于治疗肠道疾病,并可改善肠道外疾病和相关全身疾病。我国利用人体新鲜粪便或者发酵粪水治病的历史悠久,近年来粪菌移植疗法逐渐成熟,用于肠易激综合征、代谢性疾病、自身免疫性疾病和肥胖症等疾病临床治疗的报道逐渐增多,为炎症性肠病的治疗提供了新的途径,同时也为临床医学的发展提供了新的思路,肠道菌群移植作为治疗肠道菌群相关疾病的新型医疗技术,将会带来超越常规治疗所能达到的效果,并且有望解决患者症状无法缓解的问题[1]。此外,大量研究表明,人类肠道菌群与多种疾病密切相关,经肠道菌群移植治疗后,可能会缓解患者的其他疾病症状,对于医院的临床医学研究有着重要意义[2]。为进一步探明肠道菌群移植对炎症性肠病治疗的临床价值,本研究选择本院2018 年1 月~2022 年6 月治疗的42 例炎症性肠病患者作为研究对象,对比分析了肠道菌群移植对炎症性肠病的临床疗效和安全性,旨在探明治疗炎症性肠病的可靠方法,给临床研究提供一条全新的思路。现报告如下。
1 资料与方法
1.1 一般资料 选择本院2018 年1 月~2022 年6 月治疗的42 例炎症性肠病患者作为研究对象,随机分为非移植组和粪菌移植组,每组21 例。粪菌移植组男女比例为13∶8;平均年龄(48.89±15.23)岁;平均病程(15.23±5.36)年;克罗恩病9 例,溃疡性结肠炎12 例。非移植组男女比例为14∶7;平均年龄(48.78± 15.24)岁;平均病程(15.36±5.40)年;克罗恩病10 例,溃疡性结肠炎11 例。两组患者一般资料比较差异无统计学意义(P>0.05),具有可比性。本研究经院伦理委员会批准通过。
1.2 纳入及排除标准
1.2.1 纳入标准 年龄>18 岁,性别不限;符合炎症性肠病诊断标准;经肠道菌群16S rDNA 测序(中国科学技术大学先进技术研究院-卓源健康人体微生物组研究联合实验室)显示,肠道菌群多样性下降;经口服药物或生物反馈疗法等综合治疗3 个月仍无效;无严重心功能不全、严重肺功能障碍,肝肾功能基本正常;患者接受上一次治疗后至少2 周;预期生存时间 >12 个月;能合作观察不良事件和疗效;本人或其法定代理人签署书面知情同意书;既往无肠道手术的病史;凝血功能正常。
1.2.2 排除标准 不符合炎症性肠病诊断标准;患者对这项技术有任何疑虑或者存在其他风险史;患者处于疾病末期或者可能在研究中死亡;入组前已参加其他任何菌群治疗;乙型肝炎、结核、梅毒及人类免疫缺陷病毒(HIV)抗体阳性或任何传染性疾病急性期;心功能Ⅲ级及以上,转氨酶升高超过正常上限的2 倍,肾功能不全;发热体温>38℃或临床上有明显的可影响本方案的活动性感染;严重贫血(血红蛋白<60 g/L)、粒细胞减少、凝血酶原时间(PT)延长>1.5 s;有严重免疫缺陷;有明显的心脑血管异常;有心律失常病史或判断患有增加室性心律失常风险的心脏病;入组后发现不符合治疗方案;入组后发现严重躯体疾病;依从性较差,不配合临床治疗方案;主动要求退出治疗;有不能耐受的不良事件等。
1.3 方法
1.3.1 非移植组 非移植组口服美沙拉嗪肠溶片联合双歧杆菌三联活菌胶囊治疗。美沙拉嗪肠溶片(商品名:惠迪,葵花药业集团佳木斯鹿灵制药有限公司,国药准字H19980148,规格:0.25 g),口服,1.0 g/次,3 次/d;双歧杆菌三联活菌胶囊 (商品名:培菲康,上海上药信谊药厂有限公司,国药准字S10950032,规格:0.21 g),口服,2~4 粒/次,3 次/d。持续治疗30 d。同时,根据患者病情,给予补液,纠正水电解质紊乱、营养支持等对症治疗。
1.3.2 粪菌移植组 粪菌移植组在非移植组基础上增加粪菌移植治疗,具体措施如下。
1.3.2.1 治疗方案 健康肠道菌群制剂:规格:40 ml/瓶;储存条件:-80℃(12 个月);运输条件:健康肠道菌群制剂置于干冰保藏箱中运输。3 次菌群移植为1 个疗程,每次移植菌群制剂的量为120 ml。采用灌肠治疗方式治疗,每次间隔5~7 d。标准化肠道菌群制剂制备技术路线见图1。

图1 标准化肠道菌群制剂制备技术路线
1.3.2.2 标准化粪菌制备 本方案所用的标准化粪菌制备技术参照美国粪菌移植工作组发布的、中华预防医学会微生态学分会儿科微生态学组、欧洲粪菌移植工作组、食品药品监督管理局(FDA)、生物制品审评与研究中心(CBER)等机构与组织联合发布的粪菌移植指南文件(78FR 12763)制定的粪菌制备标准操作规程(版号:V5.2020),在中国科学技术大学先进技术研究院-卓源健康人体微生物组研究联合实验室(生物安全二级实验室)按照粪菌制备标准操作规程(版号:V5.2020)进行标准化粪菌制备完成。参与标准化粪菌制备的人员和质控人员均受过专业的微生物分离及检测训练,并具备微生物学或医学等相关学科学历背景。标准化菌群制剂复苏流程如下:本制剂为-80℃条件下存储,使用前需进行梯度解冻复苏:①-80℃,储藏库中存储的肠道菌群制剂;②-20℃,移植前1 d从-80℃中取出放置于-20℃冰箱中至少4 h;③4℃,移植前一晚从-20℃中取出置于4℃冷藏冰箱中解冻 (8 h);④25℃(室温),移植前1 h 从4℃冷藏冰箱中取出置于室温复苏;⑤肠道菌群制剂温度与室温基本一致后,实施肠道菌群移植。
1.3.2.3 粪菌移植 患者取左侧卧位,先进行生理盐水清洁灌肠,随后将导尿管插入肛门(深度15 cm),注射器吸取120 ml 肠道菌群制剂注入,注射完成后,指导患者仰卧休息30 min,每次治疗间隔5~7 d,3 次菌群移植为1 个疗程。
1.4 观察指标及判定标准 比较两组患者治疗前后Mayo 评分、CMDI 评分、QOL 评分及不良反应发生情况。
1.4.1 Mayo 评分 Mayo 量表包括排便次数评分(0~ 3 分)、便血评分(0~3 分)、内镜检查评分(0~3 分)、医师总体评分(0~3 分),总评分0~12 分,评分与患者病情严重程度呈正相关性[3]。
1.4.2 CMDI 评分 CMDI 评分范围为0~10 分:0 分为结肠黏膜完全正常,无病变;1~2 分表示存在粘连,或仅有1 处溃疡,肠壁无充血、增厚;3~5 分表示存在1 处以上溃疡伴炎症,但溃疡和炎症沿结肠纵轴 >1 cm;6~10 分表示溃疡伴炎症≥2 处,溃疡和炎症沿结肠纵轴损伤>2 cm。评分越高,则结肠黏膜损伤越严重[4]。
1.4.3 QOL 评分 QOL 量表包括食欲、精神、睡眠、疲乏、疼痛、同事的理解与配合、家庭的理解与配合、对治疗的态度、疾病认知、治疗副作用、日常生活、复查等指标,评分0~100 分,分数越高则生活质量越高[5]。
1.4.4 不良反应发生情况 两组患者治疗期间,观察患者生命体征、体格检查、实验室指标、心电图等变化,统计两组患者不良反应发生情况,包括腹痛、腹胀、恶心呕吐、腹泻、头痛头晕、其他。
1.5 统计学方法 采用SPSS20.0 统计学软件对研究数据进行统计分析。计量资料以均数±标准差()表示,采用t检验;计数资料以率(%)表示,采用χ2检验。P<0.05 表示差异具有统计学意义。
2 结果
2.1 两组患者治疗前后Mayo 评分比较 治疗前,两组患者排便次数评分、便血评分、内镜检查评分、医师总体评分及总分比较差异无统计学意义(P>0.05);治疗后,粪菌移植组患者排便次数评分、便血评分、内镜检查评分、医师总体评分及总分均显著低于非移植组,差异具有统计学意义(P<0.05)。见表1。
表1 两组患者治疗前后Mayo 评分比较(,分)
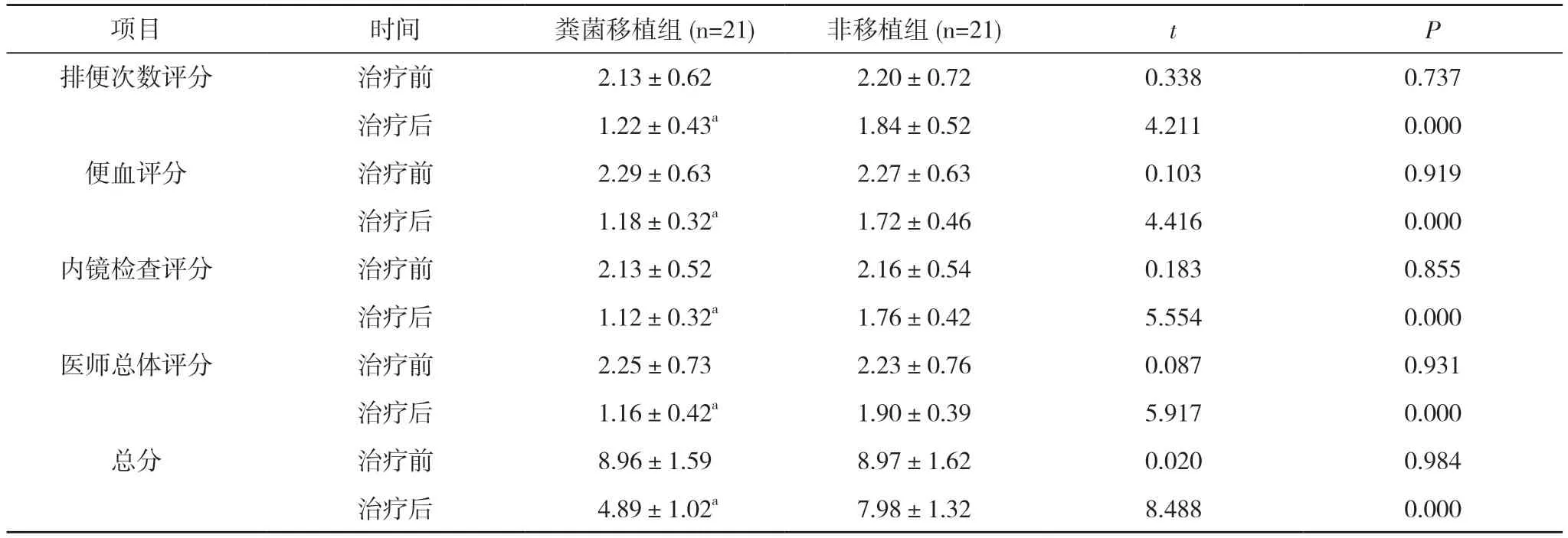
表1 两组患者治疗前后Mayo 评分比较(,分)
注:与非移植组治疗后比较,aP<0.05
2.2 两组患者治疗前后CMDI 评分比较 治疗前,两组患者CMDI 评分比较差异无统计学意义(P>0.05);治疗后,粪菌移植组患者CMDI 评分显著低于非移植组,差异具有统计学意义(P<0.05)。见表2。
表2 两组患者治疗前后CMDI 评分比较(,分)

表2 两组患者治疗前后CMDI 评分比较(,分)
注:与非移植组治疗后比较,aP<0.05
2.3 两组患者治疗前后QOL 评分比较 治疗前,两组患者QOL 评分比较差异无统计学意义(P>0.05);治疗后,粪菌移植组QOL 评分显著高于非移植组,差异具有统计学意义(P<0.05)。见表3。
表3 两组患者治疗前后QOL 评分比较(,分)

表3 两组患者治疗前后QOL 评分比较(,分)
注:与非移植组治疗后比较,aP<0.05
2.4 两组患者不良反应发生情况比较 粪菌移植组患者不良反应发生率为28.57%(6/21),与非移植组的23.81%(5/21)比较,差异无统计学意义(P>0.05)。见表4。两组不良反应症状较轻,可耐受,症状逐渐消退。

表4 两组患者不良反应发生情况比较[n(%)]
3 讨论
近年来,炎症性肠病的发病率逐年上升,患者发生结肠癌的风险高于正常人,需积极提升其防控水平。炎症性肠病的表现形式存在不同特征,但是也存在一些共同的症状,如腹痛、呕吐、腹泻、血便或体重减轻等,同时也存在关节炎、坏疽性脓皮病、原发性硬化性胆管炎、口腔复发性溃疡等并发症[6,7]。通常根据临床表现,结合血液检查、粪便检查、结肠镜和活体组织切片等来诊断[8]。目前,炎症性肠病没有确切有效的治疗方法,常用氨基水杨酸制剂、免疫抑制剂、类固醇药物控制病情的突发,但是临床效果因人而异,临床疗效欠佳,亟待探索更为安全、有效的治疗方案[9]。
炎症性肠病与肠道菌群的失调密切相关,炎症性肠病患者与健康人群肠道菌群比较,在多样性差别和特定物种丰度方面存在较大差异[10]。微生物对炎症性肠病患者肠道炎症环境的响应,同时预示肠道菌群物种组成改变对研究菌群失调的意义重大。同时,肠道菌群的代谢产物也可通过多种方式影响宿主,肠道菌群可以起到抑制病原菌,增强免疫耐受,开启上皮修复,确保免疫细胞亚群平衡的作用[11]。总之,肠道菌群在炎症性肠病中扮演很多角色,可保护宿主减轻炎症,同时可直接引起炎症。炎症性肠病对肠道菌群丰度较高部位的影响较大,粪菌移植可重建健康菌群状态,改善肠道内环境,可有效缓解肠黏膜损伤及炎性症状[12]。目前,粪菌移植被认为是纠正肠道菌群失调的有效手段,其在治疗艰难梭菌感染方面取得了成功,使得该疗法被应用于炎症性肠病的临床治疗中。
肠道菌群移植作为治疗肠道菌群相关疾病的新型医疗技术,将会带来超越常规治疗的效果,特别是在临床治疗肠道菌群紊乱相关肠道疾病(艰难梭菌感染、炎性肠病、功能性便秘、肠易激综合征)方面有着重要的临床应用价值,这种新型的治疗方式受到基础和临床医学的关注[13,14]。我国小部分大型医院已注册开展粪菌治疗和研究,成功报道逐渐增多,本项目在理论上可行。本院多年坚持炎症性肠病方面的研究,由知名微生物学教授、医学专家等组成的专家团队作为技术支持,参与指导整个制备及质控过程,相关理论基础、技术都很成熟,在粪菌移植治疗方面上可相互配合,顺利完成研究任务。本临床方案所用肠道菌群制剂的制备在中国科学技术大学生物安全Ⅱ级实验室(BSL-2 实验室)进行肠道菌群制剂标准化制备,整个制备过程在厌氧工作站和生物安全柜中完成。参与肠道菌群制剂制备的人员和质控人员、选择相关临床指标检测,制定了粪菌移植方案,选配肠道菌群制剂,做好肠道准备,实现肠道菌群制剂复苏,并完成肠道菌群移植。本研究对粪菌移植患者随访及疗效观察发现,治疗后,粪菌移植组患者排便次数评分、便血评分、内镜检查评分、医师总体评分及总分分别为(1.22±0.43)、(1.18±0.32)、(1.12±0.32)、(1.16±0.42)、(4.89±1.02)分,均显著低于非移植组的(1.84±0.52)、(1.72±0.46)、(1.76±0.42)、(1.90±0.39)、(7.98±1.32)分,差异具有统计学意义(P<0.05)。治疗后,粪菌移植组患者CMDI 评分为(3.82±1.02)分,显著低于非移植组的(5.36±1.13)分,差异具有统计学意义(P<0.05)。可知应用粪菌移植新技术,可有效改善患者炎症反应、肠黏膜损害,提示通过粪菌移植,可以改变目前炎症性肠病患者的痛苦,肠道菌群移植作为治疗肠道菌群相关疾病的新型医疗技术,有望解决患者炎症性肠病症状无法缓解的问题。此外,粪菌移植相关临床研究表明,人类肠道菌群与多种疾病密切相关。经肠道菌群移植治疗后,可能会缓解患者的其他疾病症状,减少疾病对患者带来的生活学习等不便,很大程度上减少患者的时间成本与经济损失[15-20]。本次研究也发现,治疗后,粪菌移植组QOL 评分为(88.89±8.01)分,显著高于非移植组的(75.23±5.69)分,差异具有统计学意义(P<0.05)。粪菌移植组患者不良反应发生率为28.57%(6/21),与非移植组的23.81%(5/21)比较,差异无统计学意义(P>0.05)。提示肠道菌群移植后,患者生活质量显著提高,有助于改善患者预后,促进患者恢复正常生活与工作,有利于患者回归社会,临床应用安全可靠,可知粪菌移植治疗炎症性肠病可以获得良好的社会效应与较大的经济效益。
综上所述,炎症性肠病与肠道菌群的失调密切相关,粪菌移植作为医疗新技术在临床上得以广泛推广,其在治疗肠道菌群组成结构紊乱相关性疾病方面,有着优于传统治疗方式的临床疗效与安全性。粪菌移植治疗可有效改善炎症性肠病患者病情,促进肠黏膜病灶修复,提高预后生活质量,安全可靠,临床应用价值较高,值得推广借鉴。

