五味子及其炮制品挥发油成分差异研究
李晓霞,刘忠英,刘舒,孙严彤,刘晓,汪戎锦※
(1.吉林大学药学院,吉林 长春 130021;2.中国科学院长春应用化学研究所,吉林省中药化学与质谱重点实验室,吉林 长春 130022)
五味子[Schisandra chinensis(Turcz.)Baill.]为木兰科的一种药用植物,多以其干燥成熟果实入药[1]。药理学研究表明,五味子具有肝脏、神经系统和心血管系统的保护作用,能够调节血糖和血脂[2]、增强免疫力起到抗癌和抗病毒等药理作用[3-6]。五味子的现代炮制方法多以蒸制、盐制、蜜制、醋制和酒制等应用于临床[7,8]。五味子中化学成分复杂,在炮制过程中会受到不同因素的影响从而使多种化学成分发生改变[9-12]。作为五味子最主要的活性成分之一,五味子挥发油因其具有良好的镇咳作用及中枢神经系统调节作用而被广泛应用[13,14]。研究表明,五味子果实和种子中含有的挥发油主要为萜类及少量的酸、醇等含氧成分[15],经过炮制后可能会产生一定的含量及成分差异,而目前研究者对五味子及其炮制品中挥发油类成分差异研究较少。因此,本文采取优化的五味子炮制工艺,制备蒸五味子、盐五味子和蜜五味子,并采用气相色谱质谱联用(GC-MS)法对五味子及其3种炮制品中的挥发油类成分进行初步研究,为阐明中药功效、提升五味子质量标准和临床合理用药提供理论依据。
1 材料与方法
1.1 药材、试剂及仪器
五味子(吉林省北药药材加工有限公司,批号:20180821);甲醇(天津新通精细化工有限公司);蜂蜜(北京同仁堂蜂产品有限公司);精制食用盐(上海市盐业有限公司)。DFT-200手提式高速万能粉碎机(温岭市林大机械有限公司);SHZ-Ⅲ型循环水真空泵(上海亚荣生化仪器厂);Milli-Q Gradient A10超纯水系统(美国Millipore Inc.);电热鼓风干燥箱(上海一恒科学仪器有限公司);TSQ8000三重四极杆气质联用仪(美国Thermo)。
1.2 实验方法
1.2.1 五味子炮制品制备对五味子炮制方法进行优化,并制备蒸五味子、盐五味子及蜜五味子炮制品。蒸五味子:取五味子待炮制品10 g,加入清水10 mL,拌匀、润透,置于适宜的蒸制容器内,蒸汽加热蒸制3 h,取出,稍晾,拌回蒸液,干燥;盐五味子:将食盐加适量水溶解为1%盐水,滤过,备用。取五味子待炮制品10g,加入备好的1%盐水10 mL,拌匀,闷润1 h,置于炒制容器内,80℃,炒制60 s,取出,放凉;蜜五味子:将炼蜜加适量沸水稀释为10%蜜水,备用。取五味子待炮制品10g,加入备好的10%蜜水10mL,拌匀,闷润1h。置于炒制容器内,80℃,炒制60 s,取出,放凉。
1.2.2 五味子挥发油类成分提取方法精密称取供试品100 g,粉碎,过50目筛,置烧瓶中,以1:10的液料比,加入蒸馏水1 000 mL,振摇混合后,将挥发油测定器与回流冷凝管连接。从冷凝管上端加水使其将挥发油测定器的具有刻度部分充满至溢入烧瓶时为止。置于电热套中缓缓加热至沸腾,并保持微沸状态约5 h,直至挥发油测定器中提取出的挥发油的量不再增加,停止加热,静置片刻后开启挥发油测定器下端活塞,缓缓将水放出,至油层上端到达刻度0线上面5 mm处为止。放置1h以上,再开启活塞使油层下降至其上端刚好与0刻度线平齐,读取挥发油总量,并计算供试品中挥发油的含量(%)。
1.2.3 挥发油类成分测定方法GC-MS色谱条件:选用TG-5MS(30 m 0.25 mm,0.25m)色谱柱;升温程序:柱起始温度40℃,并保持5 min,以2℃/min程序升温至200℃,保持1 min,再以程序升温至250℃;总分析时间为90 min;进样口温度230℃;载气为高纯N2;载气流速为1.3 mL/min;进样量为0.4L;分流比为20:1。
GC-MS质谱条件:EI电离源:离子源温度230℃;四极杆温度150℃;电离电压70eV;倍增器电压1341V;发射电流34.6A;质谱接口温度280℃;溶剂延迟6 min;全扫描模式:质量扫描范围为m/z:20~500 Da。
将提取后的五味子挥发油用甲醇稀释5 000倍后,采用GC-MS法进行测定。利用G1701BA化学工作站,结合检索NIST08标准谱图库及相关文献确定挥发性成分。
2 结果与分析
2.1 五味子及其炮制品挥发油提取率测定
采用水蒸气蒸馏法提取五味子挥发油,并对提取的挥发油进行提取率计算。五味子、蒸五味子、盐五味子和蜜五味子中挥发油的提取率分别为1.40%、0.85%、1.27%和1.31%。其中,蒸五味子挥发油提取率最低。
2.2 五味子及其炮制品挥发油成分分析
采用GC-MS对五味子及其3种炮制品的挥发油成分进行分析,图1表示各样本中提取挥发油的总离子流图。为了更加直观清晰地观察挥发油组分GC-MS总离子流图中每一个色谱峰,将图1分成图2(0~45min)和图3(45~90 min),并在图中注明峰号。
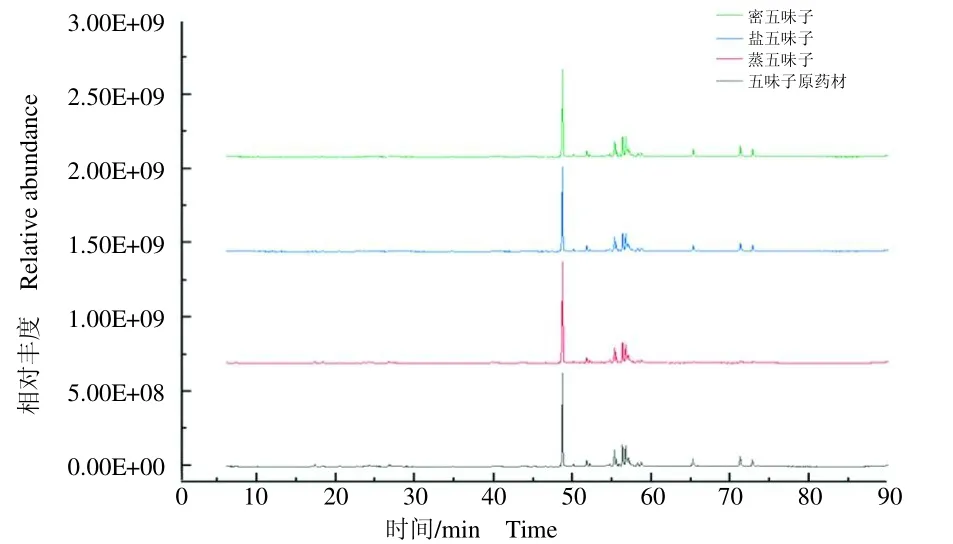
图1 五味子挥发油组分的总离子流图Fig.1 Total ion current chromatograms of volatile oil components of Schisandra chinensis and its processed products
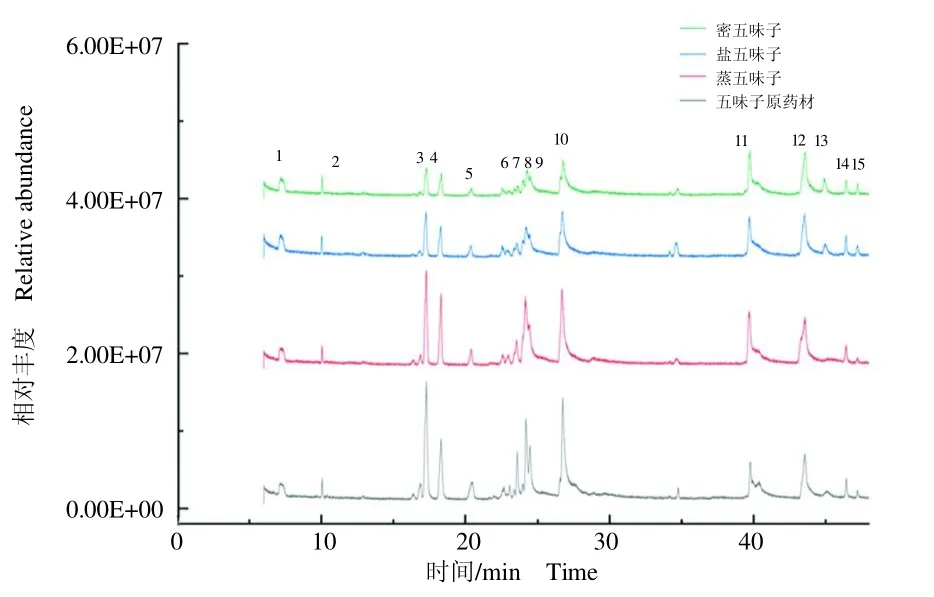
图2 五味子挥发油组分0~45 min的总离子流图Fig.2 Total ion current chromatograms of volatile oil components of Schisandra chinensis and its processed products in the retention time of 0~45 min
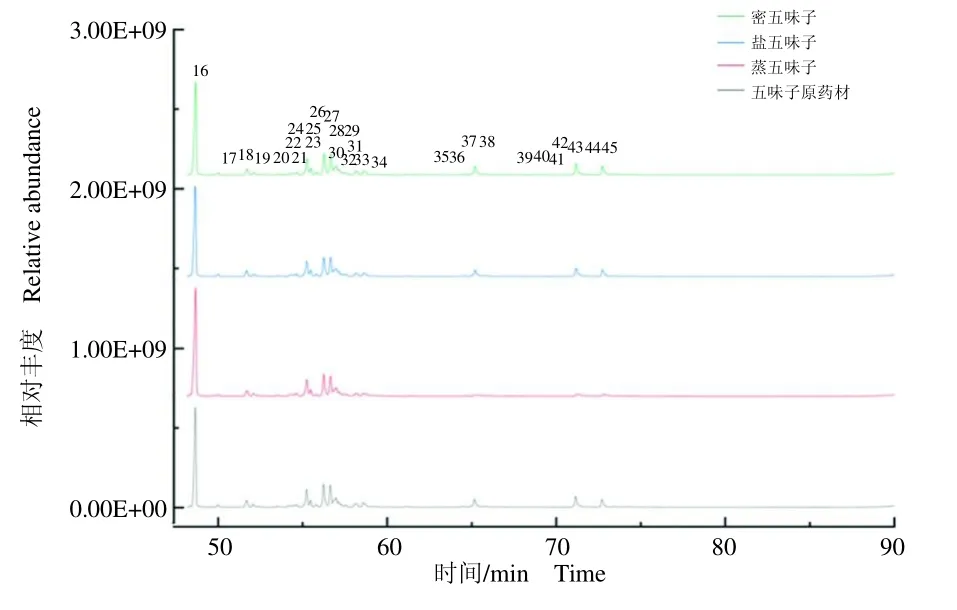
图3 五味子挥发油组分45~90 min的总离子流图Fig.3 Total ion current chromatograms of volatile oil components of Schisandra chinensis and its processed products in the retention time of 45~90 min
表1为GC-MS检测出的五味子及其炮制品中挥发油成分的分类。结果表明,在五味子原药材挥发油中共检测出64个色谱峰,鉴定出45种化合物,占总峰面积的83.37%。其中萜类化合物27种,占总峰面积的70.81%;芳香族化合物7种(芳香醚2种,占1.99%,芳香烃5种,占3.61%);脂肪族类化合物2种,占0.92%;酯类3种,占1.05%;酮类化合物6种,占5%。蒸五味子挥发油中共检测出55个峰,鉴定出38种化合物,占总峰面积的85.33%。其中萜类化合物和芳香烃类化合物较五味子各少2种;酮类化合物较五味子少3种。盐五味子挥发油中共检测出56个峰,鉴定出41个化合物,占总峰面积的86.37%。其中萜类化合物和酮类化合物比五味子各少1种;芳香烃类化合物较五味子少2种。蜜五味子挥发油中共检测出57个峰,鉴定出42个化合物,占总峰面积的86.37%。其中芳香烃类化合物较五味子少2种;酮类化合物较五味子少1种。五味子及其炮制品挥发油中含量最高的化合物为依兰烯。五味子及其炮制品中挥发油成分分析表如表2所示,共列出45种从五味子及其炮制品中提取的挥发油类成分鉴定结果,包括各成分的分子式、结构式、保留时间及相对含量等。由此表可知,五味子药材经过炮制后,多种挥发油类成分相对含量发生变化,且一些挥发油类成分不能在炮制品中检测到,推测3种炮制工艺均对五味子药材中的挥发油成分具有一定的影响,使其成分和含量发生改变。

表1 五味子及其炮制品中挥发油分类Table 1 Classification of volatile oil in Schisandra chinensis and its processed products %

表2 五味子及其炮制品中挥发油成分分析表Table 2 Information of volatile oil in Schisandra chinensis and its processed products

续表

续表
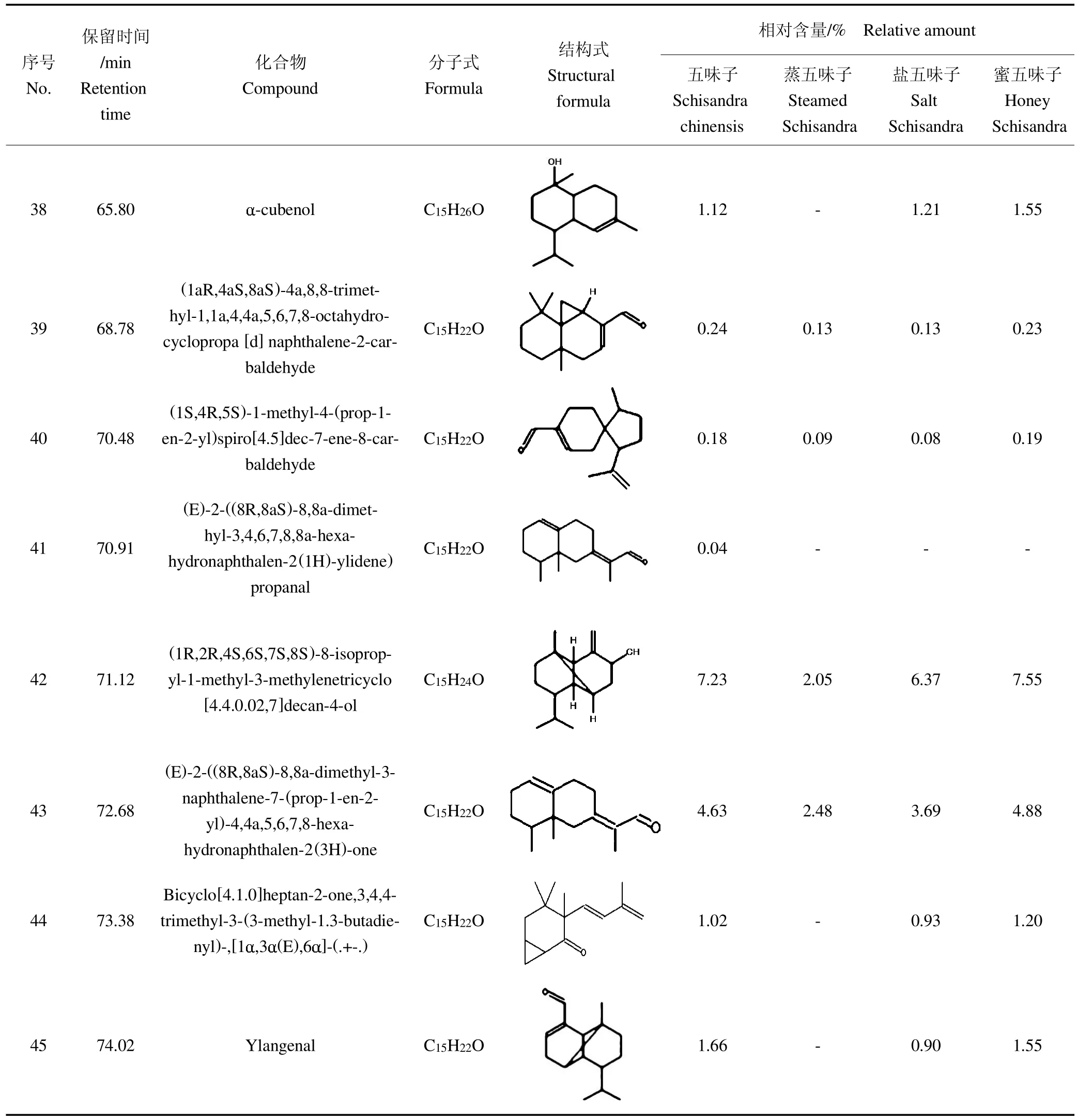
续表
3 讨论
为了探讨五味子及其炮制品中挥发油类成分的含量差异,本研究采用水蒸气蒸馏法对五味子及其3种炮制品中挥发油进行提取,并利用GC-MS法对其进行成分分析。在五味子挥发油中共检测出64个峰,鉴定出45种化合物,占总峰面积的83.37%。蒸五味子挥发油中共检测出55个峰,鉴定出38种化合物,占总峰面积的85.33%。盐五味子挥发油中共检测出56个峰,鉴定出41种化合物,占总峰面积的86.37%。蜜五味子挥发油中共检测出57个峰,鉴定出42种化合物,占总峰面积的85.53%。本研究共鉴定出45种存在于五味子及其炮制品中的挥发油类成分,其中萜类化合物27种,约占总挥发油的70%以上,芳香族类化合物7种,脂肪族类化合物2种,酯类化合物3种以及酮类化合物6种。由于炮制方式不同,不同炮制品中挥发油类成分也存在一定差异。
综上所述,本研究通过对五味子及其炮制品进行成分分析,明确了五味子挥发油的组成以及五味子炮制前后挥发油类成分的含量差异,为五味子及其炮制品发挥特定的药理作用提供理论依据。

