无血清全悬浮培养Vero细胞系的建立及生物反应器培养参数优化
杨惠清,武发菊,葛玉凤,刘小刚,安芳兰,刘学荣,胡永浩
(1.甘肃农业大学动物医学院,甘肃兰州 730000;2.中农威特生物科技股份有限公司,甘肃兰州 730046)
Vero细胞(非洲绿猴肾细胞)是日本学者Yasumura和Kawakita在 1962 年从非洲绿猴肾脏分离的首个用于生产人用生物制品的异倍体贴附依赖性细胞[1]。Vero细胞是世界卫生组织(WHO)和我国生物制品规程认可的生产疫苗的细胞系[2-3]。与用作疫苗生产的原代细胞、二倍体细胞和其他一些传代细胞基质相比,Vero细胞的来源方便,生物安全性高,对多种病毒的感染敏感、病毒增殖滴度高,是很多病毒理想的基质,能广泛用于人和动物疫苗的生产[4]。为了获得高浓度的产品,首先需要获得高密度的细胞。近年来,微载体培养技术在 Vero 细胞的培养上得到了广泛的应用。周健等[5]通过微载体生物反应器培养制备的Vero细胞流感H1N1亚型全病毒灭活疫苗各项指标符合《中国药典》规定;刘志成等[6]利用微载体培养技术,初步建立了生物反应器-微载体培养技术培养Vero细胞制备CA16的工艺,为CA16灭活疫苗的研制奠定了基础。但是,与悬浮培养相比,微载体的使用不仅加大了细胞培养的成本,也给培养规模的放大带来了不便[7]。因此,Vero细胞全悬浮培养技术应运而生。Rourou S等[8]利用自制的培养基,获得了可在摇瓶中悬浮生长的Vero细胞(VeroS),细胞密度水平高于2.0×106cells/mL,结果与在Cytodex1微载体上生长的Vero细胞结果相当。
本研究对贴壁型Vero细胞进行悬浮培养驯化,筛选出1株可无血清全悬浮培养的Vero细胞,建立相应细胞库,进行相关检定,并在此基础上进行了规模化应用,优化了生物反应器培养参数,使其可在生物反应器中高密度生长,为以Vero细胞为基质的病毒性疫苗的生产提供参考,也填补了国内Vero细胞全悬浮培养技术的空白。
1 材料与方法
1.1 材料
1.1.1 细胞 贴壁Vero细胞为中农威特生物科技股份有限公司于2015年2月从美国模式培养物集存库(American type culture collection,ATCC)引进,编号为CCL-81。
1.1.2 主要试剂 无血清培养基(virus production-serum-free medium,VP-SFM),苏州沃美公司产品;DMEM (minimum essential medium)培养基、胎牛血清(fatal bovine serum,FBS)、胰蛋白酶和DMSO,美国Gibco公司产品。
1.1.3 仪器设备 CO2摇床,上海比奥实业发展有限公司产品;7.5 L反应器,Sartorius公司产品;台式冷冻离心机,Thermo Fisher公司产品;倒置显微镜,日本Olympus公司产品;CASY细胞计数分析仪,罗氏公司产品;液氮罐,四川亚西橡塑机械有限公司低温设备厂产品;超净工作台,苏净安泰公司产品。
1.2 方法
1.2.1 Vero细胞的悬浮驯化 采用常规方法复苏1支Vero贴壁细胞,用逐步降血清法适应无血清培养。具体方法如下:用含 100 mL/L FBS的DMEM培养长成致密单层的Vero细胞,传2代后用胰蛋白酶消化,传代至含50 mL/L FBS的培养基(500 mL/L DMEM+500 mL/L VP-SFM)中培养,待铺满后适应含30 mL/L FBS的培养基(300 mL/L DMEM+700 mL/L VP-SFM),再适应含10 mL/L FBS的培养基(100 mL/L DMEM+900 mL/L VP-SFM),进行血清饥饿处理(于传代前12 h更换不含血清的培养基)后,适应VP-SFM,最终获得无血清培养Vero细胞株。
取对数生长期已适应无血清培养的Vero细胞接种至无血清培养基VP-SFM,并转移至摇瓶中,培养过程中,根据细胞的增殖状态,调整培养参数,连续传代至细胞完全失去黏附瓶壁的能力,以单个细胞悬浮生长于培养液中,细胞生长状态稳定,传代细胞密度大于2.0×106cells/mL,活率大于90%,认为Vero细胞已适应悬浮无血清培养。
1.2.2 悬浮Vero细胞库的建立
1.2.2.1 原始细胞库 将1.2.1中已适应无血清悬浮培养的Vero细胞,连续传代至细胞生长稳定时收集适量细胞离心,加入冻存液,吹打混匀,调节细胞密度为7.0×106cells/mL,每只冻存管分装1.5 mL。梯度冻存后放入-70 ℃冰箱过夜,再放于-196 ℃液氮罐中保存,作为原始细胞库。
1.2.2.2 主细胞库 取1支原始细胞库细胞,于40 ℃纯水中1 min内复融,取适量37 ℃预热的新鲜培养基置于离心管中,将上述细胞加入离心管中,混匀后600 r/min离心5 min除去冷冻保护液,弃上清,再加入适量新鲜培养液,接种至培养瓶中,接种密度为0.6×106cells/mL 左右,37 ℃恒温摇床振荡(转速120 r/min)培养48 h左右,取样计数。连续传代至细胞生长稳定时收集适量细胞离心,加入冻存液,吹打混匀,调节细胞密度为7.0×106cells/mL,每只冻存管分装1.5 mL。梯度冻存后放入-70 ℃冰箱过夜,再放于-196 ℃液氮罐中保存,作为主细胞库。
1.2.2.3 工作细胞库 取1支主细胞库细胞,于40 ℃纯水中1 min内复融,取适量37 ℃预热的新鲜培养基置于离心管中,将上述细胞加入离心管中,混匀后600 r/mim离心5 min除去冷冻保护液,弃上清,再加入适量新鲜培养液,接种至培养瓶中,接种密度为0.6×106cells/mL 左右,37 ℃恒温摇床振荡(转速120 r/min)培养48 h左右,取样计数。连续传代至细胞生长稳定时收集适量细胞离心,加入冻存液,吹打混匀,调节细胞密度为1.2×107cells/mL,每只冻存管分装1.5 mL。梯度冻存后放入-70 ℃冰箱过夜,再放于-196 ℃液氮罐中保存,作为工作细胞库。
1.2.3 Vero细胞原始细胞库、主细胞库和工作细胞库的检定
1.2.3.1 细胞形态观察及活力检测 取原始细胞库、主细胞库及工作细胞库Vero细胞各1支复苏,进行传代培养,采用细胞分析仪检测细胞密度和活力,显微镜下观察细胞生长形态,并拍照。
1.2.3.2 生长曲线 将复苏后传代1次的细胞,调整接种浓度为 0.6×106cells/mL,接种至培养瓶中,于37 ℃培养箱中培养,每24 h取样,进行细胞计数,直至细胞密度降低为止,绘制生长曲线并求得最大增殖数量和倍增时间(PDT)[9]。
1.2.3.3 细胞的传代稳定性 取工作细胞库Vero细胞1支,复苏,按0.6×106cells/mL无菌接种至培养瓶中进行连续传代,共传20代,用细胞分析仪进行细胞密度和活率测定,比较48 h细胞密度及活率。
1.2.3.4 无菌、支原体和病毒检查 按《中国兽药典》三部(2020版)附录进行检查[10]。
1.2.3.5 染色体分析 参照《四种动物传代细胞染色体变异率分析》中染色体标本制备方法进行染色体制片,Gimesa染色后油镜下观察并拍照,分别对100个染色体铺展完好的片子进行统计分析[11]。
1.2.4 悬浮细胞培养工艺的放大
1.2.4.1 响应面试验设计 为了找到最佳的试验条件及因素间的交互作用,采用Box-Behnken试验设计,以细胞密度为响应值,以pH、溶氧和搅拌转速为影响因素,设计3因素3水平共17次试验的响应面试验,优化筛选出的最优培养参数。各因素及水平见表1。悬浮Vero细胞经摇瓶逐步扩大培养,按照初始密度为0.6×106cells/mL 接种于7.5 L生物反应器。采用搅拌式培养,有效培养体积为4 L,培养温度37 ℃,其余培养参数按表1所示的培养参数进行试验,并进行细胞计数。
1.2.4.2 优化结果的验证 用最优化的培养参数培养Vero细胞,比较此条件下的细胞密度与通过多元函数分析确定出的极值及取得极值所对应的变量值,以验证模型的可靠性,并确定最后优化的结果。

表1 Box-Behnken设计的因素及水平
2 结果
2.1 细胞驯化及传代
贴壁培养的Vero细胞在逐步降血清至无血清培养的过程中,细胞未表现出明显的形态差异,适应了无血清环境,表现为贴壁良好、细胞透亮、边缘清晰,形状多为长梭形,生长迅速,活力高,传代稳定。
将已适应无血清培养的Vero细胞用无血清培养基在125 mL三角瓶中传代,悬浮培养初期Vero细胞大量死亡,活率较低,增大接种密度以维持培养初期较高的密度,采用离心换液的方式传代,800 r/min离心5 min,传代8代~10代后逐步适应,生长速度逐渐变快,倍增时间逐步规律,获得了适应无血清悬浮培养的Vero细胞悬浮细胞。细胞呈圆形、饱满、透亮,边缘整齐,大小均匀,细胞液干净、透亮。细胞驯化过程中细胞生长情况见图1。
2.2 Vero细胞原始细胞库、主细胞库、工作细胞库的检定
2.2.1 细胞的形态观察 显微镜下观察发现,细胞圆形、饱满、透亮,边缘整齐,大小均匀,细胞液干净、透亮,呈现较好的悬浮生长状态(图2)。
2.2.2 Vero细胞复苏后的活率 原始细胞库、主细胞库及工作细胞库Vero细胞活率分别为95.4%、96.0%和95.5%,均高于80%。
2.2.3 Vero细胞系的生长曲线 Vero细胞的生长曲线均呈“ S ”型(图 3),最大增殖密度为4.2×106cells/mL,平均倍增时间为19.6 h。
2.2.4 Vero细胞的传代稳定性 连续传20代,48 h细胞活率在94.5%~96.5%之间,较稳定;从P3代开始,传代过程中细胞密度处于较稳定的范围内,表明细胞传代过程中生长较稳定(图4)。
2.2.5 无菌、支原体和病毒检查结果 无菌和支原体检查结果为阴性,病毒检查中未出现细胞病变、红细胞凝集和红细胞吸附现象。

A.100 mL/L血清培养的Vero细胞;B.适应无血清培养的Vero细胞;C.初始无血清悬浮培养的Vero细胞;D.适应无血清悬浮培养的Vero细胞。

图2 Vero细胞形态(200×)
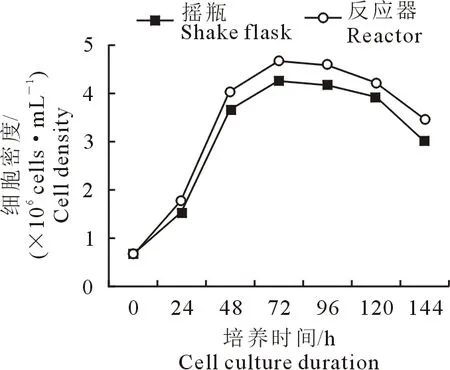
图3 Vero细胞系生长曲线
2.2.6 Vero细胞核型分析结果 对Vero细胞系的100个铺展完好的中期相的染色体数目进行统计,结果显示,Vero细胞系的染色体数为58或60的占75%,染色体中期分裂相见图5。
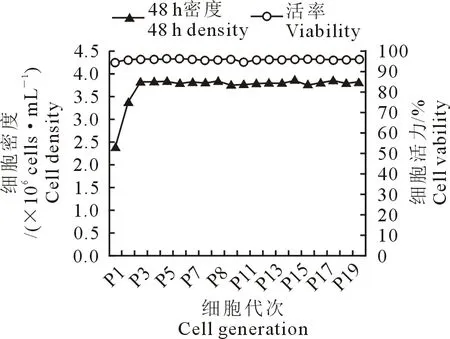
图4 细胞活率及48 h密度曲线

图 5 Vero细胞染色体的显微镜观察(1 000×)
2.3 生物反应器培养结果
2.3.1 响应面试验设计结果 响应面图呈马鞍型,表明有极值存在,决定系数R2为0.955 4,表明Y值变化的95.54%可由此模型解释,模型拟合程度较好。根据响应面变化情况,pH、溶氧和搅拌转速的最佳值为7.07、49.54%和80.45 r/min,在此条件下,预测细胞密度可达4.555×106cells/mL(表2和图6)。
2.3.2 优化结果的验证 用最优的pH、溶氧和搅拌转速在生物反应器中培养Vero细胞,细胞最大浓度为4.5×106cells/mL,较优化前的3.5×106cells/mL提高了0.28倍,为预测值的98.79%,符合度较高。
3 讨论
哺乳动物细胞无血清全悬浮培养技术经过多年的发展已日趋成熟,该技术具有较为显著的应用优势,是当前临床生物制品生产的主要技术工艺[12]。目前,已使用微载体在生物反应器中培养Vero细胞生产部分病毒性疫苗[13-17]。而采用Vero全悬浮细胞生产的疫苗在国内尚少见。

表2 中心组合试验设计及结果
细胞作为疫苗生产的基质,其质量直接影响疫苗的质量和安全性。一株细胞用于生产前必须进行全面的安全性评价[18]。评价的内容包括细胞来源、传代培养及驯化过程、细胞鉴别、复苏后活力、生长特征、微生物污染、外源病毒因子检查和细胞核学检查[19]。本研究驯化的全悬浮培养型Vero细胞来源清楚,有较高的复苏活力,细胞没有被细菌、真菌和支原体等微生物污染。外源病毒因子检查,排除了致细胞病变的病毒、致红细胞吸附的病毒等病毒的污染。建立的主细胞库及工作细胞库各项检测结果均符合《中国兽药典》规定,具有良好的传代稳定性。
生物反应器培养工艺的放大是一个十分复杂的技术问题,在放大培养过程中,混合和传质是培养细胞的重要因素[20]。同时,罐体越大造成的流体剪切力也会越大,影响细胞状态,尤其是悬浮细胞[21]。因此,需要对生物反应器的培养参数进行优化,以便获得高密度悬浮培养的细胞。本研究通过Box-Behnken试验设计,对生物反应器培养参数pH、溶氧和搅拌转速进行了优化,经优化后的参数培养细胞,增殖密度可达4.5×106cells/mL,较优化前的3.5×106cells/mL提高了0.28倍,实现了Vero细胞生物反应器高密度培养。

A.pH和溶氧;B.pH和搅拌转速;C.溶氧和搅拌转速
综上所述,本研究通过逐步降血清和改变培养液的方法,获得1株无血清全悬浮培养Vero细胞系,通过优化生物反应器培养参数,实现了在7.5 L反应器中的高密度培养,为该细胞的全悬浮规模化生产提供了参考。

