非洲猪瘟病毒防污染双重荧光定量PCR检测方法的建立
卞志标,郭怡德,席振军,柯海意,蔡汝健,孙铭飞,勾红潮,李春玲
(广东省农业科学院动物卫生研究所/广东省畜禽疫病防治研究重点实验室/农业部兽用药物与诊断技术广东科学观测实验站,广东广州 510640)
非洲猪瘟(African swine fever,ASF)是由非洲猪瘟病毒(African swine fever virus,ASFV)感染引起的一种急性、热性、高度接触性传染病。ASFV属非洲猪瘟相关病毒科非洲猪瘟病毒属,是一种有囊膜的双股线状DNA病毒,具有24个基因型[1]。世界动物卫生组织(WOAH)将其列为法定报告的动物疫病,我国将其列为一类动物疫病[2-3]。2018年8月3日,我国确诊首例非洲猪瘟疫情,至今在全国各地均有报道,给养猪业带来了严重的经济损失[4]。快速准确的诊断方法对于非洲猪瘟的及时发现和综合防控至关重要[5-6],该病常用的检测诊断方法主要包括病毒分离、间接免疫荧光试验、ELISA、PCR等。病毒分离和间接免疫荧光试验虽属标准检测方法,但操作繁琐,很难在条件一般的实验室开展[7]。探针法荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qPCR)技术具有操作简单、敏感性高、特异性好等优点[8],目前针对P72基因已开发出多种检测试剂盒,在ASFV检测方面得到广泛应用。
ASFV的C962R基因全长约2.54 kb,编辑DNA引物酶,在ASFV中具有较强的保守性,可作为P72基因之外新的检测靶标[9]。另外,临床已发现MGF基因缺失的变异株流行[10],并表现出新的流行特点,加大了非洲猪瘟的诊断和防控难度。MGF-505-2R基因组全长约1.5 kb,属于MGF-505基因簇的一员。MGF-505基因簇与ASFV宿主范围特异性、宿主先天反应阻断和病毒毒力有关[11],因此可作为区分ASFV野毒株和MGF基因缺失变异株的靶基因。
本研究基于GenBank中已公布的ASFV高度保守C962R基因和毒力相关基因MGF-505-2R分别设计引物和探针,建立了ASFV双重qPCR检测方法,解决了ASFV核酸检测靶标基因过分单一的问题,预期为ASFV野毒株和MGF基因缺失变异株的鉴别检测提供技术储备。
1 材料与方法
1.1 材料
1.1.1 细菌、病毒、试验用动物及病料 猪丹毒丝菌 (Erysipelothrixrhusiopathiae)、副猪嗜血杆菌(Hoemophilusparasuis,HPS)、链球菌(Streptococcussuis,SS)、猪传染性胸膜肺炎放线杆菌(Actinobacilluspleuropneumoniae,APP)、猪圆环病毒2型(Porcine circovirus 2,PCV2)、猪伪狂犬病病毒(Pseudorabies virus,PRV),由广东省农业科学院动物卫生研究所猪病研究室分离、鉴定并保存;MGF-505-2R和C962R基因质粒,由生工生物工程(上海)股份有限公司合成;SPF级西藏小型猪购于南方医科大学实验动物中心;病料我从不同地区采集的194份猪临床组织样品,其中心脏40份,肝脏30份,脾脏30份,肺脏40份,肾脏28份,脑组织12份和淋巴结14份。
1.1.2 主要试剂 2×AceQ Universal U+ Probe Master Mix V2qPCR试剂,南京诺唯赞生物科技股份有限公司产品;核酸提取试剂盒(HP Tissue DNA Maxi Kit D5196),美国Omega公司产品;ASFV抗原检测试剂盒(批号:Q03-001-211101),北京森康生物技术开发有限公司产品。
1.1.3 主要仪器 LightCycler96实时qPCR仪,美国Roche公司产品;Beckman Microfa 离心机,德国贝克曼公司产品;ESCO AC2-481超净工作台,新加坡艺思高科技有限公司产品;PCR-0108-LP-RT-WqPCR管,美国Axygen公司产品;TDZ5-WS(多管自动)离心机,湖南赛特湘仪离心机仪器有限公司产品。
1.2 方法
1.2.1 引物与探针的设计 根据NCBI数据库中ASFV Georgia 2007/1株的MGF-505-2R序列(Gene ID:41902793),通过Primer5软件设计合成检测MGF-505-2R基因的引物和探针(表1)。另根据NCBI数据库中ASFV Georgia 2007/1株的C962R基因序列(Gene ID:41902841),使用软件进行比对,筛选出C962R基因的保守序列,并通过Primer5软件设计检测C962R基因的引物和探针(表2)。引物和探针由生工生物工程(上海)股份有限公司合成。
1.2.2 荧光定量聚合酶链反应阳性标准品的制备MGF-505-2R基因和C962R基因的质粒,由生工生物工程(上海)股份有限公司合成,将MGF-505-2R基因质粒、C962R基因质粒和这2种质粒1∶1比例混合物进行浓度梯度稀释作为qPCR标准品。
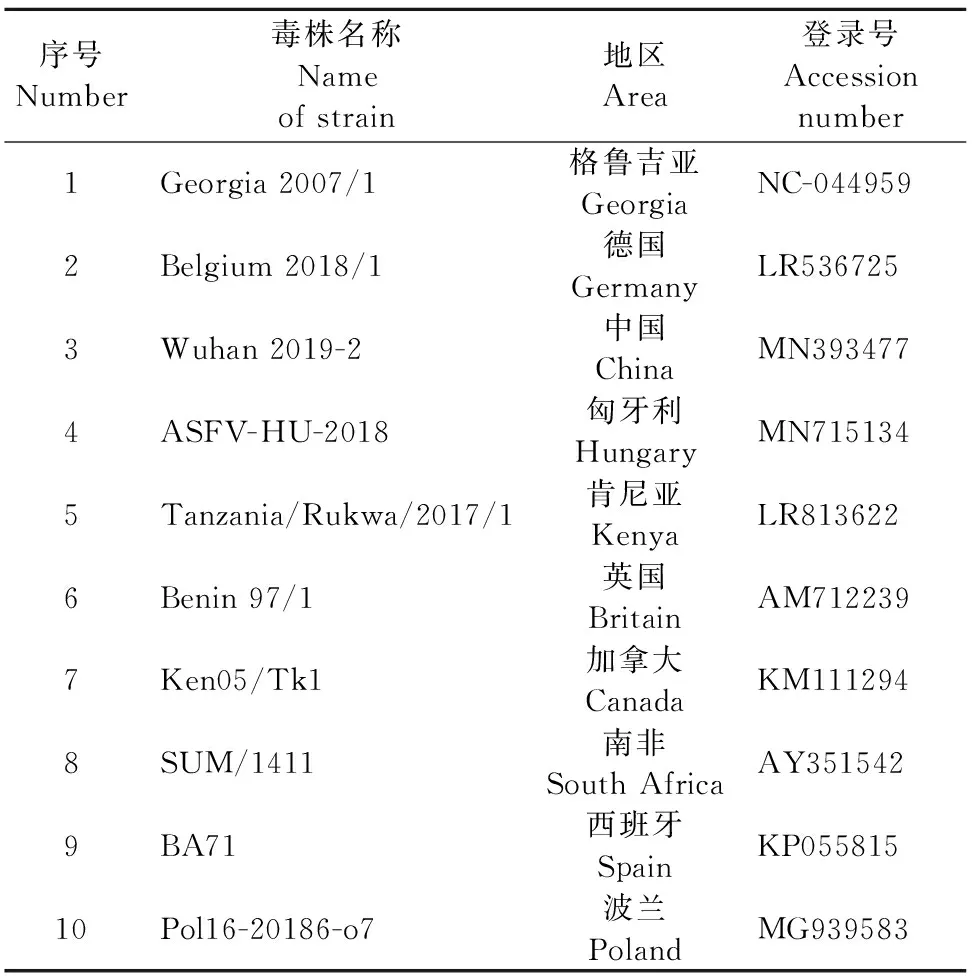
表1 引物设计所用的ASFV参考毒株
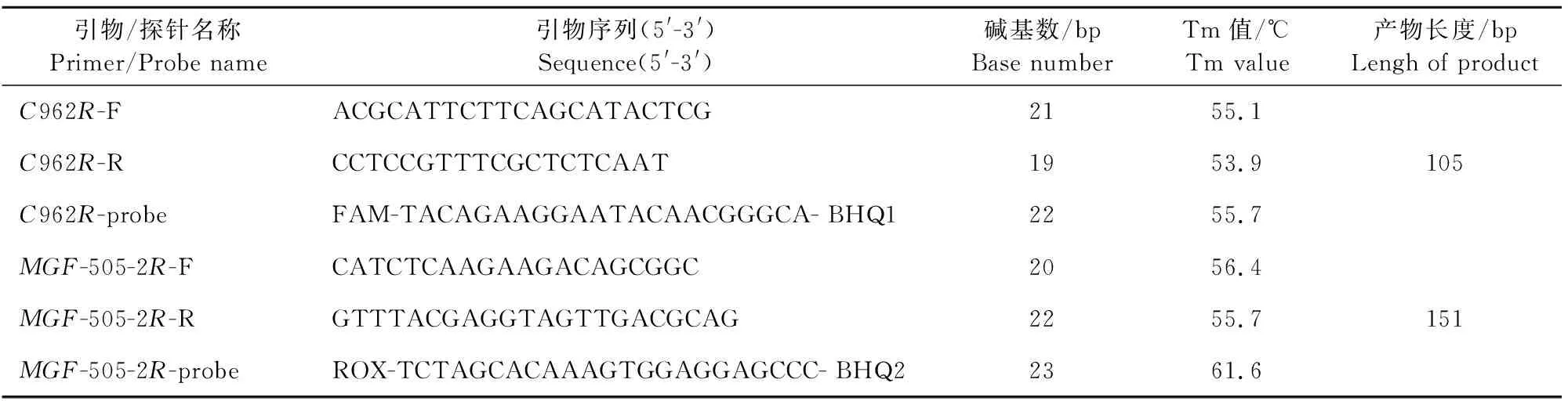
表2 基于C962R基因和MGF-505-2R基因设计的引物及探针
1.2.3MGF-505-2R基因和C962R基因荧光定量聚合酶链反应条件的优化 使用矩阵法分别对MGF-505-2R基因和C962R基因的引物、探针以及退火温度进行梯度优化试验。通过对试验结果中Ct值和荧光信号的综合分析,优化出2个基因的最佳反应体系和反应条件。
1.2.4 敏感性试验 以浓度为1×105、1×104、1×103、1×102、1×101,1 copies/μL的标准品为模板,进行探针法双重qPCR扩增,验证其敏感性。
1.2.5 特异性试验 分别提取Ery、HPS、SS、APP、PCV2、PRV的DNA,用所建立的ASFV探针法双重qPCR方法进行检测。
1.2.6 重复性试验 对不同浓度的标准品(1×105~1×102copies/μL)进行批内和批间重复检测,每个样品分别设3次批内和批间重复,对检测结果进行变异系数分析。
1.2.7 防污染试验 为了验证ASFV的防污染双重qPCR检测方法能够有效减少气溶胶导致假阳性的产生,试验将浓度为1×103copies/μL的标准品作为模板,使用ASFV的防污染双重qPCR进行扩增后,将产物进行浓度梯度稀释。进一步,将稀释的产物作为模板,分别使用含尿嘧啶-N-糖基化酶(uracil-N-glycosylase,UNG)和不含UNG酶的两个体系同时进行qPCR扩增,并对检测结果进行分析。
1.2.8 非洲猪瘟病毒探针法双重荧光定量聚合酶链反应的临床样本检测 为了初步评价该检测方法的临床应用效果,采集SPF级西藏小型猪的扁桃体、淋巴结和脾脏等免疫器官,将扁桃体、淋巴结和脾脏的研磨液分别与不同浓度的标准品进行混合制备样品(200 μL),每个器官分别设置1号、2号、3号和阴性对照组,其对应质粒拷贝浓度依次为1×104、1×103、1×102、0 copies(表3),对制备的各组样品进行基因组DNA提取,然后用建立的ASFV探针法双重qPCR方法进行检测,每组样品做3个重复。通过对比检测结果,分析ASFV探针法双重qPCR在检测方面的初步应用。另外使用本检测方法对不同地区采集的194份猪临床组织样品进行检测,检测结果与商品化非洲猪瘟抗原检测试剂盒进行比较,计算结果的符合率。

表3 检测方法初步应用实验用样品的制备
2 结果
2.1 阳性标准品制备
C962R基因质粒与MGF-505-2R基因质粒由生工生物工程(上海)股份有限公司合成,将2种质粒分别稀释至拷贝数为1×1010copies/μL作为原液,取10 μLMGF-505-2R基因质粒和10 μLC962R基因质粒原液混合加入80 μL ddH2O稀释,然后梯度稀释为1×106、1×105、1×104、1×103、1×102、1×101、1 copies/μL,即为ASFV探针法双重qPCR的标准品。
2.2 非洲猪瘟病毒探针法双重荧光定量PCR条件的优化
对MGF-505-2R基因和C962R基因的引物及探针的浓度进行优化,确定ASFV探针法双重qPCR的最佳反应体系为:MGF-505-2R基因和C962R基因的上、下游引物终浓度均为0.2 μmol/L,探针浓度为0.1 μmol/L,标准品模板1 μL,Vazyme Probe Mix(诺唯赞探针法预混液)10 μL,补ddH2O至20 μL。最佳反应条件为95 ℃预变性5 min;95 ℃ 15 s,60 ℃ 30 s,共45个循环;40 ℃冷却1 min。
2.3 敏感性试验
以浓度梯度浓度稀释为1×105、1×104、1×103、1×102、1×101、1 copies/μL的阳性标准品为模板进行qPCR扩增,获得扩增曲线(图1),当标准品拷贝数为1×101copies/μL时,仍有S型扩增曲线,结果表明,该检测方法最低可检测到1×101copies/μL。将浓度值与Ct值代入公式:

2.4 特异性试验
应用建立的ASFV探针法双重qPCR对1×104copies/μL标准品模板、Ery、HPS、SS、APP、PCV2和PRV的DNA进行扩增,仅标准品模板有特异性曲线,而Ery、HPS、SS、APP、PCV2和PRV均未出现扩增曲线(图2),说明该检测方法具有良好的特异性。

ROX:R1.1×105 copies/μL;R2.1×104 copies/μL;R3.1×103 copies/μL;R4.1×102 copies/μL;R5.1×101 copies/μL;R6.1 copies/μL;R7.0 copies/μL。
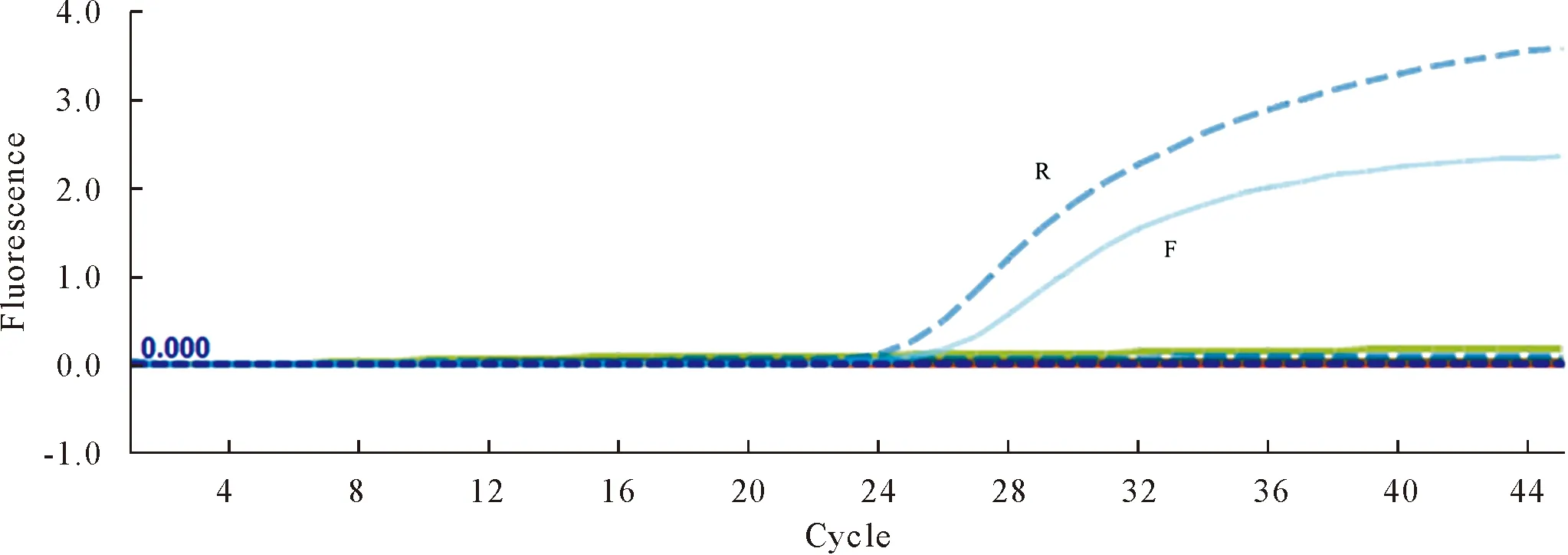
ROX:R.1×105 copies/μL;FAM:F.1×105 copies/μL
2.5 批内重复性试验结果
由表4和表5可知,取1×105、1×104、1×103、1×102copies/μL 4个浓度的标准品进行批内重复试验,每个浓度重复3次,结果显示各浓度Ct值变异系数为0.07%~1.75%,说明本试验建立的ASFV探针法双重qPCR检测方法在批内具有良好的重复性。
2.6 批间重复性试验结果
由表6和表7可知,取1×105,1×103,1×102,1×101copies/μL 4个浓度的标准品在同一条件下进行3次重复检测,结果显示各浓度Ct值变异系数为0.14%~1.20%,说明本试验建立的ASFV探针法双重qPCR检测方法在批间具有良好的重复性。

表4 ASFV探针法双重qPCR的FAM通道批内重复性试验
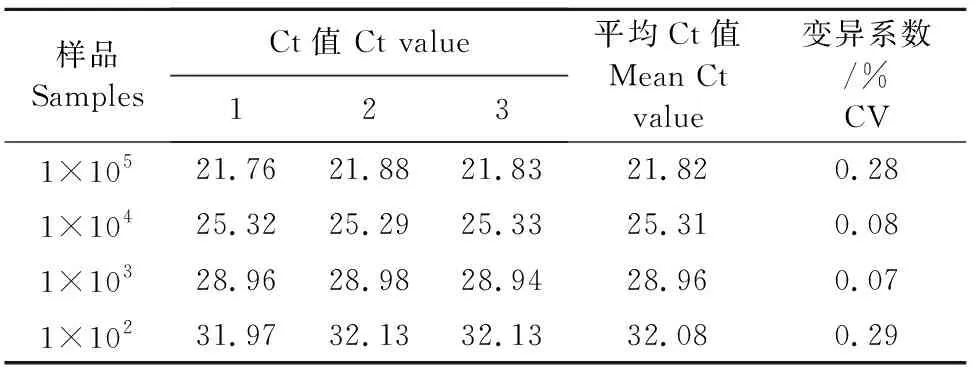
表5 ASFV探针法双重qPCR的ROX通道批内重复性试验
2.7 防污染试验结果
使用1×103copies/μL的标准品作为模板进行PCR反应,得到的产物通过胶回收纯化,得到的样品浓度为76 ng/μL,将样品进行浓度梯度稀释为7.6×101、7.6、7.6×10-1、7.6×10-2、7.6×10-3、7.6×10-4、7.6×10-5fg/μL,进一步对以上样品进行qPCR检测,结果如图3A和图3B所示,在不含UNG酶的情况下,所有测试样品都产生了阳性结果,特别是从这些DNA水平无法检测的样本中产生的阳性结果,被认为是假阳性。然而,如图3C和图3D所示,在含有UNG酶的情况下,FAM通道反应能够消除小于7.6×10-2fg/μL的假阳性扩增,ROX通道能够消除小于7.6×10-1fg/μL的假阳性扩增,结果表明,本研究建立的ASFV的防污染双重qPCR检测方法可以有效地消除低剂量污染产生的假阳性扩增。

表6 ASFV探针法双重qPCR的FAM通道批间重复性试验
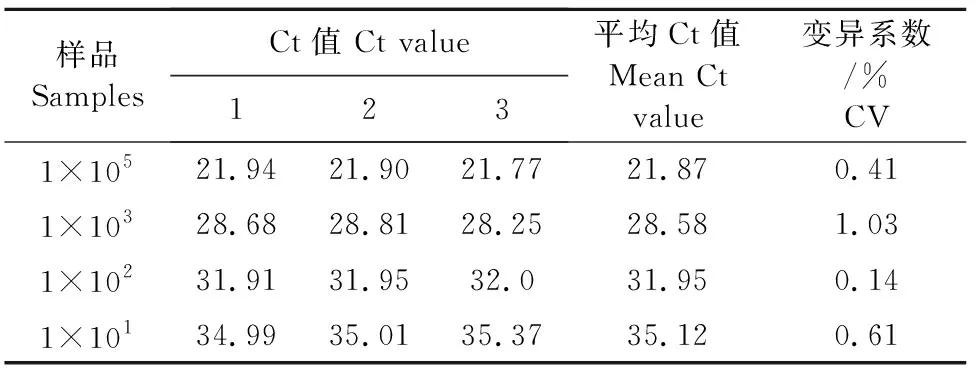
表7 ASFV探针法双重qPCR的ROX通道批间重复性试验
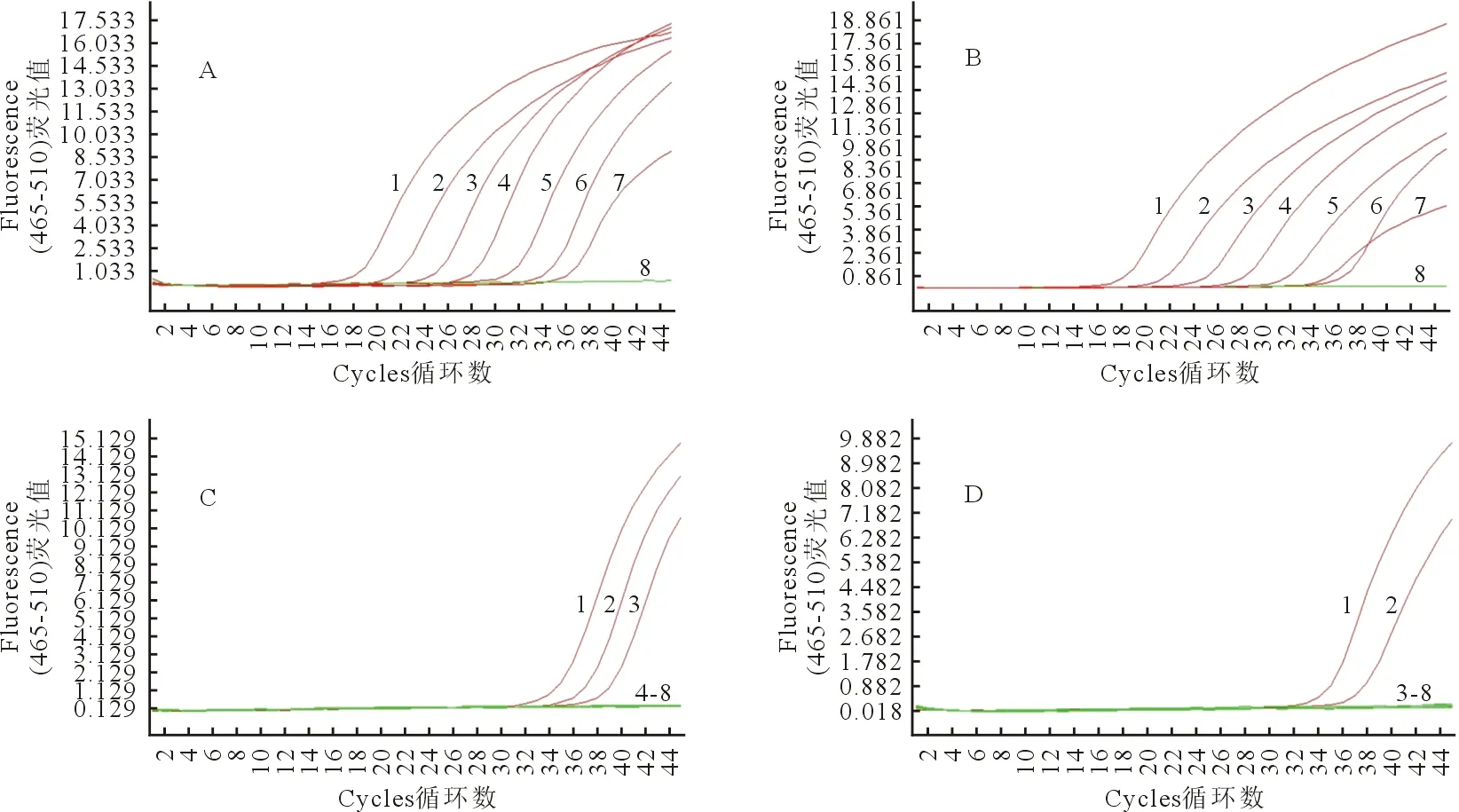
A.不含UNG酶反应体系的FAM通道检测结果;B.不含UNG酶反应体系的ROX通道检测结果;C.含UNG酶反应体系的FAM通道检测结果;D.含UNG酶反应体系的ROX通道检测结果;曲线1~8分别表示PCR产物(7.6×101、7.6、7.6×10-1、7.6×10-2、7.6×10-3、7.6×10-4、7.6×10-5、0 f g/μL)
2.8 非洲猪瘟病毒探针法双重荧光定量PCR的初步应用及临床样本检测结果
由表8和表9可知,对扁桃体1号、扁桃体2号、扁桃体3号、扁桃体阴性、淋巴结1号、淋巴结2号、淋巴结3号、淋巴结阴性、脾脏1号、脾脏2号、脾脏3号、脾脏阴性共12个样品进行检测,每个样品做3个重复,结果显示,对于100 copies~10 000 copies的样本进行核酸提取并检测,检出率为100%。与敏感性结果比较,相同数量拷贝的样本Ct无明显差异。与特异性结果比较,猪淋巴结等免疫器官的基因组不发生非特异性反应。另外,对于194份临床样本的检测结果均为阴性,与商品化非洲猪瘟抗原检测试剂盒的检测结果相比较,符合率为100%。综合以上结果,说明本试验建立的ASFV探针法双重qPCR检测方法效果良好,能够从复杂的组织样品中特异的检测出C962R基因和MGF-505-2R基因,与商品化非洲猪瘟抗原检测试剂盒比较,检测结果的符合率为100%。
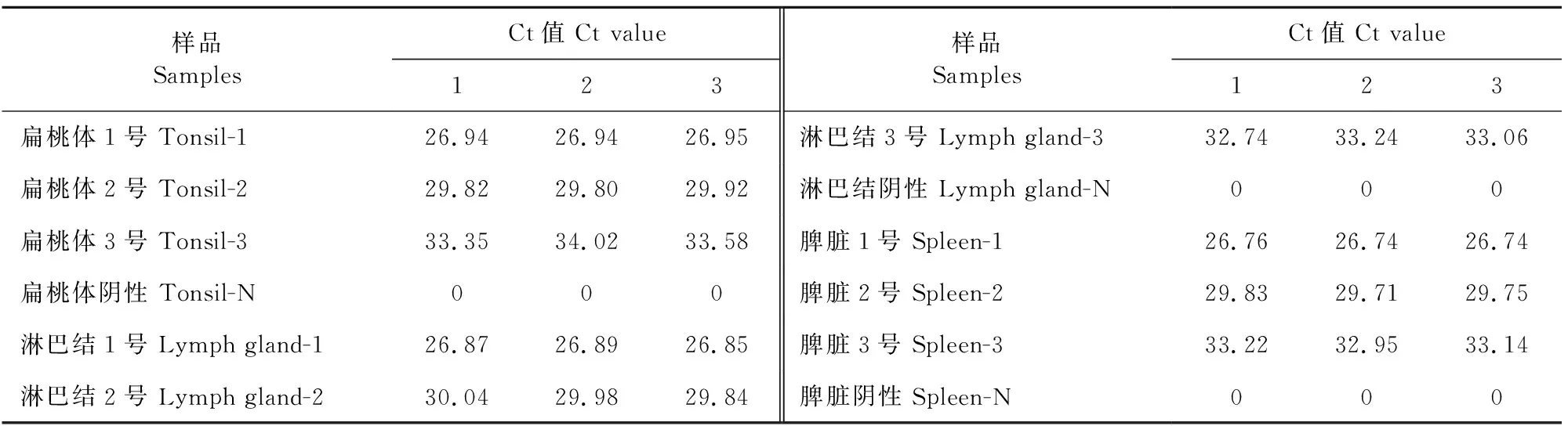
表8 ASFV探针法双重qPCR的FAM通道初步应用检测结果

表9 ASFV探针法双重qPCR的ROX通道初步应用检测结果
3 讨论
目前针对非洲猪瘟的防控,精准快速的诊断技术配合科学的生物安全措施是最有效的处理方法。在众多的检测方法中,qPCR具有操作简单、敏感性高、特异性好等优点,是目前ASFV检测应用最广的方法之一[12]。但是,目前市面上ASFV的检测只针对P72基因。由于qPCR的高敏感,即使有少量的气溶胶污染,也会导致假阳性的产生,因此实验室一旦发生P72基因气溶胶污染,将无法准确判定待测样本的阴性或阳性。另外,近日临床上已发现MGF基因缺失的变异株,并出现新的流行特点,加大了非洲猪瘟的诊断和防控难度,目前针对P72基因的检测方法将无法区分野毒株与变异株。为解决以上难题,本研究基于C962R基因和MGF-505-2R基因分别设计引物和探针,构建了ASFV防污染双重qPCR检测方法。
常用的qPCR检测方法包括SYBR Green qPCR和TaqMan探针qPCR检测方法等,其中SYBR Green qPCR方法是通过荧光染料与双链DNA结构结合显示荧光,即体系中任何双链DNA结构存在都会显示荧光,故容易出现假阳性[13]。另外,目前对于DNA的测定,现行质量标准中含量测定方法采用紫外吸收法[14],但紫外吸收法的对样品的纯度有较高的要求,一般要求核酸浓度大于0.25 μg/mL[15],对于气溶胶等无法进行DNA测定的低剂量环境污染样本,容易产生假阳性结果[16]。本研究建立的双重qPCR检测方法是根据TagMan探针qPCR原理设计,由于TagMan探针能与病毒基因特异性结合,可以有效避免假阳性的产生。另外,本研究通过在反应体系中加入dUTP和UNG酶 ,可有效防止气溶胶等低剂量污染导致假阳性的产生[17]。该检测方法具有良好的线性关系,C962R基因与MGF-505-2R基因的线性相关系数分别为0.997 6和0.998 3。敏感性与Wang A P和Jia R等[18]建立的ASFV实时qPCR检测方法高10倍,比WOAH推荐的qPCR方法高100倍,并且与多种病症相似的猪疫病病原(Ery、HPS、SS、APP、PCV2和PRV)均无交叉反应。批内和批间重复性试验变异系数均小于1.75%,表明本研究建立的检测方法重复性良好。对于该检测方法初步应用的模拟试验说明,该检测方法可以从复杂样品特异的检测出C962R基因和MGF-505-2R基因,可用于野毒株与MGF变异株的鉴别诊断,对于194个临床组织样品的检测结果表明,该检测方法与商品化试剂盒的阴性符合率为100%。
综上所述,本研究建立的检测方法扩增效率高,敏感性、特异性和重复性良好,一方面解决了市面上针对P72基因检测单一性的问题,另一方面解决了类似气溶胶低剂量污染产生假阳性的难题。该方法可用于野毒株与MGF-505-2R基因变异株的鉴别诊断,可为深入开展分子流行病学调查提供技术储备。

