沙棘多糖对脑胶质瘤大鼠的抑瘤作用及对HMGB1、MGMT及TLR4表达的影响
徐大伟,刁玉领,惠 磊,周文科,汲乾坤
脑胶质瘤由大脑和脊髓胶质细胞癌变所产生,约占所有原发性颅脑肿瘤的51.4%,呈现细胞异常增殖、快速弥漫性浸润和抗凋亡的侵袭性特征,影响脑组织功能,对病人生命健康及生活质量造成极大威胁[1-2]。目前脑胶质瘤的临床治疗主要依靠外科手术,并辅以新的放疗(适形、调强放疗)和药物化疗,但病人生存率仍然较低。因此,开发安全有效的药物对提高病人生存质量具有重要意义。沙棘的浆果是传统药用食品,具有活血散瘀、化痰宽胸、补脾健胃、清热止泻、缓解疼痛等功效,在肿瘤预防治疗、增强免疫、抗炎、抗衰老等方面具有明显效果[3-4]。沙棘多糖(hippophae rhamnoides polysaccharide,HRP)是从沙棘果中提取的一种多糖类物质,具有抑菌、抗氧化、抗病毒、抗肿瘤、防衰老以及肝脏保护等作用[5]。目前,HRP对脑胶质瘤的药理活性及作用机制研究较少,本研究拟通过建立脑胶质瘤大鼠模型,探讨HRP的抑瘤作用及可能机制,为HRP类药物的研究和脑胶质瘤的临床治疗提供实验依据。
1 材料与方法
1.1 材料
1.1.1 细胞系和实验动物 大鼠C6脑胶质瘤细胞株购自中国科学院上海生命科学研究院细胞资源中心。无特定病原体(SPF)级SD雄性大鼠60只,7周龄,体质量(200±20)g,购自北京维通利华实验动物技术有限公司[SCXK(京)2016-0011]。购入后在SPF环境中适应性饲养1周。
1.1.2 主要试剂和仪器 HRP(纯度>90%)购自上海诗丹德标准技术服务有限公司;替莫唑胺购自北京嘉瑞时代科技有限公司;兔抗大鼠高迁移率族蛋白B1(high mobility group box-1,HMGB1)一抗、O6-甲基鸟嘌呤-DNA-甲基转移酶(O6-methylguanine-DNA-methyltransferase,MGMT)一抗、Toll样受体4(Toll-like Receptor 4,TLR4)一抗购自美国Thermo Fisher Scientific公司,小鼠抗大鼠β-actin一抗购自美国Santa Cruz公司,HRP标记的羊抗兔二抗、HRP标记羊抗鼠二抗购自英国Abcam公司;磁共振成像(MRI)扫描仪(MiniMR-60实验动物核磁共振成像仪)购自上海纽迈电子科技有限公司;流式细胞仪购自美国BD公司;蛋白凝胶电泳仪购自上海天能科技有限公司。
1.2 方法
1.2.1 大鼠C6脑胶质瘤细胞培养 复苏大鼠C6脑胶质瘤细胞,加入体积分数10%灭活新生胎牛血清的RPMI-1640培养基(含NaHCO32 g/L,青霉素100 U/mL,链霉素100 U/mL)中,将培养瓶置于37 ℃、5%CO2恒温恒湿密闭细胞培养箱中培养,采用单层培养法传代。取10 μL对数生长期C6细胞,苔盼蓝排斥实验检测细胞活力>95%。用红细胞计数板光镜下计数,调节浓度至每10 μL含1×106个细胞。
1.2.2 建立大鼠脑胶质瘤模型 取60只SD大鼠,用1.5%戊巴比妥钠(30 mg/kg)腹腔注射麻醉大鼠,大鼠脑立体定向仪头架固定头部,两耳针深入外耳道,剪去头顶部毛发,消毒后铺洞巾。头顶双侧眼裂连线后约1.5 cm处横向剪开头皮,逐层暴露至颅骨,确定前囟位置。囟中点前1 mm,矢状缝右侧旁开3.0~3.5 mm,接种部位为大鼠右侧尾状核,自接种点垂直进针,从接触硬膜开始计算,进针深度约6 mm,后退1 mm,10 min内将10 μL细胞悬液(含有约1.0×106个C6细胞)缓慢注入脑组织,注射完毕留针5 min,缓慢退针,用骨蜡封闭骨孔,逐层缝合头皮切口。给予3 d含抗生素的饮用水预防感染。接种后10 d,行强化头部MRI,确定是否有肿瘤形成。
1.2.3 分组及药物干预 有3只大鼠在造模过程中死亡,将造模成功的57只大鼠随机分为模型组(15只)、HRP低剂量组(14只)、HRP高剂量组(14只)、替莫唑胺组(14只)。HRP低剂量组、HRP高剂量组分别给予HRP 100 mg/kg、200 mg/kg,用生理盐水溶解后灌胃,每日1次,连续给药10 d;替莫唑胺组给予替莫唑胺 20 mg/kg,用生理盐水溶解后灌胃,每日1次,连续给药10d;在实验期间模型组灌胃相同体积的生理盐水。
1.2.4 大鼠脑胶质瘤体积及抑瘤率测算 治疗结束24 h后,对每组大鼠进行头颅MRI检查,测量肿瘤长短径,按照公式计算各组肿瘤体积及抑瘤率。肿瘤体积=a×b2/2(a为测量的肿瘤长径,b为肿瘤短径);抑瘤率=(模型组肿瘤体积-治疗组肿瘤体积)/模型组肿瘤体积×100%,抑瘤率≥30%为肿瘤对药物敏感。
1.2.5 苏木精-伊红(HE)染色观察大鼠脑胶质瘤形态学变化 断头处死大鼠,分离大脑,沿移植C6细胞的进针点做冠状切口,4%多聚甲醛固定,石蜡包埋,组织切片(厚度约为3 μm),二甲苯脱蜡,苏木精、伊红染色,梯度乙醇脱水,二甲苯透明,中性树胶封片,光学显微镜下观察肿瘤细胞数量、密度及坏死等形态学变化。
1.2.6 流式细胞仪检测肿瘤组织细胞凋亡和细胞周期 每组取3只大鼠,取出大鼠脑胶质瘤组织,剪碎,300目尼龙滤网过滤,制备肿瘤单细胞悬液,1 000 r/min(离心半径10 cm)离心5 min,弃上清,磷酸缓冲盐溶液(PBS)清洗,调整细胞浓度至1×106个/mL,乙醇4 ℃固定18 h,离心弃上清,PBS重悬,加入RNA酶(Rnase)碘化丙啶(propidium iodide,PI)染色液37 ℃避光染色30 min,流式细胞仪检测肿瘤细胞凋亡率和细胞周期。数据用CellQuest软件进行分析。
1.2.7 实时荧光定量聚合酶链式反应(PCR)检测肿瘤组织中HMGB1、MGMT和TLR4 mRNA水平 取60 mg脑胶质瘤组织,加入液氮研磨,按照Trizol试剂说明书提取RNA,超微量分光光度计测定RNA浓度及A260/280。反转录cDNA,配制PCR反应体系:2×SYBR Green Master Mix 10 μL,2.5 μmol/L正向、反向引物各1 μL,模板cDNA 2 μL,ddH2O 6 μL;反应程序:95 ℃预变性60 s;95 ℃,15 s;60 ℃,15 s;72 ℃,45 s,共循环40次。待测基因PCR引物使用Primer 3.0设计,引物序列见表1。

表1 待测基因名称及引物序列
1.2.8 蛋白免疫印迹法(Western Blot)检测肿瘤组织中HMGB1、MGMT和TLR4蛋白表达 取100 mg脑胶质瘤组织,液氮研磨,加入裂解液裂解,匀浆液4 ℃,10 000 r/min离心15 min,取上清即为蛋白样品。二喹啉甲酸(BCA)法测定总蛋白浓度,加入电泳上样缓冲液后100 ℃金属浴加热5 min使蛋白变性,10%聚丙烯酰胺凝胶(SDS-PAGE)进行电泳,电泳结束后将蛋白转移至聚偏二氟乙烯(PVDF)膜,5%脱脂牛奶室温封闭1 h,分别用HMGB1一抗(1∶1 000)、MGMT一抗(1∶1000)、TLR4一抗(1∶125)、β-Actin一抗(1∶1 000)4 ℃孵育过夜,TBST洗膜3次,每次5 min。加入1∶2 000稀释的HRP标记的二抗中室温孵育1 h,TBST洗膜3次,每次5 min,加入增强型化学发光试剂(ECL)化学发光液,暗室曝光显影,使用Image J软件进行蛋白条带灰度值分析,以目的蛋白条带灰度值/内参β-actin蛋白条带灰度值的比值作为目的蛋白相对表达水平。

2 结 果
2.1 各组大鼠肿瘤体积和抑瘤率比较 各组肿瘤体积、抑瘤率组间比较,差异有统计学意义(P<0.001)。与模型组比较,HRP低剂量组、HRP高剂量组、替莫唑胺组肿瘤体积减小(P<0.05);与HRP低剂量组比较,HRP高剂量组、替莫唑胺组肿瘤体积减小(P<0.05),抑瘤率升高(P<0.05);与HRP高剂量组比较,替莫唑胺组抑瘤率降低(P<0.05)。详见表2。

表2 各组大鼠肿瘤体积和抑瘤率比较(±s)
P<0.05;与HRP高剂量组比较,③P<0.05。
2.2 HE染色观察 HE染色显示,模型组脑胶质瘤内肿瘤细胞生长活跃,数量丰富,排列密集,核大深染,肿瘤细胞异型性明显,核浆比例高,核分裂现象多见,呈浸润性生长,无明显细胞萎缩坏死现象;HRP低剂量组细胞数量较模型组减少,细胞生长密度降低,有部分坏死;HRP高剂量组可见凋亡细胞,数量明显减少,生长密度降低,细胞体积变小,细胞核形态相对规则,出现萎缩、栅栏状坏死现象;替莫唑胺组较模型组、HRP低剂量组细胞数量减少,但较HRP高剂量组多,可见少量萎缩坏死细胞。详见图1。
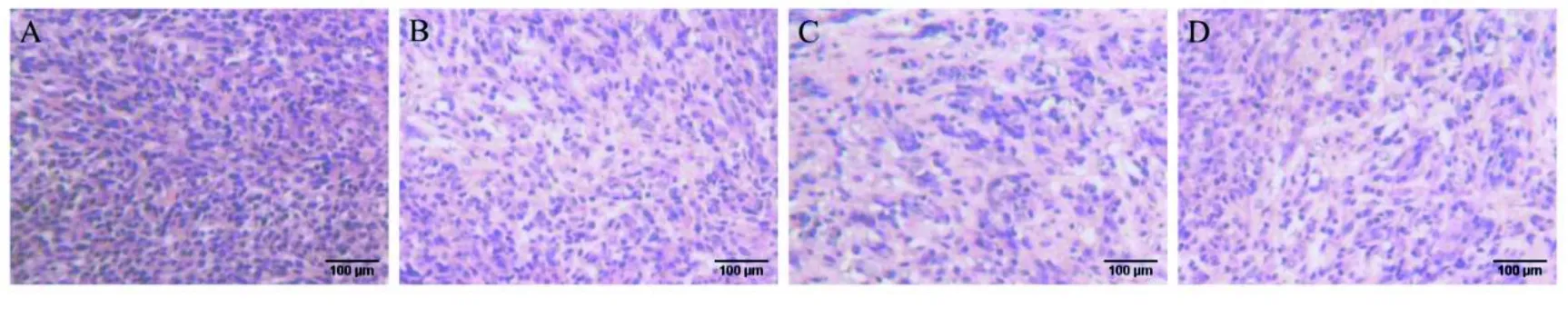
图1 各组肿瘤组织HE染色结果(×200) (A为模型组;B为HRP低剂量组;C为HRP高剂量组;D为替莫唑胺组)
2.3 各组大鼠肿瘤组织细胞凋亡和细胞周期 各组Sub-G1期、G0/G1期、S期与G2/M期细胞及凋亡率组间比较,差异均有统计学意义(P<0.001)。与模型组比较,HRP低剂量组、HRP高剂量组和替莫唑胺组Sub-G1期、G0/G1期细胞增加,S期、G2/M期细胞减少,凋亡率升高,差异均有统计学意义(P<0.05);与HRP低剂量组比较,HRP高剂量组和替莫唑胺组Sub-G1期、G0/G1期细胞增加,S期、G2/M期细胞减少,凋亡率升高,差异均有统计学意义(P<0.05);与HRP高剂量组比较,替莫唑胺组Sub-G1期、G0/G1期细胞减少,S期、G2/M期细胞增加,凋亡率降低,差异均有统计学意义(P<0.05)。详见表3。

表3 各组大鼠肿瘤组织细胞周期和细胞凋亡率比较(±s) 单位:%
2.4 各组大鼠肿瘤组织中HMGB1、MGMT和TLR4 mRNA水平比较 各组肿瘤组织中HMGB1、MGMT和TLR4 mRNA相对表达量比较,差异均有统计学意义(P<0.001)。与模型组比较,HRP低剂量组、HRP高剂量组和替莫唑胺组HMGB1、MGMT和TLR4 mRNA相对表达量均降低(P<0.05);与HRP低剂量组比较,HRP高剂量组、替莫唑胺组HMGB1、MGMT和TLR4 mRNA相对表达量均降低(P<0.05);与HRP高剂量组比较,替莫唑胺组HMGB1、MGMT和TLR4 mRNA相对表达量均升高(P<0.05)。详见表4。

表4 各组大鼠肿瘤组织HMGB1、MGMT、TLR4 mRNA表达水平比较(±s)
2.5 各组大鼠肿瘤组织中HMGB1、MGMT和TLR4蛋白表达水平 各组肿瘤组织中HMGB1、MGMT和TLR4蛋白相对表达量比较,差异均有统计学意义(P<0.001)。与模型组比较,HRP低剂量组、HRP高剂量组及替莫唑胺组HMGB1、MGMT和TLR4蛋白相对表达量均降低(P<0.05);与HRP低剂量组比较,HRP高剂量组和替莫唑胺组HMGB1、MGMT和TLR4 蛋白相对表达量均降低(P<0.05);与HRP高剂量组比较,替莫唑胺组HMGB1、MGMT和TLR4蛋白相对表达量均升高(P<0.05)。详见表5及图2。

表5 各组肿瘤组织中HMGB1、MGMT和TLR4蛋白表达水平比较(±s)

图2 各组肿瘤组织中HMGB1、MGMT和TLR4蛋白表达条带图(A为模型组;B为HRP低剂量组;C为HRP高剂量组;D为替莫唑胺组)
3 讨 论
脑胶质瘤的发生率占颅内肿瘤的35%~60%,其总发病率达到5/10万,死亡率高居癌症前列,恶性脑胶质瘤病人平均寿命仅为14个月[6]。恶性胶质瘤呈浸润性生长,边界不清,手术难以大范围彻底切除,导致其易复发,多数胶质瘤对放射线不敏感,化疗药物难以进入颅内,相当一部分肿瘤对抗癌药物耐药,且副作用大,导致临床效果不理想。植物中的多糖成分副作用相对较小,临床已被成功用于抗肿瘤治疗[7-8],多糖可通过阻滞细胞周期及诱导凋亡等途径发挥抗肿瘤作用[9-10]。HRP的水解单糖含有阿拉伯糖、鼠李糖、木糖等,其抗肿瘤作用已被证实[11]。
C6大鼠脑胶质瘤模型操作简便,成瘤率高,可重复性好,颅外远隔部位转移率低,与人脑胶质瘤病理特征相似。本研究将C6大鼠脑胶质瘤细胞接种于SD大鼠的右侧尾状核区,成功建立了脑胶质瘤动物模型。通过测量肿瘤体积及抑瘤率发现,经HRP、替莫唑胺干预后肿瘤体积较模型组明显减小,抑瘤率均大于30%。其中,HRP高剂量组抑瘤率最高,达44.41%。对肿瘤组织进行病理学观察及细胞周期与凋亡检测发现,与模型组比较,HRP低剂量组、HRP高剂量组和替莫唑胺组细胞数量明显减少,生长密度降低,细胞体积变小,出现萎缩、栅栏状坏死现象;Sub-G1期、G0/G1期细胞增加,S期、G2/M期细胞减少,细胞凋亡率升高,提示HRP阻滞C6脑胶质瘤细胞周期G0/G1期,S期和G2/M期细胞减少代表凋亡的Sub-G1期出现,凋亡细胞增加,发挥抑瘤作用。Zhamanbaeva等[12]研究发现,沙棘叶提取物具有抑制人急性髓系白血病细胞增殖作用,诱导细胞周期阻滞和凋亡。Li等[13]研究发现,沙棘提取物异鼠李素诱导结肠癌细胞周期阻滞在G2/M期,增强了细胞周期蛋白B1的蛋白表达,从而抑制肿瘤细胞增殖,促进其凋亡。本研究证实沙棘提取物HRP对脑胶质瘤细胞周期的阻滞作用。
HMGB1是一种非组蛋白染色质相关蛋白,参与DNA修复、重组、自噬、坏死和细胞凋亡等生物学过程[14]。HMGB1可以促使核酸内切酶激活,是凋亡小体的组成部分,通过转录依赖性途径和转录非依赖性途径调控细胞凋亡。HMGB1与受体RAGE、TLR4结合,激活下游信号通路,从而达到拮抗凋亡的效果[15]。Zhang等[16]研究发现,HMGB1可通过HMGB1-RAGE信号通路促进胶质瘤细胞增殖。Deng等[17]研究发现,HMGB1可与Toll样受体结合促进胶质瘤细胞的侵袭和迁移发挥促瘤作用。MGMT可以修复肿瘤细胞的DNA烷基化损伤,表现为对烷化剂类抗肿瘤药物的耐药,所以抑制肿瘤细胞的MGMT基因表达和活性可逆转其耐药性。HRP是否通过抑制肿瘤细胞的HMGB1、TLR4表达对脑胶质瘤大鼠发挥抗肿瘤作用以及是否可以抑制MGMT基因表达实现逆转其耐药性方面未见报道。本研究建立脑胶质瘤大鼠模型,经HRP干预后检测HMGB1、MGMT及TLR4的mRNA和蛋白表达水平,结果显示,HRP可以下调HMGB1、MGMT及TLR4的mRNA和蛋白表达,提示HRP可能通过抑制肿瘤细胞HMGB1、TLR4、MGMT表达,促进细胞凋亡,发挥抑瘤作用。
综上所述,HRP对脑胶质瘤大鼠具有明显抑制肿瘤生长作用,可能与抑制HMBG1、TLR4、MGMT表达,阻滞细胞周期,促进细胞凋亡,为临床治疗脑胶质瘤提供实验依据。

