野菊抗盐株系筛选与抗盐机理初探
薄 杉,夏 斌,刘铭宇,陈 斌,孙 颖,李 强,何 淼
(东北林业大学 园林学院,哈尔滨150040)
土壤盐碱化是当前全世界面临的一个非常棘手的问题[1-2]。据统计,世界盐渍土总面积约10亿hm2,中国盐渍土总面积超过3600万hm2,占中国可利用土地面积的4.88%[3]。并且,生态破坏的不断加剧使盐碱土的面积与日俱增。盐碱化严重的土壤会导致植物代谢紊乱,发生渗透胁迫、离子毒害,使得植物生长不良,甚至死亡,造景效果大打折扣[4-5],但植物中的高抗盐类群对盐碱化土壤有良好的适应性,在盐碱土上依然有着较好的观赏效果[6]。所以,改良盐碱土,促进土壤盐碱化严重地区的园林事业发展,可以通过获得高抗盐优异植物类群,并更多地了解其抗盐机理来实现。
野菊(ChrysanthemumindiumL.),属于菊科(Compositae)菊属(DendraothemasGaertn.),为一种多年生草本植物[7]。菊花是中国十大传统名花之一,观赏效果好,园林应用价值高[8]。由于野菊源自野外,对各种生境的适应性强于其他菊花品种,且野菊和其他品种的菊花拥有很近的亲缘关系[9]。所以,在发掘抗盐性强的野菊株系的基础上对野菊的抗盐性进行研究,对于改善菊花群体的抗盐性、促进菊花在盐碱地的应用与推广、丰富盐碱地植物种类具有重要意义。但目前,对野菊的研究主要集中在繁育栽培[10]以及食药用价值[11]方面,对其抗盐性的研究较少。本研究以引自辽宁省本溪市及周边区县的207个野菊株系作为试验材料进行抗盐性筛选,以获得野菊自然群体中的抗盐株系,并分析其中6个株系在盐胁迫下的表型、光合生理及渗透调节物质的变化情况,以期初步探明野菊的抗盐机理,为日后对野菊抗盐机制的更深入研究及菊花抗盐新品种的培育奠定理论基础,使北方地区盐碱地的园林绿化有着更加丰富的植物资源。
1 材料与方法
1.1 试验材料
试验于2020年9-12月在东北林业大学园林苗圃进行,抗盐株系筛选的试验材料为引自辽宁省本溪市及周边区县的207个野菊株系。
筛选试验后,从得出的高、中、低抗3大类群中分别选择2个株系[2个高抗株系:3-25-2(A),4-4-6(B),2个中抗株系:3-18-3(C)、2-13-2(D),2个低抗株系:5-11-2(E)、4-7-2(F)]作为抗盐机理研究的试验材料。
1.2 试验方法
1.2.1 试验材料的前期准备 选取野菊顶端生长良好且无病虫害的茎段进行扦插繁殖,扦插基质为珍珠岩,扦插后于温室中养殖。待扦插苗根长为1~2 cm时,选择长势一致的单株进行试验。
试验前,用蒸馏水将野菊根部清洗干净,随后对其进行适当修剪,使每个野菊单株均保留4~6片真叶。将待测野菊置于塑料箱中水培,水培液是霍格兰营养液,每2 d更换1次营养液,水培7 d后进行盐胁迫处理。
1.2.2 盐胁迫处理 抗盐株系筛选试验时,将分析纯NaCl固体溶于塑料箱中的霍格兰营养液中,使得溶液中的NaCl浓度达到且保持在150 mmol/L。每个株系设置15个重复。
抗盐机理试验设置1个盐处理组和1个对照组,处理组的盐胁迫处理方式同抗盐株系筛选试验,对照组继续用霍格兰营养液进行培养,每组设置3个重复,每个重复为15株。
1.2.3 野菊抗盐评价体系的建立与抗盐株系筛选 野菊抗盐评价体系的建立:参照刘晓静等[12]对草坪草质地评价的方法,参照尹冬梅等[13]、宋钊等[14]对植物耐涝性的评价方法,确定对野菊抗盐性的评价方式:对盐胁迫后野菊表型的变化情况进行赋分,根据赋分高低对其抗盐性的强弱进行排名,并结合管志勇等[15]对菊花近缘属植物抗盐性评价的研究方法,选择出现受害症状的时间,全株叶片枯萎的时间,盐胁迫后120 h时的茎色、叶色、叶片枯黄率5个指标对野菊株系的抗盐性进行评价。通过聚类分析法将此次引种的野菊根据抗盐性强弱进行分级。
评分方法:盐处理后,每隔24 h观察株系的表型变化,统计出现胁迫症状的单株以及叶片全部枯萎的单株,根据各个单株出现受害症状、叶片全部枯萎发生的时间进行赋分。盐胁迫处理120 h后,统计各株系每个单株的枯黄率、叶色及茎色并赋分。叶色与茎色均使用NCS比色卡进行比色,其中叶色通过比对自上而下第3片真叶的颜色确定得分。茎色通过比对茎与盐溶液接触部位附近的颜色确定得分。叶片枯黄率参照张静等[16]对竹节草(Chrysopogonaciculatus)耐盐临界浓度研究时所采用的目测打分法进行估算,最后根据枯黄率的高低进行赋分。每个指标的评分取平均值。具体评分标准如表1所示。

表1 野菊抗盐性评价指标与评分标准Table 1 Evaluation index and scoring standard of salt resistance of C.indicum
分数的汇总与分析:评分完成后,将各项指标得分的平均值四舍五入取整数,得出其最终得分。将各指标最终得分相加,获得各个株系的总分。根据总分的高低对各个株系的抗盐性进行排名,随后以总分为依据进行系统聚类分析。
1.2.4 生理指标的测定 抗盐机理探究试验进行72 h(保证所有株系均能正常取样与测量)后,进行相关生理指标的测定。
光合色素含量的测定:选取植株顶部第3~5片功能叶,采用丙酮-乙醇混合液浸提法[17]测量叶绿素a(Chl a)、叶绿素b(Chl b)、类胡萝卜素的含量,并计算叶绿素a+b(Chl T)、叶绿素a/b的值。
光合指标的测定:使用Li-6400光合仪在晴朗无风的上午9:00-11:30测量净光合速率(Pn)、蒸腾速率(Tr)、胞间CO2浓度(Ci)、气孔导度(Cond),测量时选择植株自顶部第3~5片功能叶。选用红蓝光源叶室,设置光照度800 μmol/(m2·s),温度设置为25 ℃,以大气CO2作为CO2气源。每个株系的每个处理测量3个植株,每个植株重复测定3次。计算水分利用效率(WUE =Pn/Tr)、表观叶肉导度(AMC=Pn/Ci)、气孔限制值(Ls= 1 -Ci/Ca)。
渗透调节物质含量的测定:选取植株自顶部第3~5片功能叶,采下后用锡箔纸包裹,迅速放入液氮桶中带回试验室,置于-80 ℃冰箱,待测。采用蒽酮比色法[17]测定可溶性糖含量,采用酸性茚三酮[16]法测定脯氨酸含量,采用TBA法[17]测定丙二醛含量。
1.3 数据分析
采用Excel 2013对数据进行统计与计算,采用SPSS 22.0进行数据分析,采用R studio进行系统聚类分析。
2 结果与分析
2.1 野菊抗盐性的评价与分级
对野菊出现胁迫症状时间,全株叶片枯萎时间,盐胁迫后120 h时的茎色、叶色、叶片枯黄率5个指标进行评分。基于所得总分对引种野菊的抗盐性进行系统聚类分析,结果如图1所示。通过系统聚类,在距离为10处,根据抗盐性的高低将本次引种的野菊聚为3类:高抗株系有111个,中抗株系有44个,低抗株系有52个。
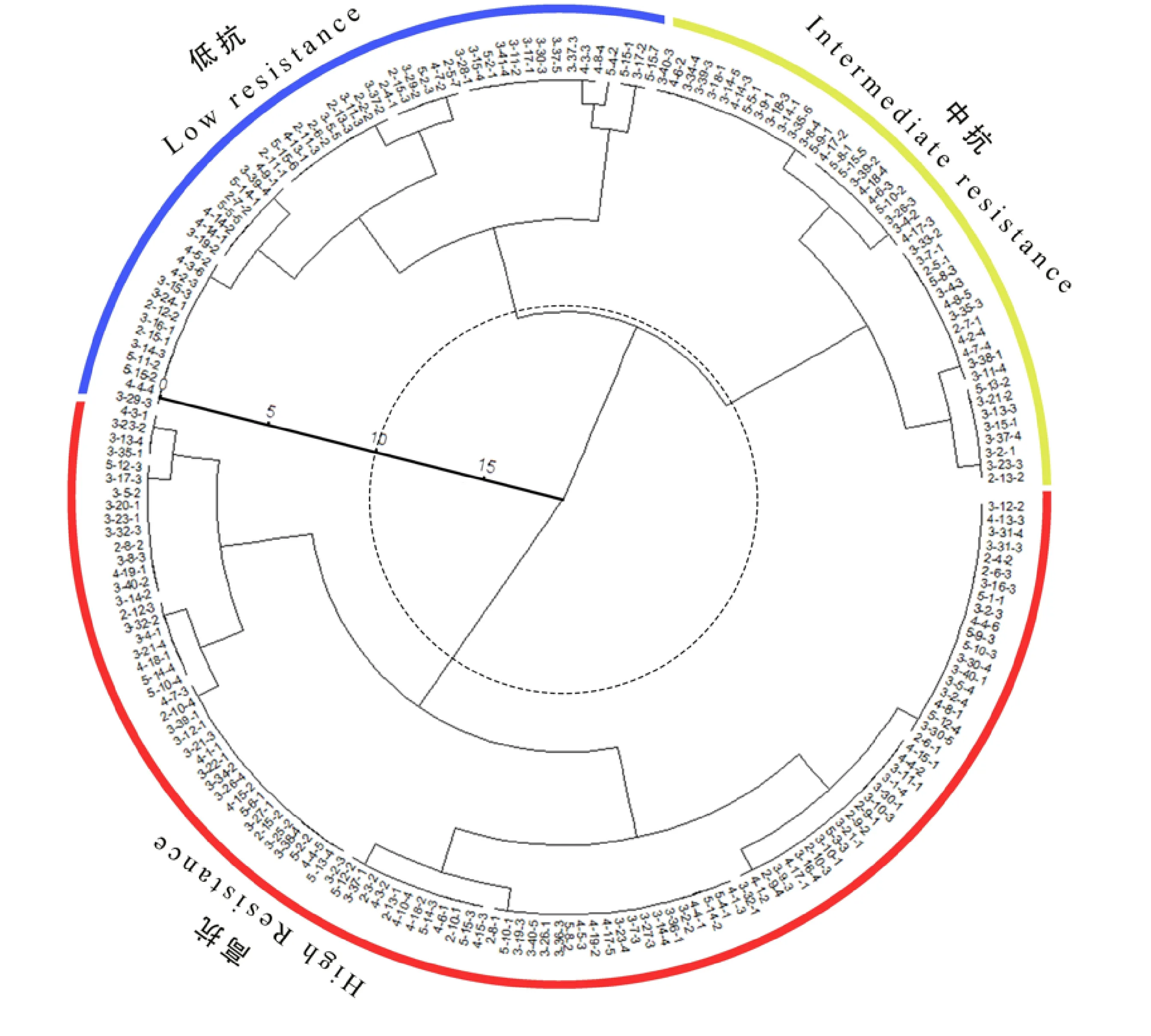
图中各数字字符代表不同的野菊株系
2.2 盐胁迫对野菊表型的影响
如图2所示,试验进行72 h后对照组与处理组的表型之间差别明显。对照组中各株系均生长良好,茎叶的颜色及形态均未发生明显变化。处理组各株系的外部形态发生一定变化,高抗株系A、B的叶片变为浅绿色,边缘发生轻微萎蔫,茎的形态及颜色未发生明显变化。中抗株系C、D的叶片变为黄绿色,且有一定程度的萎蔫、皱缩,茎色略微变浅,茎的形态无明显变化。低抗株系E、F的叶片黄化较为严重,部分叶片枯萎、脱落,茎色变为淡褐色或褐色,且出现萎蔫现象。

图2 盐胁迫下野菊表型的变化Fig.2 Changes of phenotypic in C.indicum under salt stress
2.3 盐胁迫对野菊光合色素含量的影响
如表2所示,与对照组相比,除株系A的叶绿素a含量外,处理组中各株系光合色素含量均显著下降(P<0.05),株系F的下降幅度最大。处理组中,株系D与株系F叶绿素a/b的值较对照组显著降低(P<0.05)。
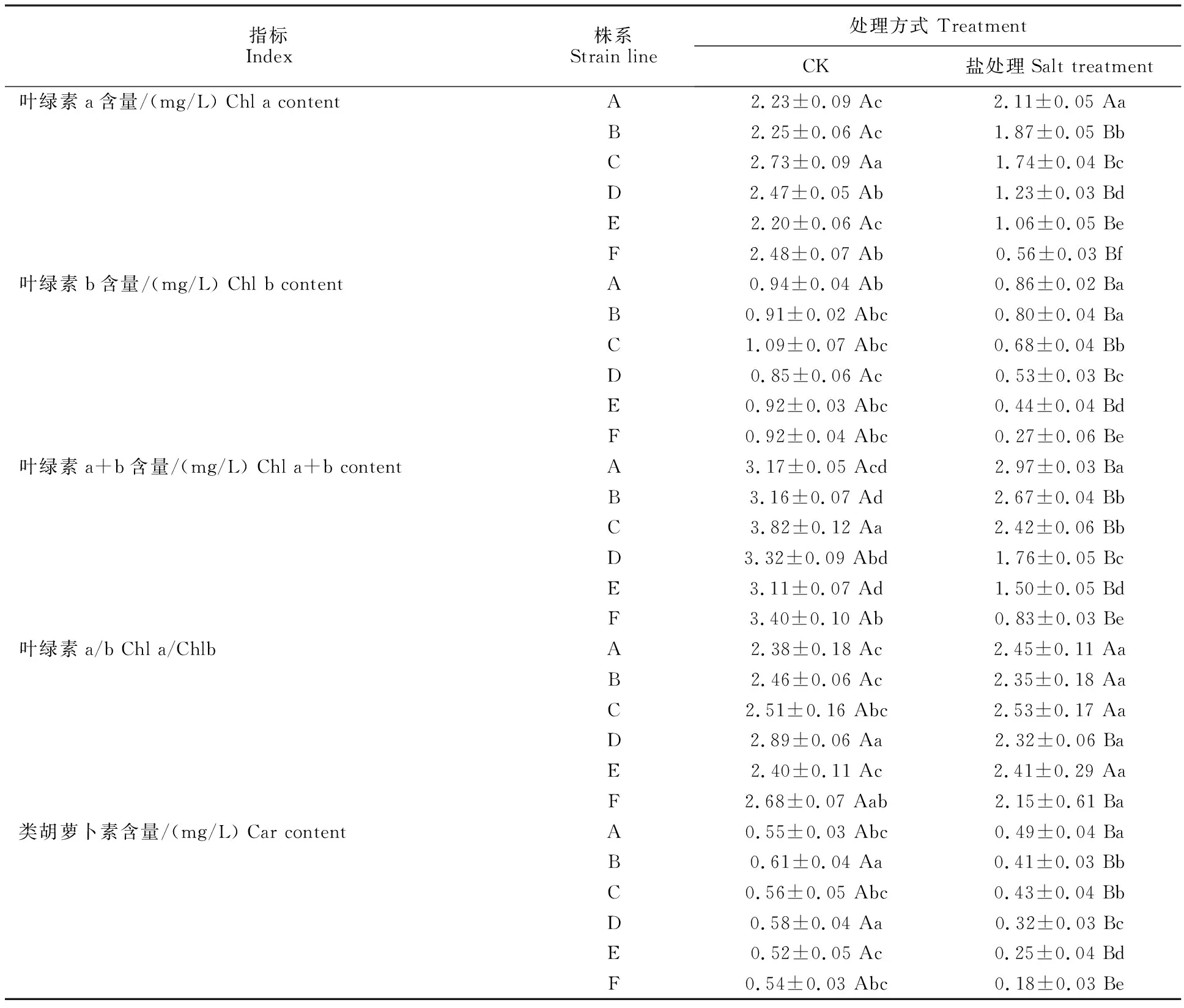
表2 盐胁迫下野菊光合色素的含量Table 2 Photosynthetic pigment content in C.indicum under salt stress
处理组中株系A到株系F的光合色素含量均为下降趋势,且大部分株系之间存在显著差异(P<0.05),叶绿素a/b的值在各株系之间均无显著性差异(P>0.05)。
2.4 盐胁迫对各株系野菊光合特性的影响
如表3所示,对照组的净光合速率、蒸腾速率均显著高于处理组(P<0.05)。除株系A、B外,对照组的水分利用效率高于处理组。除株系E、F外,对照组的胞间CO2浓度高于处理组,气孔限制值低于处理组。对照组的气孔导度、表观叶肉导度均高于处理组,株系A的气孔导度、株系B的表观叶肉导度与对照组相比差异不显著 (P>0.05)。

表3 盐胁迫下各株系野菊的光合指标Table 3 Photosynthetic indexes in C.indicum under salt stress
处理组中,除水分利用效率、表观叶肉导度外,各株系间的各项光合指标均具显著性差异 (P<0.05)。株系A到株系F的净光合速率、蒸腾速率、气孔导度、水分利用效率、均呈不断降低的趋势,胞间CO2浓度为先降低后升高的趋势,气孔限制值、表观叶肉导度为先升后降的趋势。
2.5 盐胁迫对各株系野菊渗透调节相关物质的影响
如表4所示,处理组中各株系的脯氨酸、可溶性糖含量及丙二醛含量均显著高于对照组(P<0.05)。处理组中株系A到株系F的脯氨酸、可溶性糖含量呈不断降低趋势(表4)。丙二醛含量呈不断上升趋势。处理组各株系间的脯氨酸含量均存在显著差异(P<0.05)。除株系A、B外,处理组各株系间的可溶性糖、丙二醛含量存在显著差异(P<0.05)。
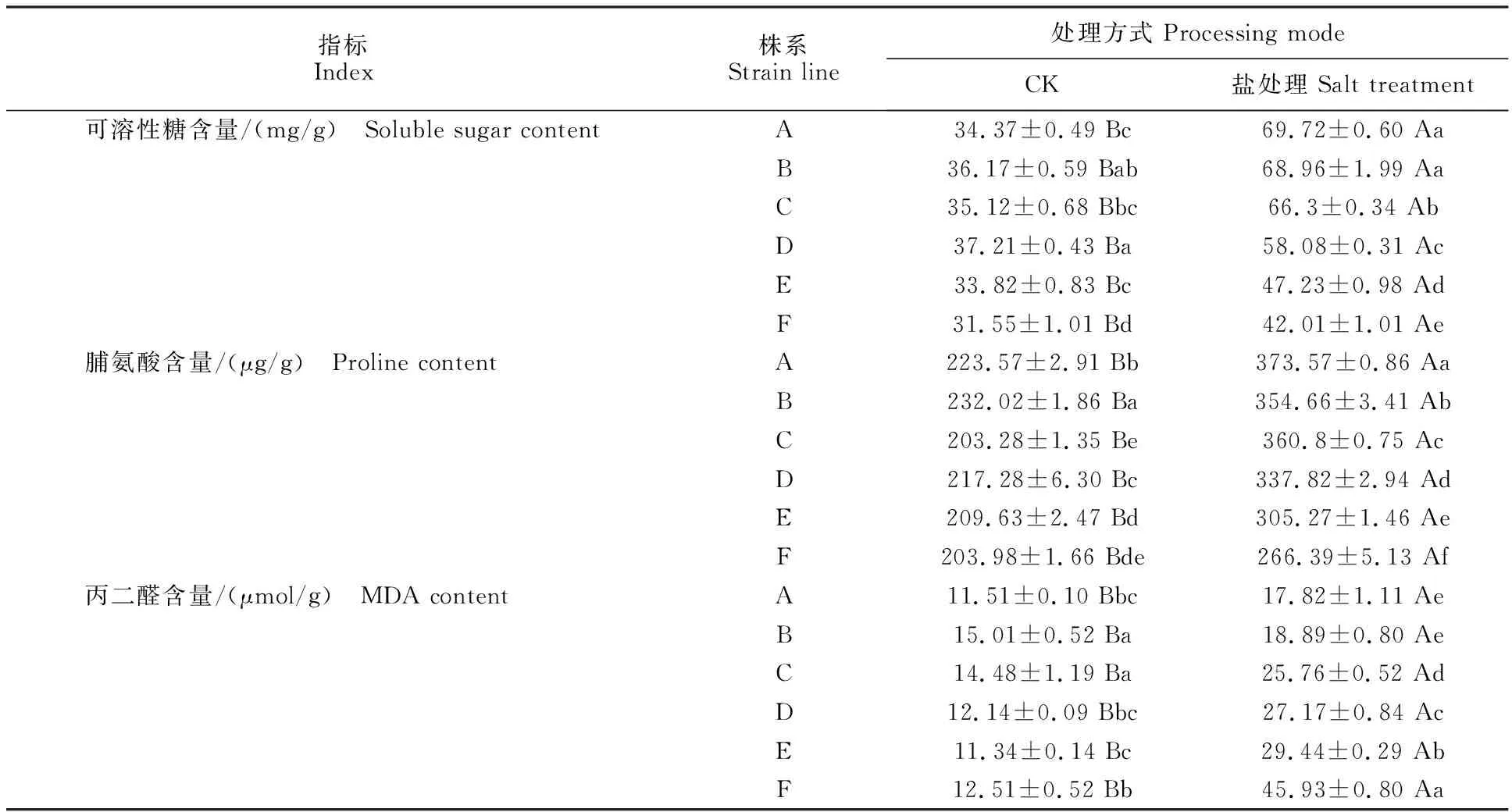
表4 盐胁迫下野菊渗透调节相关物质含量的变化Table 4 Changes of osmoregulation related substances in C.indicum under salt stress
3 讨论与结论
筛选是获得优良种质,改善植物群体整体质量的基础[18]。植物抗性的筛选主要基于形态指标与生理指标两个方面[19]。其中,表型变化是植物受到逆境胁迫最直接的反应,比如茎叶萎蔫、变色等[20]。所以,根据表型可以在短时间内对大量种质资源进行抗性筛选。聚类分析是根据客观反映研究对象之间远近关系的统计量(距离或相似性指数),对研究对象在排除人为主观因素影响的基础上进行分类[21]。通过赋分排名及系统聚类分析可知,本研究中207个引种野菊株系的抗盐性存在一定差异,有111个株系为高抗盐株系,可能是在不同的生长环境下,土壤的成分与周边的环境使得野菊在生长发育过程中产生一定的盐适应性。后期试验发现,与对照组相比,各株系在盐处理后表型均产生一定变化,抗盐性越强的株系表型变化越不显著。由此可见,抗盐性强的株系拥有较完备的盐响应机制,能够在盐胁迫下基本保持正常的外部形态,是进行抗盐性研究的重要材料。
光合色素具有吸收、传递光子的功能,是植物光合作用中至关重要的成分,其含量与比例的变化可作为评价植物受胁迫影响程度的重要指标[22]。本研究结果表明,处理组中各株系的光合色素含量较对照组有所降低,且抗盐性越强的株系降低幅度越小,这与丁丁等[23]的研究结果一致,原因可能是过多的Na+会严重影响植物对其他元素的吸收,这些元素有些是光合色素合成所必需的元素,最终使得光合色素的合成受阻[24]。盐胁迫会导致叶肉细胞受损,使得叶绿素降解酶活性升高,加速叶绿素的分解,从而导致叶绿素含量下降[25]。由于类胡萝卜素具有消耗过剩光能的作用,但盐胁迫使得野菊对光能的吸收与转运受阻,使得类胡萝卜素发挥的作用很小,所以类胡萝卜素含量的降低可能会使野菊在受到盐胁迫时不至于消耗过多的有机物[26]。叶绿素a/b的值在不同处理、不同株系之间的变化相对较小,表明盐胁迫对于叶绿素a与叶绿素b的影响大致相等,仅在胁迫较重时,盐胁迫对于叶绿素a的影响大于对叶绿素b的影响。
光合作用是植物进行物质合成与能量代谢的基础,是植物对于盐胁迫最为敏感的生理过程之一[27-28]。通过净光合速率可直接对植物光合作用的情况进行评价[29]。本研究结果表明,处理组的净光合速率显著低于对照组,抗盐性越强的株系下降幅度越小,表明盐胁迫对野菊的光合代谢过程产生一定的影响,受影响的程度与株系的抗盐性密切相关,这与王旭明等[25]的研究结果一致。
导致盐胁迫下植物光合速率下降的原因可分为气孔因素与非气孔因素。葛江丽等[30]的研究表明气孔因素与非气孔因素之间不是相互独立的,多重因素的影响会导致二者发生动态变化。气孔导度、气孔限制值、胞间CO2浓度是反应气孔情况的重要指标,其中,气孔导度与胞间CO2浓度同时下降表明植物光合速率下降主要是由气孔因素导致的[31]。本研究结果表明,除低抗株系E、F外,其他各株系的气孔导度与胞间CO2浓度均低于对照组,气孔限制值高于对照组,表明在胁迫症状不重时,气孔因素是导致野菊光合速率下降的主要因素。表观叶肉导度可反映RuBPCase活性的高低,是用于评价非气孔限制程度的指标之一[32]。本研究结果表明,处理组各株系的表观叶肉导度普遍低于对照组,抗盐性越强的株系偏低幅度越小,表明随着胁迫症状的加重,非气孔因素逐渐成为导致野菊光合作用下降的主导因素,这与荆培培等[33]的研究一致。
盐胁迫下,植物体很容易失去水分。蒸腾速率与水分利用效率是光合作用中与水分关系最为密切的两个指标,并且水分利用效率是反应植物在盐胁迫下能量转化效率的关键指标,可在一定程度上反应其抗盐性的强弱[34]。本研究结果表明,处理组中各株系的蒸腾速率普遍低于对照组,除株系A、B外,处理组中各株系的水分利用效率低于对照组,且抗盐性越强的株系不汾利用效率和蒸腾速率越高。表明盐胁迫对野菊的水分代谢机制产生一定的影响,且抗盐性强的野菊株系在盐胁迫下有着较高的能量转化效率,能基本维持水分代谢平衡。抗盐性不同的株系蒸腾速率下降的原因有所不同,对于较高抗株系而言,其增大气孔阻力来减少水分流失导致蒸腾速率略有下降,而对于低抗的株系而言,盐胁迫导致其膜系统受损严重,这种情况下,叶肉细胞的光化学活性严重偏低,从而导致CO2的利用效率明显降低,最终使光合速率与蒸腾速率与对照组或其他株系相比明显偏低[35]。
渗透调节是植物应对盐胁迫的重要生理机制之一,对于调节植物水势的平衡与保持膜系统的完整起着关键的作用[36]。有研究表明可溶性糖是非盐生植物的重要渗透调节物质,也可以作为在胁迫下储存能量的一种形式[37]。脯氨酸具有清除羟基自由基的作用,保护膜系统免受盐的毒害,同时维持正常的细胞膨压[38-39]。本研究结果表明,处理组中各株系的脯氨酸与可溶性含量均明显高于对照组,表明野菊可通过合成渗透调节物质来应对盐胁迫带来的不利影响。处理组中,自株系A到株系F,可溶性糖与脯氨酸含量的下降趋势为先缓后急,原因可能是抗盐性较强的株系在该浓度的盐胁迫下未将渗透调节作为主要的抗盐机制,渗透调节物质含量依旧存在提升空间,但随着抗盐性的不断减弱,野菊合成渗透调节物质的能力亦在减弱,加之盐胁迫对其生理代谢活动造成的影响更加不利于其渗透调节物质的合成,形成了恶性循环,导致自株系C到株系F渗透调节物质含量出现了急剧降低的趋势。株系C的脯氨酸含量显著大于株系B,说明脯氨酸是野菊在较重盐胁迫下的主要渗透调节物质,这与李硕[40]等的研究结果一致。丙二醛是膜脂过氧化的产物,其含量可用来衡量植物受胁迫影响严重程度的大小[41]。本研究表明,处理组中各株系的丙二醛含量较对照组均显著升高,且抗盐性越强株系升高幅度越小,表明盐胁迫下野菊的膜系统均遭到了不同程度的破坏,但抗盐性较强的株系的膜系统遭到破坏的程度较小,从而在一定程度上保证生理代谢活动的正常进行。
本研究以150 mmol/L NaCl水培作为胁迫方式,基于表型变化结合聚类分析对207个引种野菊株系进行抗盐性筛选,并对野菊抗盐生理机制展开研究。发现引种野菊中有111个株系对盐胁迫有较强的抗性,抗盐性较强野菊在盐胁迫下的水分代谢与合成渗透调节物质的能力较强,从而有效减缓光合色素的分解,保证光合作用不受过大的影响,最终使得表型上发生的变化较小。本研究为菊花抗盐新品种的选育与抗盐性更深层次的研究奠定了基础。

