捻转血矛线虫PCR检测方法的建立及其应用
邹 敏,要慧中,杨冰可,周璐露,赵光明,杨文欢,吴 昌,林 青,4
(1. 西北农林科技大学 动物医学院,陕西杨凌 712100;2. 陕西省动物疫病预防控制中心,西安 710299;3. 商南县农业综合执法大队,陕西商南 726300;4. 家畜疫病病原生物学国家重点实验室,中国农业科学院 兰州兽医研究所,兰州 730046)
捻转血矛线虫(Haemonchuscontortus)是一种世界范围内的反刍动物胃肠道高致病性吸血线虫,特别是在热带、亚热带和温带等温暖潮湿的地区,其危害程度更为严重[1-2]。主要寄生于山羊、绵羊等家养和野生反刍动物的皱胃和小肠[3],可导致宿主出现消瘦、贫血、下颚水肿、生理机能紊乱等慢性消耗性症状,甚至引起幼年动物急性死亡[4-7],给世界范围内的山羊、绵羊等反刍动物养殖业带来重大的经济损失[2,7]。捻转血矛线虫病除了通过特征性的临床病变以及尸检时在胃肠道中发现大量的捻转血矛线虫虫体来确诊外[1],还可通过从粪便中检测出的捻转血矛线虫虫卵来确诊。传统的粪检方法主要是显微镜检查,临床上通常是应用麦克马斯特氏法(McMaster’s method)来计算每克粪便中的虫卵数(EPG),对线虫感染进行定性和定量测定[8]。传统镜检方法通过形态准确鉴定线虫卵的种类有一定难度,往往判定结果存在一定的主观性,且在实际检测时也常有漏诊情况出现。
在过去的几十年里,为了提高肠道蠕虫病诊断的敏感性和特异性,分子诊断方法得到不断发展和完善。目前,随着线虫基因组学研究的不断深入,加之蛋白质组学和代谢组学的技术不断发展[9],使得特异性生物标记物用来进行物种鉴别成为可能[10]。近年来,由于PCR技术快速、高效、便捷和特异性强等特点,同时又可以弥补传统方法的一些缺陷,因此,基于PCR的一系列病原检测技术已经在动物胃肠道线虫的研究中得到广泛应用[8,11-12]。本研究将基于捻转血矛线虫ITS2-28S基因序列,建立针对捻转血矛线虫卵的一种快速PCR分子检测技术,为羊捻转血矛线虫病的诊断与防治提供有效方法,并为该病的监测预报提供技术支持。
1 材料与方法
1.1 材 料
1.1.1 虫卵样品 将采集于羊皱胃的捻转血矛线虫雌虫在室温下培养8~12 h以获得成熟的虫卵,同时将雌虫虫体置于体视显微镜下解剖其子宫,将子宫内尚未成熟的虫卵挤出。所收集的虫卵保存于生理盐水内。细颈线虫、粗纹食道口线虫、似血矛线虫、夏伯特线虫、兰氏毛尾线虫、绵羊毛尾线虫、尖尾线虫、网尾线虫、蛇形毛圆线虫等虫卵的DNA阳性样品由西北农林科技大学寄生虫实验室提取并保存。
1.1.2 粪便样品 120只奶山羊新鲜粪便样品分别采自陕西省蓝田县(85只)、千阳县(20只)、富平县(15只)3 个某规模化奶山羊场。
1.1.3 主要试剂 普通琼脂糖凝胶DNA回收试剂盒(DP209)和高纯度质粒小提中量试剂盒(DP107)均购自天根生化科技(北京)有限公司;OMEGA粪便基因组DNA提取试剂盒(D4015)、大肠埃希杆菌JM109感受态细胞(G6014-20)、氨苄青霉素贮存液(A1170)、LB固体培养基干粉(L1015)、LB液体培养基干粉(L1010)等均购自北京索莱宝生物科技有限公司;TaKaRa ExTaq○R(RR001A)、T-vector pMD 19(Simple)载体(3271)、DNA标准DL 2000(3427A)均购自宝日医生物技术(北京)有限公司。
1.2 方 法
1.2.1 捻转血矛线虫卵DNA的提取 按照 OMEGA粪便基因组DNA提取试剂盒说明书提取虫卵的基因组DNA,并置于-20 ℃保存,备用。
1.2.2 捻转血矛线虫PCR检测方法的建立引物设计 参考GenBank中的捻转血矛线虫序列(登录号为KX829170.1),基于捻转血矛线虫ITS2-28S基因序列片段,利用ClustalX 1.83生物软件筛选出捻转血矛线虫种内保守且种间高变的碱基序列,利用NCBI内的Primer-blast和oligo 7生物学软件,设计捻转血矛线虫的上、下游特异性引物,引物相关的具体信息如表1所示。
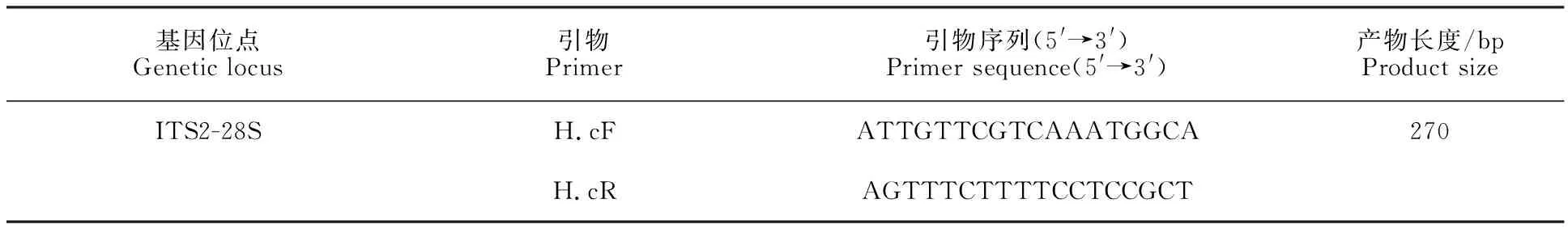
表1 捻转血矛线虫PCR引物Table 1 PCR primers for H.contortus
捻转血矛线虫PCR反应体系的建立和条件优化 PCR反应总体系设定为25 μL:10× ExTaqBuffer 2.5 μL,dNTP Mixture 2 μL,上下游引物(10 μmol/L)各1 μL,ExTaqDNA聚合酶 0.125 μL,模板DNA 1 μL,ddH2O 17.375 μL。反应条件为:94 ℃ 5 min;94 ℃ 30 s,53 ℃ 30 s,72 ℃ 30 s,35个循环;72 ℃ 5 min。
退火温度优化:根据Oligo 7推荐的最佳退火温度54.6 ℃,将温度梯度设置为60 ℃、59 ℃、58 ℃、57 ℃、56 ℃、55 ℃、54 ℃、53 ℃、52 ℃、 51 ℃、50 ℃。
特异性试验 利用建立的PCR方法对细颈线虫、似血矛线虫、夏伯特线虫、兰氏毛尾线虫、绵羊毛尾线虫、尖尾线虫、网尾线虫、蛇形毛圆线虫、粗纹食道口线虫等虫卵的DNA进行扩增,设置捻转血矛线虫卵DNA为阳性对照,ddH2O为阴性对照。扩增后将PCR产物经10 g/L琼脂糖凝胶电泳,观察结果,为进一步确定扩增结果的准确性,将阳性PCR原液送测序验证。
敏感性试验 阳性标准品的制备:使用普通琼脂糖凝胶DNA回收试剂盒(DP209),对捻转血矛线虫卵PCR扩增产物进行纯化与回收。将胶回收产物利用T-Vector pMD 19载体系统连接到pMD-19T SimpleⅠ载体上。将连接产物转化到感受态细胞,在LB固体培养基上过夜培养14~16 h后,观察菌落。挑取培养基上的单个菌落于含有1.5 μL氨苄青霉素和1 mL LB液体培养基的离心管内,放置在37 ℃摇床中,于220 r/min培养12 h。
利用建立的PCR方法及电泳检测对菌落进行鉴定后,将菌液PCR扩增产物送测序。对经测序结果正确的阳性质粒参考高纯度质粒小提中量试剂盒(DP107)说明书进行DNA提取。经分光光度计测定核酸浓度后,按5倍比稀释为9个浓度梯度分别作为模板,使用建立的PCR反应体系和反应程序进行扩增,每个梯度重复3次,以确保试验的可重复性。
1.3 临床样品检测
1.3.1 光学显微镜检查 采用饱和食盐水漂浮法进行粪便中虫卵的形态学检查,于400倍的光学显微镜下观察虫卵的大小、颜色、卵壳厚度、形状及卵内容物等形态特征,对捻转血矛线虫卵进行鉴定并记录结果。
1.3.2 粪便样品PCR检测 按照OMEGA粪便基因组DNA提取试剂盒说明书提取粪便样品DNA并进行PCR扩增,对扩增产物进行凝胶电泳检测,之后将所有阳性PCR产物送测,以确定目的基因片段的准确性。
1.3.3 两种检测方法结果比较 使用SPSS 24.0软件对两种检测方法的结果进行一致性检验(Kappa vaule)和配对卡方检验(McNemar Test),分析计算结果。当Kappa值≥0.75,二者检测结果一致性较好;当0.4≤Kappa值<0.75,二者检测结果一致性一般;当Kappa值<0.4,二者检测结果一致性较差。P<0.05为差异具有统计学意义。
2 结果与分析
2.1 PCR反应退火温度优化
通过对PCR反应条件中的退火温度进行优化,结果显示,以53 ℃为退火温度时,电泳检测出的目的条带最亮且无杂带出现(图1),即53 ℃为该PCR反应的最佳退火温度。

M.DNA 标准 DL 2000;1. 空白对照;2~12. 退火温度分别为60 ℃、59 ℃、58 ℃、57 ℃、56 ℃、55 ℃、54 ℃、53 ℃、52 ℃、 51 ℃、50 ℃
2.2 PCR特异性试验
电泳检测结果显示,仅以捻转血矛线虫卵DNA为模板的样品出现一条270 bp的特异性条带,其余线虫卵DNA样品电泳结果均为阴性(图2)。将测序结果在NCBI上进行Blast比对,结果显示,测序结果与GenBank中捻转血矛线虫基因参考序列(登录号为KF176320.1)的相似度达到100%,与GenBank中多个捻转血矛线虫基因参考序列同源性均达99%以上。
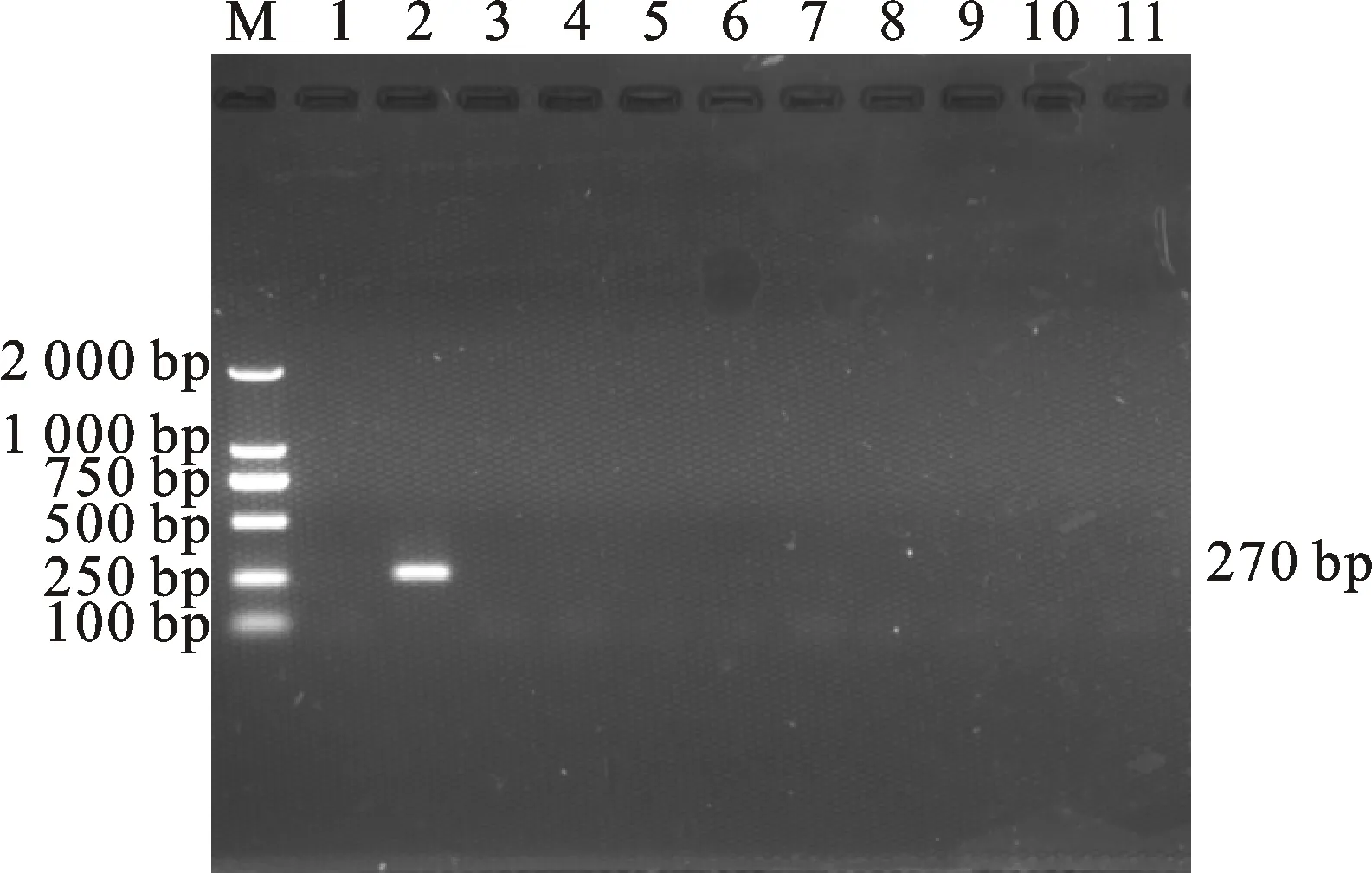
M. DNA 标准 DL 2000;1. 空白对照;2~11. DNA模板依次为捻转血矛线虫卵、细颈线虫卵、似血矛线虫卵、兰氏毛尾线虫卵、尖尾线虫卵、网尾线虫卵、夏伯特线虫卵、蛇形毛圆线虫卵、毛尾线虫卵、粗纹食道口线虫卵
2.3 PCR敏感性试验
将DNA质量浓度为116.529 ng/μL的阳性质粒标准品,按5倍比例逐级稀释至0.06 pg/μL后,以10个稀释浓度梯度为DNA模板进行PCR扩增。结果显示,该PCR方法能检测到的DNA质量浓度最低为0.298 pg/μL(图3)。

M. DNA 标准 DL 2000; 1~11. 捻转血矛线虫卵DNA质量浓度为116.529 ng/μL 、23.309 ng/μL、4.661 ng/μL、0.932 ng/μL、0.186 ng/μL、0.583 ng/μL、0.037 ng/μL、0.007 ng/μL、1.492 pg/μL、0.298 pg/μL、0.060 pg/μL;12. 空白对照
2.4 临床样品检测
2.4.1 粪便样品显微镜检结果 120只奶山羊粪便样品中共检出捻转血矛线虫阳性29只(其中蓝田县、千阳县和富平县3 个某奶山羊场的阳性数分别为23、4和2),阳性检出率为24.2%。
2.4.2 粪便样品PCR检测结果 120只奶山羊粪便DNA样品中共检出46只阳性样品(其中蓝田县、千阳县和富平3 个某奶山羊场的阳性数分别为38、5和3),阳性检出率为38.3%。将46只奶山羊阳性粪便样品的PCR产物测序后进行同源性检索,结果显示,与数据库内收录的捻转血矛线虫ITS2-28S 基因序列(MK300723.1)的相似度均为100%,由此判定,这46只奶山羊的粪便样品为捻转血矛线虫感染阳性。
2.4.3 两种检测方法的结果比较 120只奶山羊粪便样品经光学显微镜检查检出29只捻转血矛线虫阳性(其中2只经PCR检测为阴性),而经PCR方法检出46只阳性。经Kappa一致性检验显示,两种方法检测结果之间存在一致性且一致性一般(Kappa=0.602,P<0.01);经配对卡方检验显示,两种方法检测捻转血矛线虫卵阳性差异极显著(P<0.01)。
3 讨 论
PCR方法因其快速、高效、敏感和便捷等优点,在寄生虫病原检测及物种鉴定中发挥了重要的作用。核糖体DNA(rDNA)在真核生物中大量存在,且ITS2 rDNA序列因其具有低的种内变异性和高种间变异性,已经成为鉴定胃肠道线虫的可靠遗传工具[13-14],在线虫新物种发现、种间鉴定和种群关系等方面具有重要意义。此外,28S 基因序列在物种内都非常保守,因此,可作为反向引物的合适设计位点[15]。本研究利用捻转血矛线虫ITS2-28S rDNA序列筛选设计了一对特异性引物,并通过优化PCR反应条件,建立了一种用于捻转血矛线虫的PCR检测方法,该方法可以特异性地检出捻转血矛线虫卵。
捻转血矛线虫感染羊,并在皱胃发育成熟后通过粪便向外排出虫卵,甚至会排出死亡的虫体或虫体碎片,通过分子生物学方法检测粪便当中的病原可以大大提高羊捻转血矛线虫病的检出率。本研究选择捻转血矛线虫ITS2-28S的基因片段为靶基因建立PCR检测方法,在50 ℃~ 60 ℃的温度梯度中均能成功扩增出270 bp的特异性单一条带,且在退火温度为53 ℃时电泳条带最亮。选取羊易感的其他几种胃肠道线虫卵作为对照,结果显示,仅捻转血矛线虫卵基因组DNA为阳性,其余线虫卵DNA全部为阴性,表明所建立的PCR检测方法特异性良好,可以有效避免受到其他常见病原的干扰。在最佳PCR反应条件下,通过对原始浓度的质粒DNA进行5倍比例稀释分别作为DNA模板进行PCR扩增,最低可检测到的DNA量为0.298 pg,说明该检测方法具有较高的敏感性。此外,本研究建立的方法与Bott等[16]利用ITS2基因建立的Real-Time PCR方法检测捻转血矛线虫的敏感性相当(0.1 pg),但由于Real-time PCR需要成本更高的设备与试剂,对检测人员的专业素养要求也更高,因此,目前只适用于试验研究,而在临床诊断应用上受限。本研究建立的PCR方法与之相比,特异性和灵敏度相当,但成本更低。
本研究利用PCR方法对奶山羊的120只粪便样品进行临床检测,同时与显微镜镜检结果进行对比发现,镜检和PCR方法检测结果一致性一般(Kappa=0.602,P<0.01);PCR方法检测粪便中阳性率为38.3%,明显高于显微镜镜检结果的24.2%,且差异极显著(P<0.01)。值得注意的是,本次有2只羊粪便样品经镜检判定为捻转血矛线虫阳性,但经PCR检测结果却呈阴性,分析其原因,可能是检验人员在显微镜检查时,误将其他线虫的虫卵判定为捻转血矛线虫虫卵,这也是在显微镜镜检时容易出现的失误。综上结果表明,本研究建立的捻转血矛线虫PCR鉴定方法具有较高的特异性和敏感度,并且在通过直接检测粪便中捻转血矛线虫虫卵来确定羊只感染情况时,较显微镜检查更为准确,且不需要镜检后的粪便幼虫培养进行进一步确诊,更加省时省力,具有一定的临床应用价值,为羊捻转血矛线虫病的临床诊断提供了又一种可靠的技术选择。

