病毒性脑炎患儿血清高迁移率族蛋白-1与神经损伤和炎症反应的相关性研究*
许诣,秦建品,钱丹,沈文婷
[襄阳市中心医院(湖北文理学院附属医院)儿科,湖北 襄阳 441021]
病毒性脑炎是由柯萨奇病毒、EB 病毒、乙型脑炎病毒等引起的中枢系统感染性疾病,多发于儿童,临床主要表现为头痛、发热、抽搐等,具有病死率高、预后差的特点[1]。临床根据患儿神经系统损伤程度采取针对性治疗,多采用影像学检查评估患儿神经损伤情况,具有一定的主观性[2]。有研究发现,病毒性脑炎患儿受病毒侵袭,脑实质广泛性损伤,表现为神经细胞坏死及炎症细胞浸润,临床可通过检测脑脊液神经损伤指标和炎症因子评估患儿病情[3-4]。然而获取患儿脑脊液标本需要进行穿刺,具有一定的创伤性[5]。有研究报道,神经系统疾病患者血液中的炎性介质与神经损伤程度、机体炎症反应有关,可通过血液炎症因子反映患者神经损伤及炎症情况[6]。高迁移率族蛋白-1(high mobility group box-1,HMGB1)是一种重要的炎性介质,存在于真核细胞中,能够被免疫活性细胞和坏死细胞激活并释放到细胞外,参与炎症疾病的发生、发展,加剧机体炎症反应[7]。然而病毒性脑炎患儿血清HMGB1 水平与神经损伤和炎症反应的关系尚不清楚。鉴于此,本研究选取襄阳市中心医院收治的94 例病毒性脑炎患儿,探究血清HMGB1 水平与神经损伤、炎症反应的相关性。
1 资料与方法
1.1 一般资料
选取2019 年10 月—2021 年10 月襄阳市中心医院收治的94 例病毒性脑炎患儿作为研究组。其中男性52 例,女性42 例;年龄1~13 岁,平均(5.81±0.95)岁。另取同期本院健康体检儿童86 例作为对照组。其中男性48 例,女性38 例;年龄1~12 岁,平均(5.69±0.87)岁。纳入标准:①符合《诸福棠实用儿科学(上册)》[8]病毒性脑炎诊断标准;②首次发病。排除标准:①颅脑手术史;②心肝肾功能障碍;③血液性系统疾病;④合并其他中枢神经感染;⑤合并脑脊髓炎;⑥合并其他系统或全身感染性疾病;⑦自身免疫性疾病。两组一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究经医院医学伦理委员会批准(No:襄医190017),患者家属均签署知情同意书。
1.2 方法
根据研究组神经损伤程度细分为轻度组37 例,中度组31 例,重度组26 例。神经损伤程度采用改良Rankin 评分量表评定,1~2 分为轻度,3~4 分为中度,5 分为重度[9]。
入院后清晨空腹采集患者静脉血3 mL,3 500 r/min 离心15 min,离心半径10 cm,采用酶联免疫吸附试验测定血清HMGB1、白细胞介素1β(Interleukin-1β,IL-1β)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)水平,采用放射免疫法测定血清神经元特异性烯醇化酶(neuron-specific enolase,NSE)、髓鞘碱性蛋白(myelin basic protein,MBP)水平,试剂盒均购自上海博亚生物技术有限公司。
1.3 统计学方法
数据分析采用SPSS 22.0 统计软件。计量资料以均数±标准差()表示,比较用t检验或方差分析,进一步两两比较用SNK-q检验;计数资料以构成比表示,比较用χ2检验;相关性分析用Pearson 法;绘制受试者工作特征(receiver operating characteristic,ROC)曲线。P<0.05 为差异有统计学意义。
2 结果
2.1 两组血清HMGB1、NSE、MBP、IL-1β、TNF-α水平比较
研究组与对照组血清HMGB1、NSE、MBP、IL-1β、TNF-α 水平比较,经t检验,差异有统计学意义(P<0.05),研究组高于对照组。见表1。
表1 研究组与对照组血清HMGB1、NSE、MBP、IL-1β、TNF-α水平比较()
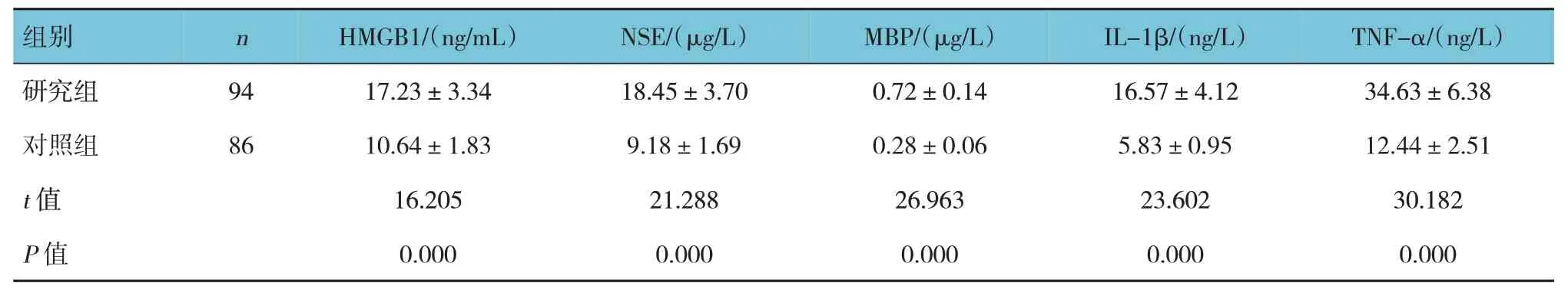
表1 研究组与对照组血清HMGB1、NSE、MBP、IL-1β、TNF-α水平比较()
2.2 不同严重程度患儿血清HMGB1、NSE、MBP、IL-1β、TNF-α水平比较
不同严重程度患儿血清HMGB1、NSE、MBP、IL-1β、TNF-α 水平比较,经单因素方差分析,差异有统计学意义(P<0.05),重度组高于中度组和轻度组(P<0.05),中度组高于轻度组(P<0.05)。见表2。
表2 不同严重程度患儿血清HMGB1、NSE、MBP、IL-1β、TNF-α水平比较()
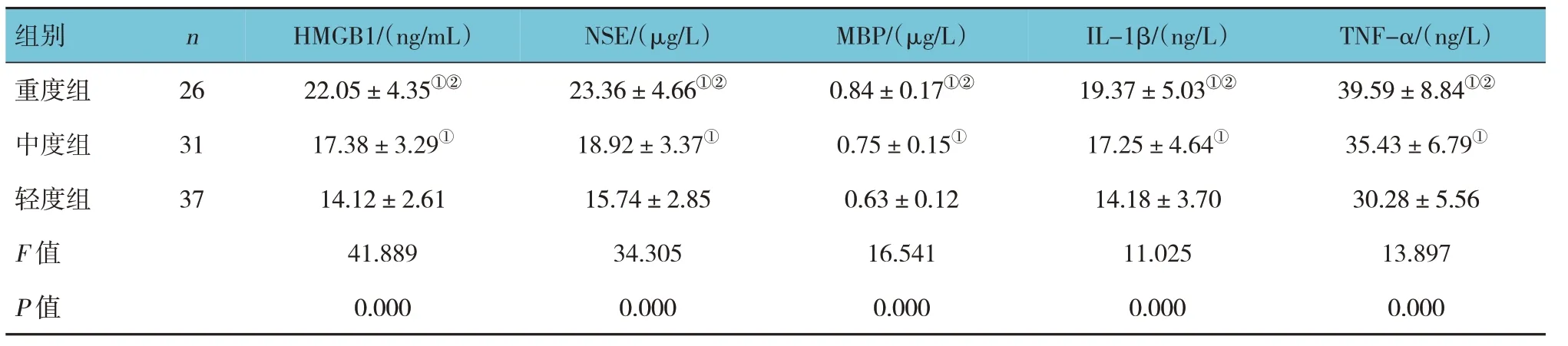
表2 不同严重程度患儿血清HMGB1、NSE、MBP、IL-1β、TNF-α水平比较()
注:①与轻度组比较,P <0.05;②与中度组比较,P<0.05。
2.3 病毒性脑炎患儿血清HMGB1 水平与NSE、MBP、IL-1β、TNF-α水平的相关性
Pearson 相关性分析结果显示,病毒性脑炎患儿血清HMGB1 水平与NSE、MBP、IL-1β、TNF-α 水平呈正相关(r=0.445、0.391、0.354 和0.386,P=0.000、0.000、0.002 和0.000)。
2.4 病毒性脑炎患儿血清HMGB1 水平对重度神经损伤的诊断效能
ROC 曲线分析结果显示,病毒性脑炎患儿血清HMGB1 水平评估重度神经损伤的最佳截断点为20.28 ng/mL,敏感性为88.46%(95% CI:0.698,0.976),特异性为94.12%(95% CI:0.856,0.984),AUC 为0.948(95% CI:0.882,0.983)。见图1。
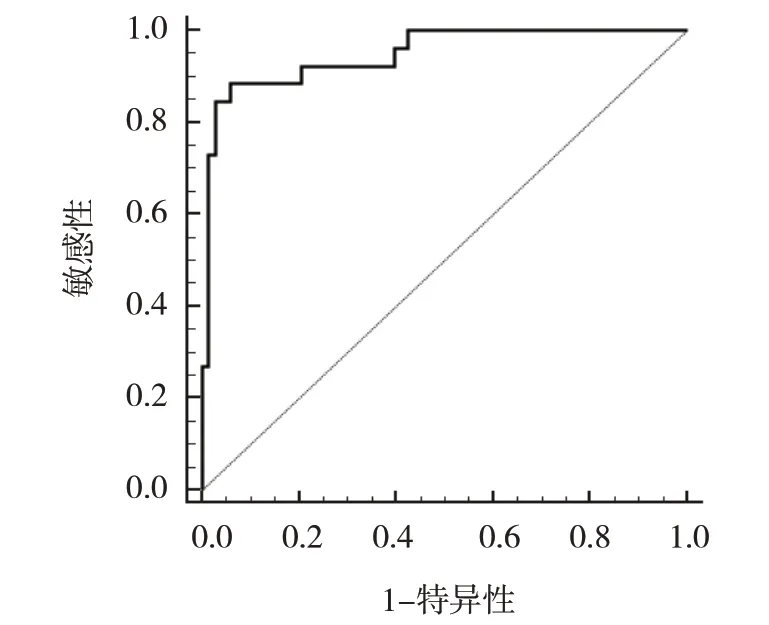
图1 病毒性脑炎患儿血清HMGB1水平评估重度神经损伤的ROC曲线
3 讨论
病毒性脑炎是由各种病毒感染引起的炎症性脑病,病毒感染后可诱发免疫性脑损伤,病变影响大脑实质,进而破坏血脑屏障[10-11]。临床研究表明,神经系统损伤可导致神经元细胞发生炎症、坏死,多种炎症因子和酶释放进入血液,引发一系列病理改变[12-13]。病毒性脑炎患儿机体病毒与神经胶质细胞相互作用,诱导产生大量IL-1β、TNF-α 等炎症因子,使脑组织发生炎症改变[14]。此外,NSE、MBP 等神经损伤指标释放进入脑脊液和血液,可作为反映神经元受损的生化指标[15]。有研究指出,血清HMGB1 水平与神经系统损伤患者神经损伤指标及炎症因子水平有关,在神经系统损伤及炎症反应中发挥重要作用[16]。
HMGB1 作为炎性介质,通过与晚期糖基化终产物受体、Toll 样受体等细胞表面受体结合促进炎症因子产生,破坏血脑屏障,促进神经细胞坏死和凋亡[17]。HMGB1 具有广泛的生物活性,维持核小体结构,调节基因转录、参与DNA 重组等功能,脑组织炎症损伤后,HMGB1 可以快速转位到细胞质并释放,直接作用于神经元表面受体和胶质细胞表面受体,促进炎症因子释放[18]。动物实验研究发现,抑制HMGB1 活性或阻断相关炎症反应通路,可以减轻脑组织的炎症损伤[19]。NSE 存在于神经元、神经细胞及神经纤维中,能够与神经元特异结合,脑损伤时从胞浆中释放进入脑脊液;MBP 是中枢神经髓鞘膜中重要成分,具有神经组织特异性[20]。本研究中研究组血清HMGB1、NSE、MBP、IL-1β、TNF-α 水平高于对照组,说明病毒性脑炎患儿神经损伤及炎症反应导致血清HMGB1、NSE、MBP、IL-1β、TNF-α 水平异常升高。分析其原因为病毒侵袭直接导致病毒性脑炎患儿脑组织受损,由于患儿自身免疫功能较差,进而引起神经细胞炎症反应,多种炎症因子透过血脑屏障进入血液,神经系统组成物质NSE、MBP参与脑损伤病理过程,随着血脑屏障受损释放进入血液。HMGB1 通过多种通路参与机体炎症反应,与脑水肿、帕金森、癫痫等多种神经系统疾病的发生、发展密切相关[21-23]。HMGB1 在中枢神经系统中可以与其受体结合,进而调节炎症反应和血脑屏障通透性,将HMGB1 注入小鼠脑组织后,能够损伤脑血管内皮细胞,破坏血脑屏障,促进IL-1β、TNF-α 等炎症因子释放,加重脑神经系统损伤[24]。病毒性脑炎患儿神经元损伤、坏死,早期HMGB1 由神经元释放加剧脑损伤,随着病情进展,由星形胶质细胞释放诱导细胞毒性反应[25]。本研究中重度组血清HMGB1 高于中度组和轻度组,中度组血清HMGB1高于轻度组,说明病毒性脑炎患儿血清HMGB1 水平随着病情进展,其水平逐渐升高。Pearson 相关性分析结果显示,病毒性脑炎患儿血清HMGB1 水平与NSE、MBP、IL-1β、TNF-α 水平呈正相关,说明病毒性脑炎患儿血清HMGB1 水平与神经损伤和炎症反应密切相关。HMGB1 作为促炎因子,能够主动分泌或被动释放,通过与多种内源性分子结合,诱导炎症反应,随着炎症反应加剧,诱发神经元细胞凋亡,加剧中枢神经系统损伤[26]。HMGB1 能够维持并放大炎症反应,细胞因子、内毒素等感染因素,以及创伤、缺血等非感染因素均可促进HMGB1 释放,而HMGB1 进一步诱导多种促炎介质的表达和释放,进而活化蛋白激酶信号通路和核转录因子κB 的核移位[27]。ROC 曲线分析结果显示,病毒性脑炎患儿血清HMGB1 水平评估重度神经损伤的最佳截断点为20.28 ng/mL,AUC 为0.948,临床可通过动态监测病毒性脑炎患儿血清HMGB1 水平变化,了解神经损伤程度,对指导临床治疗具有重要参考价值。此外,血清学指标检测方便、快捷,可重复性强,且对患儿创伤较小[28]。
综上所述,病毒性脑炎患儿血清HMGB1 水平与神经损伤和炎症反应密切相关,血清HMGB1 水平可作为评估患儿神经损伤的敏感指标。然而,本研究纳入患儿有限,统计结果可能存在一定偏差,仍需扩大样本验证研究结果。

