ApoB/ApoA1、25-(OH)D预测原发性胆汁性肝硬化病情的临床意义*
刘欣,延威,赵雨
(河南大学淮河医院 消化内科,河南 开封 475000)
原发性胆汁性肝硬化(primary biliary cirrhosis,PBC)是由于长期肝内胆汁滞留引起的,该病多发于女性,早期症状为轻度疲乏、间歇性瘙痒等[1-2]。据相关研究报道,终末期PBC 患者多表现为肝性脑病、腹水、肝衰竭等,需通过肝移植治疗[3]。早期准确评估PBC 患者病情,对患者的临床治疗及预后改善具有重要意义。但目前临床中尚缺乏对PBC 患者病情进行评估的理想生物学指标,亟须进行寻找。
载脂蛋白B(Apolipoprotein B,ApoB)、载脂蛋白A1(Apolipoprotein A1,ApoA1)主要由肝脏、小肠合成,当机体发生肝硬化,肝细胞出现肿胀、变性及坏死,ApoB、ApoA1 合成能力降低,进而致使ApoB/ApoA1 值异常偏高[4]。维生素D 为一种脂溶性类固醇激素前体,在人体中主要以25-羟基维生素D[25-hydroxyvitamin D,25-(OH)D]形式存在;其半衰期长、稳定性高,可反映机体中维生素D 的水平[5]。ApoB/ApoA1、25-(OH)D 在PBC 的发病过程中发挥重要作用,但既往报道未显示ApoB/ApoA1、25-(OH)D 与PBC 患者病情严重程度的相关性。故本研究以河南大学淮河医院收治的PBC 门诊和住院患者作为研究对象,探讨ApoB/ApoA1、25-(OH)D 在PBC 患者中的临床意义。
1 资料与方法
1.1 临床资料
选取2017 年6 月—2021 年10 月河南大学淮河医院收治的145 例患者作为PBC 组,另选取同期在本院体检的100 例健康者作为对照组。PBC 组中男性38 例,女性107 例;年龄23~72 岁,平均(56.02±8.65)岁。对照组中男性19 例、女性81 例,年龄21~73 岁,平均(54.68±10.32)岁。纳入标准:①PBC 组符合《原发性胆汁性肝硬化(又名原发性胆汁性胆管炎)诊断和治疗共识(2015)》[6]诊断标准;②年龄>18 岁。排除标准:①合并病毒性、药物性或酒精性肝病或肝内占位性病变;②合并肝脏恶性肿瘤;③自身免疫性疾病;④近3 个月服用免疫抑制剂、皮质醇类固醇激素或维生素D。依据Child-Pugh 肝功能分级标准[7],将PBC 患者分为重度病情组(C 级,43 例)和轻中度病情组(A、B 级,102 例)。本研究经医学伦理委员会批准,研究对象签署知情同意书。
1.2 ApoB/ApoA1、25-(OH)D检测
所有研究对象入院24 h 内采集静脉血5 mL,以3 200 r/min 离心8 min,离心半径10 cm,分离血清;采用全自动生化分析仪(c701 型,上海罗氏公司)测定ApoB、ApoA1 水平;并计算ApoB/ApoA1;采用酶联免疫吸附试验[8]测定25-(OH)D 水平(试剂盒购于上海酶联生物有限公司)。
1.3 临床资料收集
收集PBC 患者临床资料,包括性别、年龄、体质量指数(body mass index,BMI)、是否合并基础疾病(高血压、糖尿病及高脂血症)、吸烟史、饮酒史、总胆红素、谷氨酰转肽酶(glutamyl transpeptidase,GGT)、碱性磷酸酶(alkaline phosphatase,ALP)、谷氨酸转氨酶(glutamate aminotransferase,ALT)、天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)、透明质酸(hyaluronic acid,HA)、层黏蛋白(Laminin,LN)、Ⅲ型前胶原(type Ⅲ procollagen,PCⅢ),血样采集同1.2,HA、LN 及PCⅢ均采用化学发光法测定,试剂盒均购于上海信裕生物科技有限公司。
1.4 统计学方法
数据分析采用SPSS 21.0 统计软件。计量资料以均数±标准差()表示,比较用t检验;计数资料以构成比或率(%)表示,比较用χ2检验;绘制受试者工作特征(receiver operating characteristic,ROC)曲线;影响因素的分析采用逐步多因素Logistic 回归模型;P<0.05 为差异有统计学意义。
2 结果
2.1 两组临床资料和ApoB/ApoA1、25-(OH)D比较
两组性别、年龄、BMI 比较,差异无统计学意义(P>0.05)。两组ApoB/ApoA1、25-(OH)D 比较,差异有统计学意义(P<0.05),PBC 组ApoB/ApoA1 高于对照组,25-(OH)D 低于对照组。见表1。
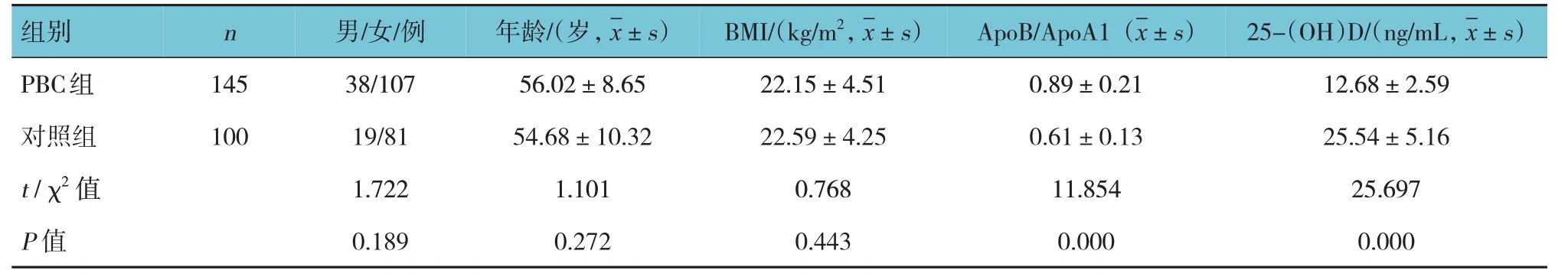
表1 两组临床资料和ApoB/ApoA1、25-(OH)D比较
2.2 轻中度病情组与重度病情组临床资料和ApoB/ApoA1、25-(OH)D比较
轻中度病情组与重度病情组性别、年龄、BMI、合并高血压、合并糖尿病、吸烟史、饮酒史、总胆红素比较,差异无统计学意义(P>0.05)。轻中度病情组与重度病情组合并高脂血症、GGT、ALP、ALT、AST、HA、LN、PCⅢ、ApoB/ApoA1 及25-(OH)D 比较,差异有统计学意义(P<0.05),重度病情组合并高脂血症、GGT、ALP、ALT、AST、HA、LN、PCⅢ及ApoB/ApoA1 高于轻中度病情组,25-(OH)D 低于轻中度病情组。见表2。

表2 轻中度病情组与重度病情组临床资料和ApoB/ApoA1、25-(OH)D比较

续表2
2.3 影响PBC 患者病情严重程度的逐步多因素Logistic回归分析
以合并高脂血症(是=1,否=0)及GGT(赋值为实际测量值)、ALP(赋值为实际测量值)、ALT(赋值为实际测量值)、AST(赋值为实际测量值)、HA(赋值为实际测量值)、LN(赋值为实际测量值)、PCⅢ(赋值为实际测量值)、ApoB/ApoA1(赋值为实际测量值)、25-(OH)D 为自变量(赋值为实际测量值),PBC 患者病情严重程度为因变量(重度=1,轻中度=0),进行逐步多因素Logistic 回归分析(引入标准0.05,排除标准0.10),结果显示:合并高脂血症[=3.053(95% CI:1.288,7.237)]、ApoB/ApoA1 [=3.184(95% CI:1.343,7.548)]及25-(OH)D [=3.377(95% CI:1.424,8.006)]是影响PBC 患者病情严重程度的影响因素(P<0.05)。见表3。
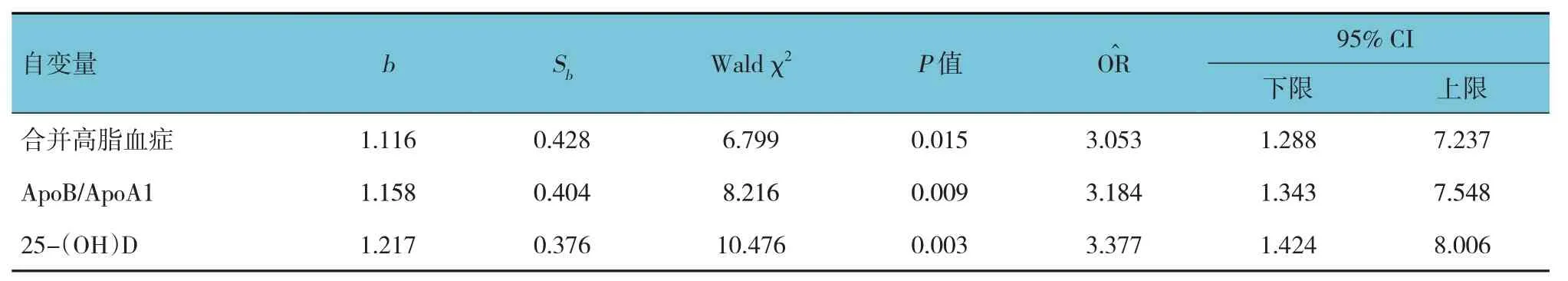
表3 影响PBC患者病情严重程度的逐步多因素Logistic回归分析参数
2.4 ApoB/ApoA1、25-(OH)D及两者联合对PBC患者病情严重程度的诊断效能
ROC 曲线分析结果显示,ApoB/ApoA1、25-(OH)D及两者联合诊断PBC 患者病情严重程度的敏感性分别为74.42%(95% CI:0.585,0.860)、72.09%(95% CI:0.561,0.842)、69.77%(95% CI:0.537,0.823),特异性分别为66.67%(95% CI:0.566,0.755)、70.59%(95%CI:0.606,0.790)、98.04%(95% CI:0.924,0.997),AUC 分别为0.668(95% CI:0.585,0.744)、0.727(95%CI:0.647,0.797)、0.883(95% CI:0.820,0.931)。见表4 和图1。
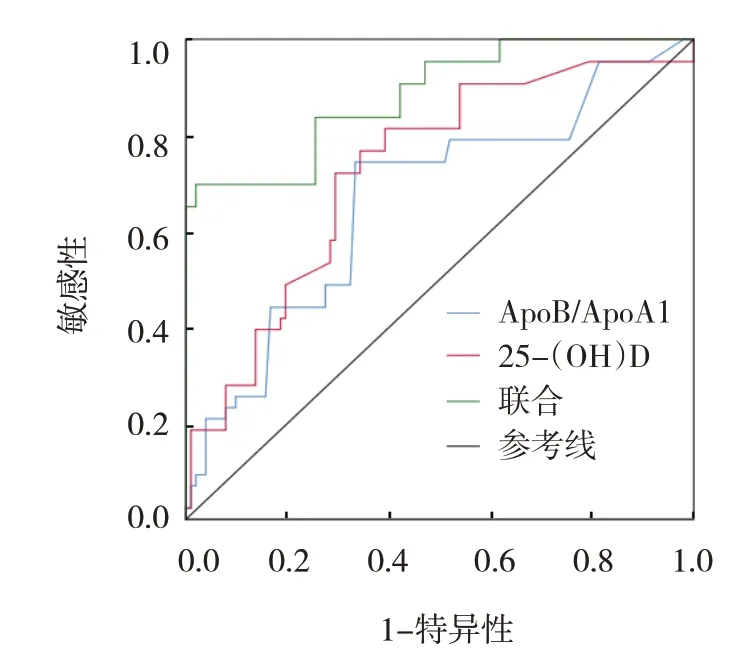
图1 ApoB/ApoA1、25-(OH)D及两者联合诊断PBC患者病情严重程度的ROC曲线
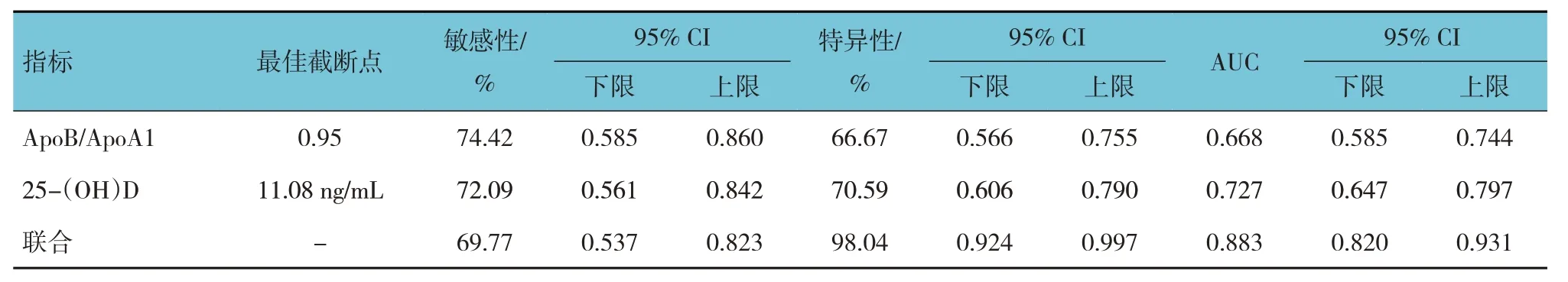
表4 ApoB/ApoA1、25-(OH)D及两者联合对PBC患者病情严重程度的诊断效能
3 讨论
PBC 是一种自身免疫性慢性胆汁淤积性肝病,发病可能与病毒性肝炎、营养障碍等有关[9-10]。PBC 早期可通过药物进行治疗,但随着肝内胆汁长时间地持续淤积,发展至终末期则需进行肝移植;故对PBC 患者的病情进行准确评估,有利于临床治疗[11-13]。通过对ApoB/ApoA1、25-(OH)D 在PBC 患者中的临床意义进行探讨,对临床PBC 患者的病情评估和临床治疗方案的制订具有重要作用。
本研究结果显示PBC 患者ApoB/ApoA1、25-(OH)D 存在明显异常。分析原因可能为,PBC患者由于肝细胞周围发生纤维化,肝窦血流不畅,致使肝细胞缺血缺氧,合成ApoB、ApoA1 能力降低,且ApoA1 的降低幅度更大,致使PBC 患者ApoB/ApoA1 异常偏高[14]。25-(OH)D 稳定性高、半衰期长,可反映机体内维生素D 水平。RHYU 等[15]研究发现,维生素D 可促进钙磷吸收、维持骨代谢平衡,同时在抑制纤维化、免疫反应等过程中发挥着重要作用;25-(OH)D 主要依赖于维生素D 受体以发挥其活性作用,而PBC 患者由于胆汁淤积,不利于维生素D 的吸收,进而降低25-(OH)D 水平。本研究结果表明,重度病情组合并高脂血症占比、GGT、ALP、ALT、AST、HA、LN、PCⅢ及ApoB/ApoA1 高于轻中度病情组,25-(OH)D 低于轻中度病情组;并经逐步多因素Logistic 回归分析显示,合并高脂血症、ApoB/ApoA1 及25-(OH)D 均为影响PBC 患者病情严重程度的影响因素。分析原因可能为合并高脂血症者由于脂代谢异常,可在一定程度上影响患者的肝功能,进而加重PBC 患者的病情。李芳芳[16]研究表明,ApoB/ApoA1 参与PBC的发生、发展,在PBC 发病早期肝细胞损伤时,肝脏可大量分泌血小板衍生生长因子,并作用于肝星状细胞,致使肝细胞进一步发生损害、甚至发生肝纤维化,导致肝脏合成ApoB、ApoA1 的能力降低,致使ApoB/ApoA1 值升高促进PBC 患者病情的加重。25-(OH)D 是维生素D 在机体中的一种活化形式,而维生素D 受体多态性与PBC 的发生密切相关;维生素D 代谢和储存的主要器官为肝脏,25-(OH)D 水平水平降低可致使机体肝脏、肾脏对维生素D 羟基化功能障碍,并降低维生素D 结合蛋白水平[17-18];故25-(OH)D 水平越低,PBC 患者病情越严重。ROC 曲线分析结果显示,ApoB/ApoA1、25-(OH)D 及两者联合对PBC 患者病情严重程度预测的敏感性分别为74.42%、72.09%、69.77%,特异性分别为66.67%、70.59%、98.04%,AUC 分别为0.668、0.727、0.883,故ApoB/ApoA1、25-(OH)D 可对PBC患者病情严重程度进行预测的可能机制为:当机体早期肝功能遭受损害时,肝脏可分泌大量血小板衍生生长因子并作用于肝星状细胞,致使肝细胞进一步发生损害,肝脏合成ApoB、ApoA1 的能力降低;ApoB 减少的幅度较小、ApoA1 水平降低幅度较大,致使ApoB/ApoA1 值明显升高[19-21]。25-(OH)D 参与PBC 患者病情的机制主要包括遗传机制和代谢机制;在遗传机制方面,25-(OH)D 水平降低可致使机体肝脏的抗氧化应激能力降低;同时由于维生素D 受体基因多态性可影响维生素D受体与25-(OH)D 的结合能力,进而降低肝脏的免疫调节能力;在代谢机制方面,25-(OH)D 水平降低可加速肝细胞的变性坏死,并可通过增加乙醇所引起的脂质过氧化反应,致使机体产生各种黏附分子、趋化因子,进而加重肝脏的脂肪变性、纤维化[22-25]。故ApoB/ApoA1、25-(OH)D 两者联合对PBC 患者病情严重程度的预测价值较高。
综上所述,ApoB/ApoA1、25-(OH)D 与PBC 患者病情严重程度有关,且ApoB/ApoA1、25-(OH)D两者联合对PBC 患者病情严重程度的诊断效能较高。

