粪便菌群移植联合口服水溶性膳食纤维治疗糖尿病性便秘的临床疗效观察
杨波 赵笛 田宏亮 吕孝琼 秦环龙, 李宁, 陈启仪,
[1. 同济大学附属上海市第十人民医院肠道微生态诊疗中心(结直肠病专科);2. 同济大学消化系统疾病临床研究中心 上海 200072]
随着人口老龄化和生活方式改变,我国成人糖尿病患病率已从1980年的0.67%飙升到2013年的10.4%[1]。预计到2040年,全球糖尿病患者数将增至近6.4亿人,其中我国糖尿病患者数将达到1.1亿人而居世界首位[2]。便秘是糖尿病的常见并发症之一。一项国内研究发现,糖尿病患者的功能性便秘发病率为41.5%,患者的饮食、运动、通便药物使用、降糖药物使用情况和患者是否出现周围神经病变等均与糖尿病性便秘的发病相关[3]。便秘可致腹痛、腹胀、痔疮和肛周不适等,甚至有患者因便秘而在排便时用力过度,由此引发脑血管破裂和心源性猝死。对于便秘,传统的药物治疗和手术治疗的不良反应多,且患者症状易反复发作。近年来的研究显示,代谢性疾病(如糖尿病[4]、肥胖症)和慢性疾病(如胃肠功能紊乱)与肠道微生物群失衡相关。因此,通过微生态治疗来调节肠道微生物群组成,可以改善代谢性疾病及合并功能性胃肠功能紊乱患者的症状[5-6]。我们开展了粪便菌群移植(fecal microbiota transplantation, FMT)联合口服水溶性膳食纤维(water-soluble dietary fiber,WSDF)治疗糖尿病性便秘的临床研究,发现有较好疗效,现报告如下。
1 对象与方法
1.1 研究对象
选取2017年6月—2019年12月在同济大学附属上海市第十人民医院住院治疗的糖尿病性便秘患者。
纳入标准:①2型糖尿病患者,诊断符合《中国2型糖尿病防治指南(2017年版)》[1]中的诊断标准;②合并便秘,便秘诊断符合功能性便秘的罗马Ⅳ诊断标准[7],病程>6个月;③过去3个月内虽在通过饮食限制、运动和口服降糖药物治疗,但血糖控制不佳,糖化血红蛋白水平为7% ~ 10%;④过去3个月内没有使用过会干扰葡萄糖稳态的糖皮质激素和抗生素;⑤愿意接受FMT,无FMT治疗相关的禁忌证。
排除标准:①孕妇或哺乳期妇女;②贫血或有血红蛋白异常疾病患者;③1型糖尿病、酮症酸中毒、活动性肝炎或合并重大心血管事件患者;④已进展到糖尿病终末期患者;⑤罹患某些严重精神疾病患者;⑥存在其他急性或慢性感染性疾病患者;⑦正在参加或3个月内参加了其他临床试验的患者。
本研究符合《世界医学协会赫尔辛基宣言》的要求,患者均签署了知情同意书。
1.2 治疗方案
FMT菌液按照国际供体标准制备[8]。
FMT治疗过程:①参照国际Amsterdam菌液制备规范制备FMT菌液[9];②床边盲插鼻空肠管;③FMT治疗前3 d进行肠道准备,经鼻空肠管给予盐酸万古霉素500 mg/50 mL,2次/d;④FMT治疗前清洗肠道;⑤经鼻空肠管注入100 mL菌液(含30 g FMT菌液),1次/d,共6次,同时嘱患者口服WSDF(粉末状果胶,8 g/包),1包/次,2次/d,共4周。
患者在住院治疗期间及随访期间(治疗后至第24周)可如既往一样继续使用原剂量的降糖药物,饮食限制要求也与普通糖尿病患者一样。
1.3 临床疗效评价指标
1)糖尿病代谢指标 在治疗前及治疗后4、12、24周时,检测患者的糖化血红蛋白水平、空腹血糖值、餐后2 h血糖值、总胆固醇水平、三酰甘油水平、体质量指数和腰围。临床达标率为治疗后糖化血红蛋白水平<7%的患者比例。
2)便秘相关指标 在治疗前及治疗后4、12、24周时,记录患者的每周自主排便次数,并进行Wexner便秘评分[10]和胃肠道生活质量指数(gastrointestinal quality of life index, GIQLI)评分[11]。根据罗马Ⅳ诊断标准,临床治愈率为经治疗后每周自主排便次数>3次的患者比例;临床有效率是指经治疗后每周自主排便次数虽未达到临床治愈标准,但较治疗前显著增加的患者比例。
3)安全性 记录治疗后患者出现的不良反应。
1.4 统计学方法
运用SPSS 20.0软件进行数据分析,计数资料用率表示,计量资料用均数±标准差表示,不同时间点的资料比较采用单向方差分析和配对t检验,P<0.05提示差异有统计学意义。
2 结果
2.1 研究对象的基本情况
根据纳入和排除标准,本研究共纳入45例糖尿病性便秘患者,其中男性27例,女性18例;年龄42 ~ 71岁,平均为(49.5±12.4)岁;体质量指数平均为(27.2±1.8)kg/m2;糖尿病病程5 ~ 25年,平均为(14.4±7.1)年;便秘病程1 ~ 11年,平均为(5.7±2.6)年。
2.2 临床疗效
在FMT联合口服WSDF治疗后4、12和24周时,患者的糖化血红蛋白水平、空腹血糖值、餐后2 h血糖值、总胆固醇水平、三酰甘油水平、体质量指数和腰围均较治疗前有显著改善,临床达标率分别为55.6%(25/45)、62.2%(28/45)和68.9%(31/45),其中治疗后24周时的糖化血红蛋白水平较治疗前降低0.9个百分点(表1);患者的每周自主排便次数、Wexner便秘评分和GIQLI评分也均较治疗前有显著改善,临床改善率分别为57.8%(26/45)、62.2%(28/45)和66.7%(30/45),临床治愈率分别为 48.9%(22/45)、55.6%(25/45)和 64.4%(29/45)(表 =2)。

表1 45例患者治疗前后糖尿病代谢指标值变化情况
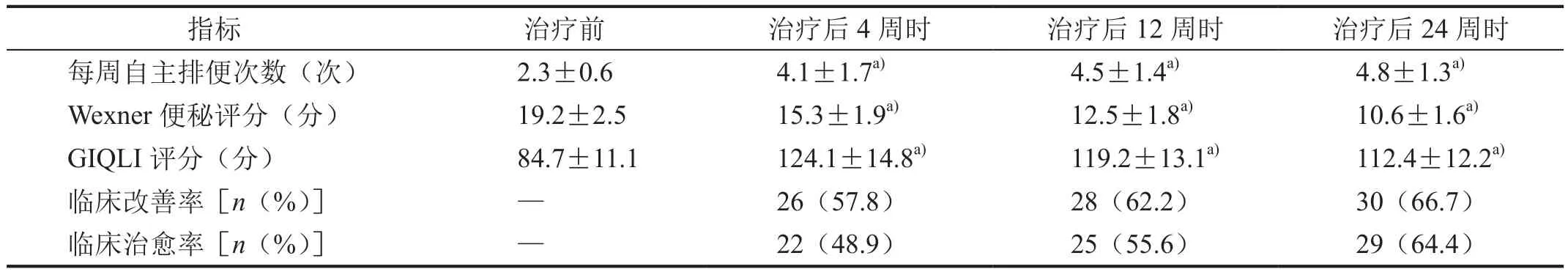
表2 45例患者治疗前后便秘相关指标值变化情况
2.3 不良反应
在治疗及随访期间,11例患者出现一过性轻度腹胀,5例患者出现轻度恶心,1例患者出现短暂头晕,1例患者出现低热(体温37.4 ℃)。未见患者发生明显的严重不良反应;未见患者发生病原体传播疾病。
3 讨论
2型糖尿病以低度炎性反应、胰岛素抵抗为特征[12]。糖尿病性便秘的主要发病机制可能为:一方面,持续的高血糖状态导致机体处于缺水状态,而大肠中水分的减少会引起粪便干结;另一方面,持续的高血糖状态也可导致机体自主神经功能受损,从而抑制胃肠蠕动。相关研究还显示,氧化应激反应会使肠道细胞凋亡率增高,导致结肠神经元减少,最终引起胃肠运动功能障碍[13]。糖尿病患者的严格饮食限制亦会使其摄入的膳食纤维减少,从而加剧排便困难。此外,糖尿病患者的胃肠相关激素水平紊乱,这会影响胃肠收缩,也可引起便秘[14]。对于糖尿病患者,虽然通过调整生活方式、运动、营养干预、药物治疗[15]和减重手术[16]能在一定程度上控制血糖、体质量和降低糖化血红蛋白水平,延缓糖尿病进程,但它们都存在一些局限性。本研究显示,糖尿病性便秘患者在接受FMT联合口服WSDF治疗后24周时,糖尿病的临床达标率为68.9%,同时便秘的临床改善率为66.7%,临床治愈率为64.4%。
糖尿病患者常伴有免疫功能低下和全身低度慢性炎性反应。这种状况与糖尿病患者肠道微生物群中有些菌群的丰度及微生物群多样性改变相关。Larsen等[17]研究了糖尿病患者和健康对照者的肠道微生物群组成,发现他们的肠道微生物群组成在门水平上有显著差异。Gaike等[18]比较了糖尿病前期、新诊出的糖尿病、正在接受治疗的糖尿病患者和健康对照者的肠道微生物群组成,结果发现4组人群肠道微生物群中的Akkermansia、Blautia和Ruminococcus菌属丰度有显著差异。此外,新诊出的糖尿病患者肠道微生物群中的乳杆菌数量减少,而Akkermansia菌属丰度与糖尿病患者的糖化血红蛋白水平呈负相关关系。另一项研究发现,2型糖尿病患者肠道中的产丁酸菌(如罗氏菌属和普拉梭菌)数量减少,而非产丁酸菌(如梭菌属)的数量显著增加[19]。糖尿病患者的胰岛素抵抗与产丁酸等短链脂肪酸的肠道微生物密切相关。
我们研究团队检测了30例混合型便秘患者粪便中的短链脂肪酸含量及切除的升结肠样本中的G蛋白偶联受体43和胆碱乙酰转移酶水平后发现,他们粪便中的乙酸、丙酸、丁酸含量均显著低于健康对照者,升结肠样本中的G蛋白偶联受体43和胆碱乙酰转移酶水平及其基因表达也均显著降低[20]。另一项研究运用变性梯度凝胶电泳和聚合酶链反应技术分析发现,顽固性便秘患者肠道中的益生菌(双歧杆菌和乳杆菌)丰度显著降低[21]。总之,糖尿病和便秘都与肠道微生物群失衡相关,肠道微生物可能既是糖尿病又是便秘治疗的一个有效作用靶点。本研究的目的就是观察微生态治疗对2型糖尿病及糖尿病性便秘的临床疗效。
近年来,FMT和WSDF在代谢性疾病治疗中的作用受到临床关注[22]。有研究发现,代谢综合征患者接受瘦者的FMT后,其肠道微生物群中的产丁酸菌数量显著增加,外周血白细胞胰岛素敏感性显著改善[23-24]。我们研究团队于2014年开始开展FMT治疗功能性便秘的临床短、长期观察,发现疗效显著[25]。WSDF是一种对肠道功能有重要作用的膳食要素,其可在结肠内被特定的菌群酵解为短链脂肪酸,能够促进益生菌(如双歧杆菌、乳杆菌)生长和调节肠道微生物群平衡,进而改善胰岛素抵抗[26-27]和促进肠蠕动、增加排便次数[28]。本研究结果显示,糖尿病性便秘患者经FMT联合口服WSDF治疗后,他们的糖尿病代谢指标值和便秘相关指标值均较治疗前有显著改善。至于治疗机制,推测是FMT联合口服WSDF治疗调节了肠道微生物群组成,使之代谢物改变,丁酸等水平升高,而短链脂肪酸水平升高能促进胰高血糖素样肽-1和酪酪肽等的分泌,最终产生胰岛素抵抗改善和胃肠动力改善作用。不过,本研究没有设置对照组,存在一定的局限性。
本研究在治疗及随访期间都未见患者发生严重的不良反应。FMT联合口服WSDF治疗慢性肠道功能性疾病,不论是短期还是长期的安全性均较好[29]。今后,我们研究团队将运用这项微生态治疗技术,对糖尿病相关的肠道内、外并发症开展更深入、更长期的临床研究,以获得更多的临床证据,并最终服务于广大患者。

