雷珠单抗联合视网膜光凝对糖尿病视网膜病变患者的疗效
李海燕 李雁朋
(九江学院附属医院眼科 九江 332001)
糖尿病为内分泌代谢性疾病,若血糖控制不佳,长期处于高血糖之中,易诱导多种并发症,其中糖尿病视网膜病变(diabetic retinopathy, DR)是最常见的一种,具有较明显的特异性,影响患者的工作、生活[1-2]。DR分为增殖性和非增殖性,前者会出现视网膜新生血管,后者则不会出现,且因糖尿病患者糖代谢存在明显异常,诱导视网膜微血管出现渗出、出血、异常等表现,进一步导致视网膜缺血,影响患者的眼部视力[3]。雷珠单抗属于抗血管内皮生长因子(vascular endothelial growth factor, VEGF)药物,当患者有新生血管出现、激光反应治疗不佳时,可给予玻璃体腔注射雷珠单抗治疗,对防治血管大量渗漏及抑制新生血管生成有积极作用,同时也可降低并发症[4]。本文探讨雷珠单抗联合视网膜光凝对DR患者的疗效,现报道如下。
1 材料与方法
1.1 一般资料
将2018年7月—2020年6月我院收治的80例DR患者(100只眼)根据治疗方法不同分为对照组((35例,40只眼,接受视网膜光凝治疗)和观察组(45例,60只眼,接受视网膜光凝联合玻璃体腔注射雷珠单抗治疗)。观察组:男25例(38只眼),女20例(22只眼);年龄40~76岁,平均(57.91±5.89)岁;病程5~12年,平均(7.98±1.02)年。对照组:男20例(23只眼),女15(17只眼)例;年龄41~75岁,平均(57.87±5.91)岁;病程5~13年,平均(8.12±1.03)年。两组患者一般资料对比差异无统计学意义(P>0.05),具有可比性。本研究经我院伦理委员会批准,所有患者签署知情同意书。
1.2 诊断、纳入和排除标准
诊断标准:依据《我国糖尿病视网膜病变临床诊疗指南》(2014 年)[5]确诊为增殖性糖尿病视网膜病变或重度非增殖性糖尿病视网膜病变,且伴黄斑水肿。
纳入标准:①患者均无斜视或弱视;②结合散瞳眼底检查、血管荧光造影检查确诊。
排除标准:①合并恶性肿瘤或肝、肾功能异常者;②中途转其他方式治疗或因精神、智力等因素无法配合治疗者;③伴随视网膜其他病变;④合并眼睑异常、青光眼、严重白内障患者;⑤血糖控制不佳者;⑥有心肌梗死或脑梗死病史;⑦合并急慢性感染性疾病。
1.3 方法
对照组给予视网膜光凝治疗。①对患者眼部检查结束后,以复方托吡卡胺滴眼液(参天制药株式会社)进行散瞳处理,再以盐酸奥布卡因滴眼液(参天制药株式会社)进行麻醉处理;②选择激光角膜镜、激光治疗仪(型号:532激光)行光凝处理,200~300 μm光斑直径,光斑为3级,曝光时间0.1~0.2 s,功率控制为100 mW并以TSOS分级测定患者光凝斑反应强度;③实行全视网膜光凝治疗,若病变严重者则施行下方眼底治疗,避免因光凝引起玻璃体出血,治疗3~4期,两期之间间隔2周;④第1次治疗颞侧与下方1/2视网膜,第2次治疗鼻侧与下方1/2视网膜,第3次则治疗上方视网膜。
观察组给予玻璃体腔注射雷珠单抗联合视网膜光凝治疗。①常规消毒后行表面麻醉处理,采用30G注射器针刺入角巩膜缘后3.5~4.0 mm,向患者玻璃体腔缓慢注射雷珠单抗(Novartis Pharma Stein AG)0.05 mL,退针后压迫穿刺点,涂抹地塞米松眼膏(ALCON CUSI s.a);共注射3次,每月1次;③激光光凝于第1次注药后开始进行视网膜光凝,治疗同上。
1.4 观察指标
比较治疗前及治疗后3个月最佳矫正视力(best corrected visual acuity, BCVA)、黄斑区视网膜厚度、VEGF水平。①视力:采取标准对数视力表,换算成logMAR形式表示;②黄斑区视网膜厚度:于治疗前后通过光学相干断层扫描黄斑中心凹,测量黄斑区视网膜厚度并进行对比;③VEGF水平:于治疗前后采集空腹静脉血4 mL,以2 500 r/min的速度离心3 min,分离血清保存待测,以ELISA法测定血清VEGF水平。
2)比较两组治疗效果,显效[6]:BCVA水平在视力表上提高≥2行;有效:BCVA水平在视力表上提高1行及以内;无效:BCVA无改善或视力下降。
3)比较两组眼底出血吸收用时、渗出吸收时间、视网膜水肿吸收时间等症状改善情况。
4)统计两组高眼压、视网膜脱落、角膜水肿、前房炎症反应等并发症发生情况。
1.5 统计学分析
采用SPSS 21.0进行统计分析,计数资料以n(%)表示,采用χ2检验;计量资料以±s表示,采用t检验。P<0.05提示差异有统计学意义。
2 结果
2.1 疗效比较
观察组总有效率为93.33%,高于对照组的77.50%(表1,P<0.05)。

表1 疗效比较[n(%)]
2.2 症状改善情况比较
观察组的眼底出血吸收用时、渗出吸收时间、视网膜水肿吸收时间均短于对照组(表2,P<0.05)。
表2 症状改善情况比较(±s,周)
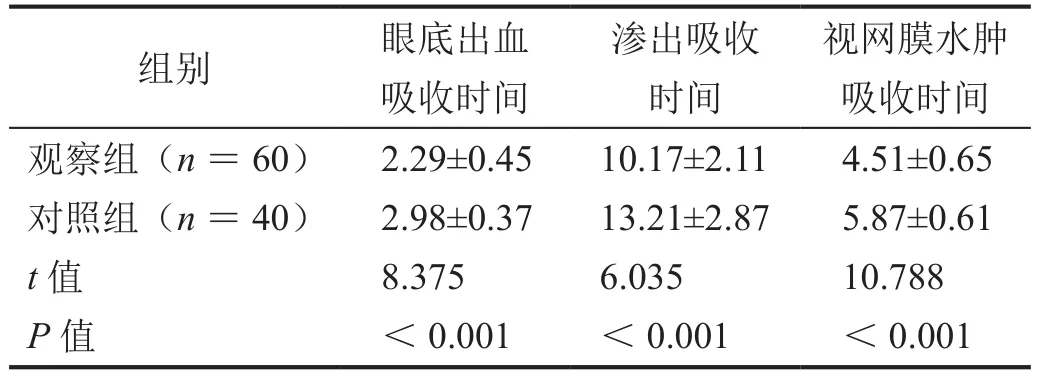
表2 症状改善情况比较(±s,周)
渗出吸收时间组别 眼底出血吸收时间视网膜水肿吸收时间观察组(n=60) 2.29±0.45 10.17±2.11 4.51±0.65对照组(n=40) 2.98±0.37 13.21±2.87 5.87±0.61 t值 8.375 6.035 10.788 P值 <0.001 <0.001 <0.001
2.3 治疗前后黄斑区视网膜厚度、logMar BCVA、VEGF水平比较
治疗前,两组黄斑区视网膜厚度、logMar BCVA、VEGF水平比较差异无统计学意义(P>0.05);治疗后,两组上述指标均下降,且观察组低于对照组(表3,P< 0.05)。
表3 治疗前后黄斑区视网膜厚度、logMar BCVA、VEGF水平比较(±s)
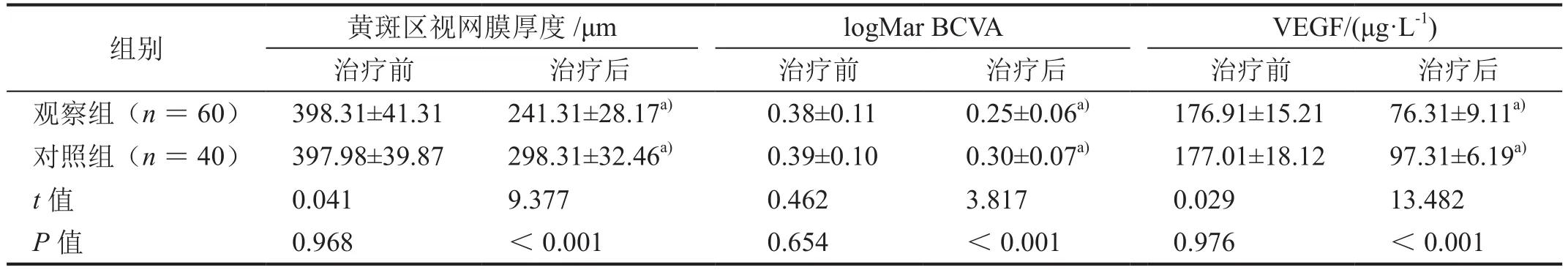
表3 治疗前后黄斑区视网膜厚度、logMar BCVA、VEGF水平比较(±s)
注:a) 与同组治疗前比较,P<0.05。
组别 黄斑区视网膜厚度 /μm logMar BCVA VEGF/(μg·L-1)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后观察组(n = 60) 398.31±41.31 241.31±28.17a) 0.38±0.11 0.25±0.06a) 176.91±15.21 76.31±9.11a)对照组(n = 40) 397.98±39.87 298.31±32.46a) 0.39±0.10 0.30±0.07a) 177.01±18.12 97.31±6.19a)t值 0.041 9.377 0.462 3.817 0.029 13.482 P值 0.968 <0.001 0.654 <0.001 0.976 <0.001
2.4 并发症发生情况比较
两组并发症发生率比较差异无统计学意义(表4,P> 0.05)。

表4 并发症发生情况比较[n(%)]
3 讨论
糖尿病所引起的并发症对患者的机体组织危害巨大,DR最为常见,其患病率会伴随糖尿病病程的延长不断增加,是降低患者视力功能的主要因素,故临床对其的重视度也越来越高。目前,DR最基本的治疗方法是视网膜光凝,主要原理是指通过激光将视网膜的出血点或者视网膜的裂孔进行封闭,从而阻止病情进一步的加重,可减少视网膜对氧的需求,提高视网膜内层中的氧浓度,促使已经生成血管消退,同时也可控制对未生成血管的形成[6]。随着医疗技术的更新,相较于视网膜光凝治疗,抗VEGF药物与视网膜光凝联合治疗效果更为理想[7]。雷珠单抗为VEGF抑制剂,可有效改善水肿情况,其还可有效调控机体血管的通透性,加速视网膜吸收渗液,以缓解黄斑水肿,显著提高患者视力[8]。本研究显示,观察组治疗总有效率为93.33%,高于对照组的77.50%,且眼底出血吸收、渗出吸收、视网膜水肿吸收等症状缓解时间均分别短于对照组,可见联合治疗可更有效改善临床症状,提高治疗效果。分析原因为视网膜光凝与雷珠单抗结合可阻断因子合成受体,加快缓解渗漏、血管出血等情况,以达到实现病情改善的目的。
黄慧等[9]研究证实,眼内的色素上皮、神经胶质、内皮细胞中均存在有VEGF表达,且DR的病理改变主要是血流动力学异常或内皮细胞遭受破坏所致,进一步造成血管通透性增加,进而出现出血、渗出等一系列病理改变,故认为VEGF在DR中发挥重要作用。眼部组织中的VEGF水平受多种因素影响,如缺氧、血清细胞因子等水平升高均可诱导VEGF及其受体表达水平升高,而雷珠单抗是重组单克隆抗体片段,能够靶向拮抗VEGF的作用,进而抑制其与受体相结合,减少新生血管的增生[10]。本研究表明,观察组患者的黄斑区视网膜厚度、logMar BCVA、VEGF均下降,且明显低于对照组,表明联合治疗可有效提高患者的视力,调节VEGF水平及黄斑区视网膜厚度。雷珠单抗能够抑制新生血管的形成,进而提高患者的视力。从安全性方面看,治疗期间两组患者均出现角膜水肿、高眼压、前房炎症反应等并发症,本研究两组患者并发症发生率比较,无明显差异,提示联合治疗不会增加不良反应,安全性较高。
综上所述,雷珠单抗可有效改善DR患者的临床症状及VEGF水平,保护患者的视力功能,不增加并发症发生率,改善患者预后,效果显著。但本次研究所纳入的样本量有限,研究时间较短,观察时间节点不够细化,在今后的研究中需完善试验环节,以进行更系统、更准确的分析,以增强试验的可信度。

