低流量鼻导管吸氧联合多奈哌齐治疗阿尔茨海默病患者抑郁、焦虑情绪的疗效观察
郭云红 王郁涛 从恩朝 吴彦
(1. 嘉兴市康慈医院老年疾病科 浙江 314500;2. 上海交通大学医学院附属精神卫生中心心境障碍科 上海 200030)
阿尔茨海默病(Alzheimer’s disease, AD)是一种以 认知功能损害为核心症状的获得性智能损害综合征[1-2]。据统计,在>60岁的老年人群中,痴呆症的患病率为3.0% ~ 4.0%[3]。痴呆症的精神行为症状(behavioral and psychological symptoms of dementia, BPSD)是指痴呆症患者经常存在的激越、幻觉、妄想、焦虑、抑郁等症状[4],痴呆症患者中有60% ~ 98%的个体会在疾病进程中出现BPSD[5-6]。有研究发现,抑郁、焦虑等情感障碍是老年痴呆症发病的危险因素,若不及时予以抗抑郁、抗焦虑治疗,会严重影响患者的生命健康和生活质量[7]。因此,积极、有效地干预AD患者的抑郁、焦虑症状,对提高患者的生活质量和改善疾病预后具有重要意义。但目前多用药物治疗AD患者的抑郁、焦虑症状[8-9],而AD患者普遍年龄偏大,身体素质较差,药物代谢能力减退,易发生药物蓄积,治疗风险增高。采用包括非药物治疗在内的联合治疗措施,可以减少单纯药物治疗给患者带来的不良反应。本研究采用低流量鼻导管吸氧联合多奈哌齐治疗AD患者的抑郁、焦虑症状,观察其疗效,旨在为AD患者BPSD管理提供参考。
1 资料与方法
1.1 资料
选取2018年5月—2021年9月在嘉兴市康慈医院老年疾病科住院治疗的58例AD患者为研究对象,按随机数字表法分为试验组和对照组各29例。其中,试验组包括女性11例、男性18例,他们的年龄为60 ~ 82岁,平均为(71.33±2.33)岁;病程为1.2 ~ 8.9年,平均为(5.75±1.07)年。对照组包括女性11例、男性18例,他们的年龄为60 ~ 83岁,平均为(71.35±2.36)岁;病程为1.3 ~ 8.7年,平均为(5.77±1.05)年。两组患者在性别、年龄、病程等方面的差异均无统计学意义(均P> 0.05)。
1.2 纳入和排除标准
1)纳入标准 ①符合《2018中国痴呆与认知障碍诊治指南(二):阿尔茨海默病诊治指南》[10]中的AD诊断标准;②存在夜间睡眠时打鼾或呼吸不规律、白天过度嗜睡症状,多导睡眠图监测显示罹患睡眠呼吸暂停低通气综合征,睡眠呼吸暂停低通气指数≥5次/h;③没有使用多奈哌齐治疗的禁忌证;④患者或其家属对研究知情同意,并签署知情同意书。
2)排除标准 ①合并严重心、肝、肾等器质性疾病患者;②有精神分裂症、焦虑症、抑郁症等精神疾病史患者;③有血液系统疾病史或脑功能不全患者;④有失语、意识障碍等影响认知功能的疾病患者;⑤无法完成全程治疗或相关评估的患者;⑥有严重脑卒中史或癫痫、恶性肿瘤患者;⑦长期酒精依赖或精神药物滥用患者。
1.3 治疗方案
对对照组患者,给予多奈哌齐治疗,其中第1 ~ 4周的给药剂量为5 mg/d,第5周起改为10 mg/d。
对试验组患者,给予低流量鼻导管吸氧联合多奈哌齐治疗,其中多奈哌齐的用药方法同对照组患者;氧疗则利用双腔鼻导管,于患者每晚入睡后进行持续8 h的2 L/min通氧。
治疗1周为1个疗程。对两组患者都治疗5周。
1.4 观察指标
在治疗前和治疗1、3、5周后,对所有患者均采用17项的汉密尔顿抑郁量表(17 items of Hamilton depression scale, HAMD-17)评估抑郁程度,采用14项的汉密尔顿焦虑量表(14-item of Hamilton anxiety scale,HAMA-14)评估焦虑程度。患者的量表评分越高,表示抑郁或焦虑程度越严重。
1.5 情绪改善疗效评价方法
以患者治疗前后的HAMD-17和HAMA-14评分减分率来评定其情绪改善的临床疗效,减分率=(治疗前评分-治疗后评分)/治疗前评分。情绪改善疗效分级,减分率≥75%的为痊愈,减分率50% ~ 74%的为显效,减分率25% ~ 49%的为有效,减分率<25%的为无效。情绪改善总有效率=(痊愈例+显效例+有效例)/总例数×100%。
1.6 统计学分析
采用SPSS 16.0软件对研究数据进行统计学分析,其中计量资料用均数±标准差表示,组间比较采用t检验;计数资料用例数和百分率表示,组间比较采用χ2检验。P<0.05提示差异具有统计学意义。
2 结果
2.1 治疗前后HAMD-17、HAMA-14评分比较
治疗1、3、5周后,两组患者的 HAMD-17、HAMA-14评分均较治疗前显著降低,且试验组患者的HAMD-17、HAMA-14评分均显著低于对照组患者(表1、2,均P< 0.05)。
表1 治疗前后HAMD-17评分比较(±s)
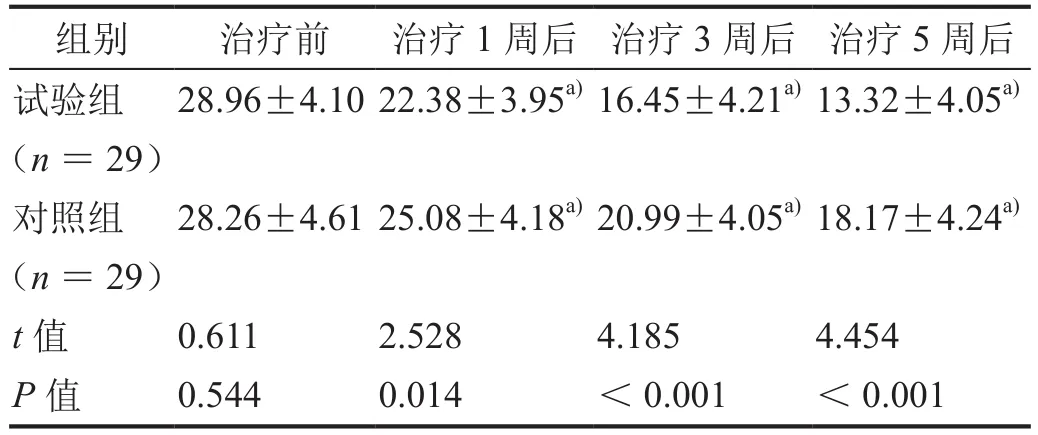
表1 治疗前后HAMD-17评分比较(±s)
注:a)与治疗前比较,P<0.01。
组别 治疗前 治疗1周后 治疗3周后 治疗5周后试验组(n=29)28.96±4.10 22.38±3.95a)16.45±4.21a)13.32±4.05a)对照组(n=29)28.26±4.61 25.08±4.18a)20.99±4.05a)18.17±4.24a)t值 0.611 2.528 4.185 4.454 P值 0.544 0.014 <0.001 <0.001
表2 治疗前后HAMA-14评分比较(±s)
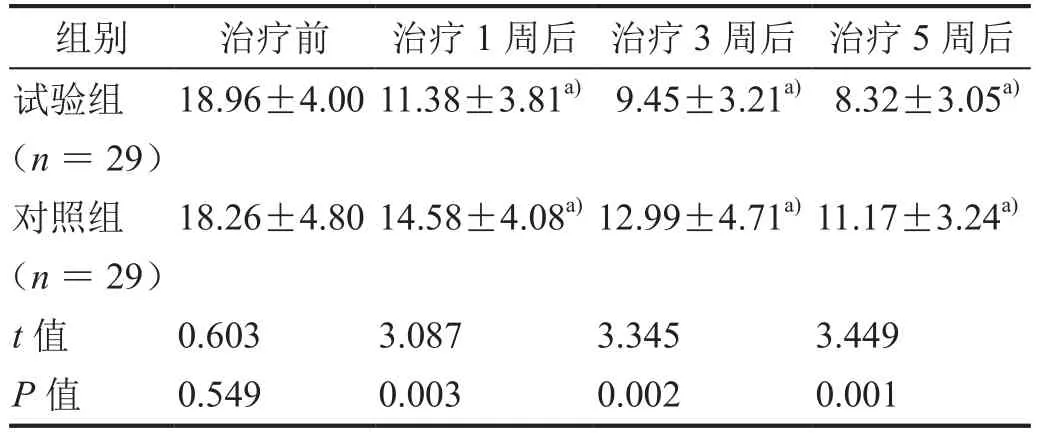
表2 治疗前后HAMA-14评分比较(±s)
注:a)与治疗前比较,P<0.01。
组别 治疗前 治疗1周后 治疗3周后 治疗5周后试验组(n=29)18.96±4.00 11.38±3.81a) 9.45±3.21a) 8.32±3.05a)对照组(n=29)18.26±4.80 14.58±4.08a)12.99±4.71a)11.17±3.24a)t值 0.603 3.087 3.345 3.449 P值 0.549 0.003 0.002 0.001
2.2 情绪改善总有效率比较
治疗5周后,试验组患者的情绪改善总有效率为89.66%(26/29),显著高于对照组患者的58.62%(17/29)(表3,P<0.05)。
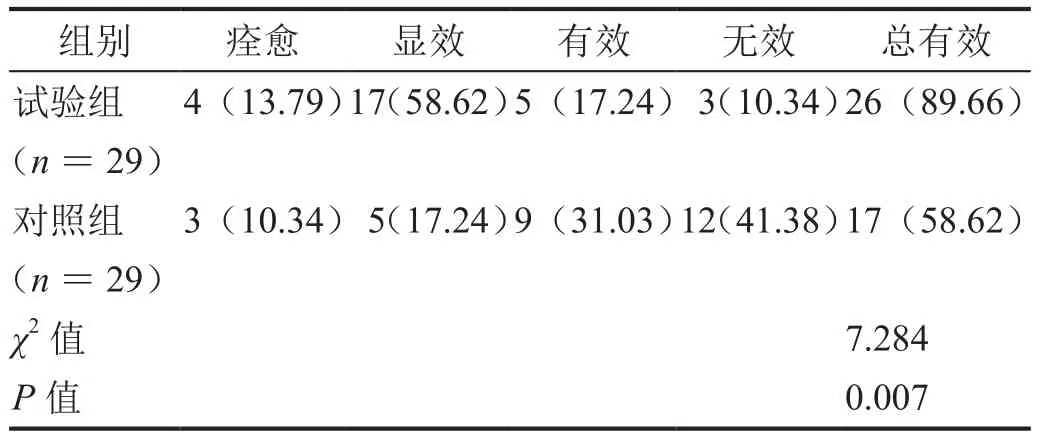
表3 治疗5周后的情绪改善总有效率比较[n(%)]
3 讨论
AD是一种获得性的持续性神经系统退行性疾病,主要病理改变是在海马体和大脑皮层等处出现β淀粉样蛋白(β-amyloid protein, Aβ)斑块、神经原纤维缠结和大量神经元溃变死亡,其中以基底前脑胆碱能神经元丢失最为严重,患者可表现出记忆力衰退、认知功能下降和行为障碍等临床症状[11-13]。目前认为脑血管壁内Aβ沉积是AD典型的病理信号[14],而这与Aβ本身的神经毒性有关。多项研究表明,缺氧可促进多种细胞分泌Aβ,并影响Aβ前体蛋白和Aβ代谢的多个环节,导致AD模型鼠大脑内的Aβ斑块增多、增大[15-17]。国内外研究指出,缺氧相关的脑内病理反应可能是前期AD的始动因素[18-19],故改善缺氧状态,干预缺氧相关的病理过程,有利于防止前期AD和AD的发生发展。此外,也有研究发现,氧疗能够修复AD模型小鼠受损的脑组织,恢复其大脑中血管和神经细胞的生长,增加脑血流量,改善认知功能[20-21]。在临床上,亦有研究显示,高压氧治疗可通过增加局部脑血流灌注,使氧弥漫进入脑组织,由此调节网状结构系统而兴奋下丘脑-垂体-肾上腺系统,使肾上腺素、多巴胺、5-羟色胺、内啡呔、甲状腺激素和γ-氨基丁酸分泌增加,从而缓解或纠正脑卒中患者的抑郁心境、食欲减退、失眠、昼夜节律紊乱、内分泌功能紊乱和焦虑不安等症状[22]。
本研究在使用传统药物多奈哌齐治疗AD的基础上,给予有抑郁、焦虑症状的患者长期夜间低流量鼻导管吸氧治疗,以期达到缓解患者不良情绪和保护脑组织,进而提高患者认知功能和生活质量的目的。结果显示,与单用多奈哌齐治疗患者相比,再联用夜间低流量鼻导管吸氧治疗患者治疗后的HAMD-17、HAMA-14评分降幅显著更大,情绪改善总有效率显著更高(分别为58.62%和89.66%),说明夜间低流量鼻导管吸氧联合多奈哌齐治疗能够改善AD患者的抑郁、焦虑症状,这有利于控制患者的AD进展,改善疾病预后,提高生活质量。
综上所述,多奈哌齐联合低流量鼻导管吸氧治疗对改善AD患者的抑郁、焦虑症状有较好的临床效果。但本研究的设计存在一定的局限性,包括未设置多奈哌齐联合抗抑郁药物治疗对照组,同时样本量较少、随访时间较短,应在随后的相关研究中予以改进。

