餐厨垃圾典型组分的热解产物分布特性
刘 亮,龙雨田,卿梦霞,罗屹东,郑 扬,贺若愚,田 红,何金桥,尹艳山,向 军
(1.长沙理工大学 能源与动力工程学院,湖南 长沙 410114;2.华中科技大学煤燃烧国家重点实验室,湖北 武汉 430074)
0 引言
城市生活垃圾产量逐年增加,严重危害生态环境并造成资源浪费[1]。据统计,我国城市生活垃圾年产量约为2亿t(餐厨垃圾占比为30%~50%),并以每年10%的速度增长[2]。餐厨垃圾成分复杂,含水量高,长期放置易腐烂变质并产生恶臭气体,甚至会传播细菌与病毒[3]。如不及时处理,餐厨垃圾可能被作为泔水油和泔水猪的原料重新流入社会,严重威胁食品安全[4]。因此,探寻餐厨垃圾高效无害的处置方式十分迫切。
餐厨垃圾的处置方法主要有填埋、堆肥、厌氧消化和热化学处理等。填埋会占用大量土地资源,且易产生大量渗滤液污染土壤和水源;餐厨垃圾高盐分的特点也限制了堆肥产品的质量;厌氧消化的经济成本相对较高,且处理周期较长[5]。与上述处置方法相比,热化学处理尤其是热解技术可制备热解油、热解气、热解焦三相产物,可实现餐厨垃圾的减量化和资源化利用[6]。生活垃圾热解处理技术已有工程设计实际案例,餐厨垃圾热解具备工业应用前景[7]。
有学者对餐厨垃圾在不同升温速率、热解温度、热解气氛和催化剂等条件下的热解特性进行了研究,发现餐厨垃圾的热解过程受原料性质和实验条件的共同影响[2],[8]。在实际条件下,餐厨垃圾的组分会随时间和地点的变化而有显著差异,现有的关于餐厨垃圾热解特性的研究多是针对单一区域特定场景的餐厨垃圾,较难为餐厨垃圾热解的工业应用提供指导。但餐厨垃圾典型组分明确,研究其中典型组分的热解特性可为餐厨垃圾热解机理的研究提供指导。
大米(富含淀粉)和豆类制品(富含蛋白质)属于我国餐厨垃圾中的主要成分,因此,淀粉与蛋白质可认为是餐厨垃圾的典型组分。基于此,本文选用大米淀粉和大豆分离蛋白两种模型化合物作为餐厨垃圾的典型组分,研究其在不同温度条件下的三相产物分布特性。首先基于气相色谱-质谱联用仪(GC/MS)与紫外荧光光谱分析仪(UV-F)解析不同温度条件下热解油产物组成和分布规律,并通过原位漫反射红外光谱仪(In-situ DRIFT)表征热解焦表面官能团的迁移变化规律,最终解析淀粉与蛋白质在不同条件下的热解产物特性的异同,以期为餐厨垃圾热解机理的研究提供指导,支撑餐厨垃圾资源化、减量化与无害化处置技术的工业应用。
1 实验材料和方法
1.1 实验材料
大米淀粉和大豆分离蛋白均为分析纯,其中大米淀粉(后续简称淀粉)购于安徽顺鑫盛源生物食品有限公司,大豆分离蛋白(后续简称蛋白质)购于上海麦克林生化科技有限公司。实验前将样品置于105℃条件下恒温干燥12h,干燥后样品保存在棕色瓶中待用。原料的工业分析与元素分析(以空气干燥基为准)见表1。
1.2 管式炉热解实验
热解特性实验在如图1所示的实验装置上进行。称取0.9~1.1g样品平铺于石英舟中,将石英舟推至管式炉外部石英管的温区,并确保系统气密性。首先用流速为300mL/min的氮气(纯度≥99.999%)吹扫30min,保证装置内空气排尽,同时以20℃/min的升温速率将反应区域升温至设定 温 度(300,400,500,600,700℃)。当 反 应 区 域达到设定温度后,将氮气流量调至200mL/min并稳定10min,随后将石英舟推至反应区域并停留15min,该过程中样品的升温速率为50℃/s。此过程中通过三级液氮冷却的U型管持续收集热解后的气相可冷凝产物,得到热解油。热解油质量通过U型管实验前后质量差得到,热解焦质量通过石英舟实验前后质量差得到。
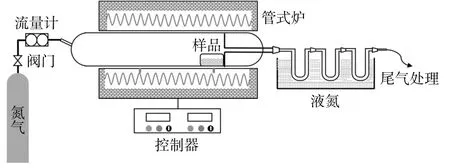
图1 热解实验装置Fig.1 Pyrolysis experimental device
热解焦产率Y焦,热解油产率Y油和热解气产率Y气的计算式如下所示。
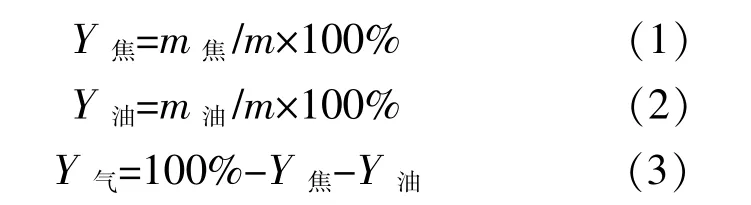
式中:m焦为实验后热解焦质量,g;m油为实验后热解油质量,g;m为每次实验的原料质量,g。
1.3 分析测试方法
热解油由多种有机物组成,包括呋喃类、醛酮类、醇类、酚类、酯类、酰胺类和腈类等轻质组分和重质组分(分子量>200Da)。采用气相色谱-质谱联用仪(GC-MS)可以精确鉴定热解油中的轻质组分,但无法准确检测其中的重质组分[9]。而紫外荧光光谱仪(UV-F)能够在不考虑分子大小的情况下表征重质组分芳香族化合物,在规定的质量浓度下,UV-F信号强度与芳香族化合物的浓度呈良好的线性关系,可以定量反映热解油中芳香族化合物的浓度。通过GC-MS和UV-F的结合,可以相对全面地了解热解油产物的组成和分布规律。
热解油的芳香环结构通过Agilent Cary Eclipse型紫外荧光光谱仪进行表征,样品测试前,先用甲醇 (色谱纯,HPLC级)将其稀释到0.0004%的质量浓度,恒定能量差为-2800cm-1,扫描速度为120nm/min,PMT电压恒定在750V。热解油中的有机成分采用Agilent5975C型气相色谱-质谱联用仪(GC-MS)进行检测,样品测试前用甲醇(色谱纯,HPLC级)将其稀释100倍(质量比),测试中采用HP-5型毛细管柱,以流量1 mL/min的氦气作为载气,进样口温度为280℃。程序升温:40℃下停留3min,然后以10℃/min的升温速率升温到280℃并停留10min。EI电离能量为70eV。
采用Thermo IS10型傅里叶变换红外光谱仪对热解过程中淀粉和蛋白质热解焦表面官能团的变化进行检测。将样品放入原位反应池后,首先用高纯氮气(流速为20mL/min,纯度≥99.999%)吹扫30min,随后将反应池从室温升至105℃,并采集背景。随后以20℃/min的升温速率从105℃升温至500℃,此过程中持续采集4000~650cm-1波长内的红外光谱。实验中红外光谱分辨率为4 cm-1,扫描次数为16次。
2 结果与讨论
2.1 热解产物产率分析
图2给出了淀粉与蛋白质热解产物产率的分布特性。由图2可知:随着热解温度的逐渐升高,淀粉和蛋白质的热解焦产率逐渐降低,并均在600~700℃时趋于平缓;淀粉和蛋白质的热解油产率则随热解温度的升高呈现出先增加后降低的趋势。其中:淀粉在500℃时达到最大热解油产率62%,随后随热解温度的进一步升高而明显下降;蛋白质在400℃时达到最大热解油产率46%,但随着热解温度的进一步升高,热解油产率的下降并不显著。淀粉和蛋白质的热解产物均以热解油为主,其次是热解气。高温会促进热解油通过二次裂解转化成小分子气体,因此,在高温下,淀粉与蛋白质的热解油产率下降,热解气产率在700℃时超过热解油产率。当热解温度为300~700℃时,淀粉的热解油产率均高于蛋白质的热解油产率,淀粉的热解焦产率均低于蛋白质的热解焦产率,说明淀粉中的挥发分含量要高于蛋白质,这与表1中的工业分析结果相一致。当热解温度进一步升高后,热解油的二次裂解程度加深。在高温下,淀粉热解油产率的降幅明显大于蛋白质,在500~700℃时,淀粉热解油产率的降幅为19.18%,而蛋白质热解油产率在400~700℃时仅降低了8.72%。淀粉热解油在高温下更易发生二次裂解,这可能与淀粉热解油中含有较多轻质成分有关。
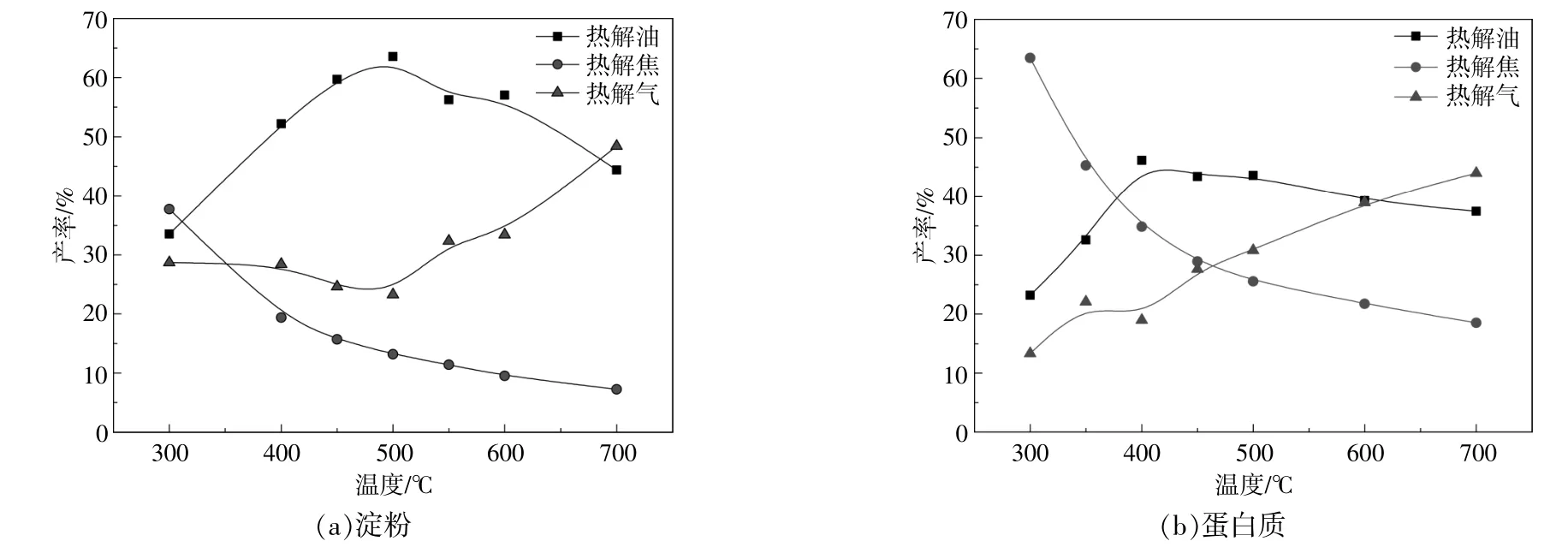
图2 不同热解温度下的热解产物产率Fig.2 The yield of pyrolysis product at different pyrolysis temperatures
2.2 GC/MS分析
本研究根据官能团将热解油中通过GC/MS检测到的有机组分分为醇类、酚类、呋喃类、含N杂环、腈类、醚类、酸类、糖类衍生物、烃类、酮类/醛类、酯类、酰胺类和其他类等类别,其相对含量如图3,4所示。
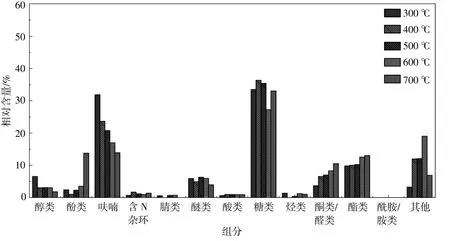
图3 不同热解温度下淀粉热解油的组分分布Fig.3 Composition distribution of starch pyrolysis oil at different temperatures
从图3可以看出,呋喃类和糖类是淀粉热解油中的主要组分,这两种组分主要来源于淀粉中糖苷键的断裂、开环反应和脱水反应[10]。在淀粉热解油中还检测到酚类、酮类、酯类和醚类等含量较高的组分,这些物质来源于热解过程中糖类聚合物/单 体 的 降 解[11],[12]。随 着 热 解 温 度 的 升 高,呋 喃类衍生物和醇类的相对含量显著降低,降幅分别为18.09%和5.51%;而酚类、酮类和酯类的相对含量呈现相反的趋势,分别升高了10.13%,5.01%和4.93%;醚类的相对含量呈先增加后减少的趋势,在600~700℃时降幅明显;呋喃类衍生物、醇类和醚类相对含量的降低可能与高温下含氧官能团的二次裂解有关[13]。
蛋白质的基本组成单位是氨基酸,因此其热解油中含有大量的含N化合物(含量超过50%),主要为含N杂环、腈类和酰胺/胺类。含N杂环,如吡啶、吡咯、嘧啶、吲哚和喹啉等主要来源于具有-COOH和-NH2基团的氨基酸的脱水环化反应。从图4可以看出,随着热解温度的升高,蛋白质热解油中含N杂环的相对含量变化并不明显,这可能是因为含N杂环未细分为吡啶、吡咯等进行讨论。除含N杂环外,腈类和酰胺/胺类也是蛋白质热解油的主要组分。酰胺/胺类主要由氨基酸的脱羧反应产生,随着热解温度的升高,酰胺/胺类化合物会发生脱氨基、环化和异构化反应,导致酰胺/胺类的相对含量下降[14]。通过氨基酸直接裂解以及酰胺/胺类/亚胺的脱水/脱氢反应形成的腈类化合物也会在高温下发生二次裂解。需要强调的是,蛋白质也是酚类物质的来源,随着热解温度的升高,酚类物质的相对含量呈增加的趋势,这是因为高温促进了酚类氨基酸(如酪氨酸)的热 解[15]。
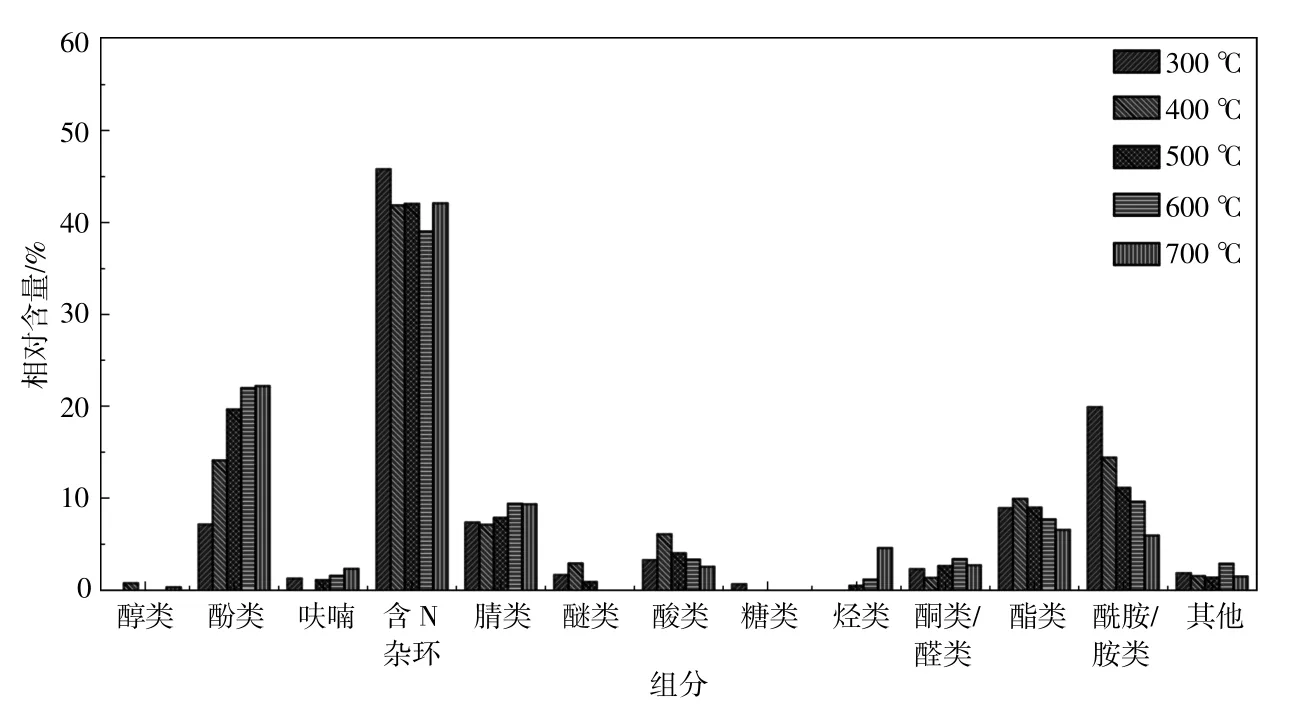
图4 不同热解温度下蛋白质热解油的组分分布Fig.4 Composition distribution of protein pyrolysis oil at different temperatures
2.3 紫外荧光光谱分析
图5为淀粉和蛋白质热解油的紫外荧光光谱图。谱图中不同波长的荧光峰代表芳香环的大小,较高荧光峰值则表明该芳香环的含量较高。
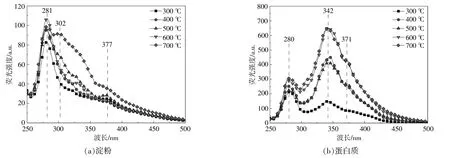
图5 不同热解温度下热解油的紫外荧光光谱图Fig.5 UV Fluorescence spectra of pyrolysis oil at different temperatures
从图5(a)可以看出:在281nm处有一个明显的荧光峰,对应单环芳香族化合物,其含量随热解温度的升高而先增后减,并在600℃时达到最大值;当热解温度为700℃时,在302nm处出现一个肩状峰,该峰对应2个苯环的芳香族化合物,表明高温会促进多环芳香族化合物的形成;在377 nm处还存在一个微弱的荧光峰,对应大于3环的稠环芳香族化合物,随着热解温度的升高,其光谱强度有增强趋势。
从 图5(b)可 以 看 出:在280,342,371nm处分别存在1个主峰,其中280nm处的主峰对应单环芳香族化合物,342nm和371nm处的主峰对应3环或3环以上的稠环芳香族化合物[16];随着热解温度的升高,荧光峰强度呈上升趋势,其中单环芳香族化合物主要在500~600℃时增加,稠环芳香族化合物主要在300~400℃和500~600℃时增加。从图5可以看出,蛋白质热解油中的芳香族化合物的含量显著高于淀粉热解油,且蛋白质热解油中具有较多的重质组分,而淀粉热解油中具有较多的轻质组分,这一现象与前文中GC/MS的实验结果相一致,主要是由淀粉与蛋白质的结构组成差异造成。
2.4 原位红外光谱分析
图6为淀粉和蛋白质的原位红外光谱图。从图6可以看出,淀粉与蛋白质的红外光谱均在3540~3465cm-1处出现属于醇类结构的O-H伸缩振动的负峰,这主要是由于高温下淀粉与蛋白质发生脱水和脱氧反应而导致O-H分解,使热解焦表面的O-H强度降低。位于3396cm-1处的吸收峰属于蛋白质结构中N-H的伸缩振动,N-H并不稳定,当热解温度超过400℃后,蛋白质结构遭到破坏,导致其吸收峰强度降低。=C-H和C-H官能团的吸收峰分别出现在3010~3008cm-1和2964~2856cm-1处,表明两者均存在烯烃和烷烃结构。此外,随着热解温度的升高,甲基对应的CH键强度降低,而亚甲基对应的C-H键和=C-H键的强度升高,这表明长链脂肪族化合物的断裂会产生C-H和=C-H,且高温会促进C-H发生脱氢反应转化为=C-H。C=O键和C=C键分别出现在1733~1700cm-1和1598~1504cm-1处,淀 粉中的C=C键强度会随着热解温度的升高而逐渐增大,表明其芳构化程度加深;蛋白质在1552cm-1处的吸收峰强度略微降低,主要是因为苯环的C=C伸缩振动峰和N-H面内弯曲振动峰重叠在一起,高温下N-H结构裂解,导致对应的吸收峰强度降低;两组分的C=O键的强度变化各不相同,蛋白质中的C=O键归属于脂肪酸或氨基酸,其强度降低与脂肪酸或氨基酸的脱羧作用有关[17];淀粉中的C=O键属于酮类结构,随着热解温度的升高,C=O键强度增加,表明酮类结构的C=O键 的 热 稳 定 性 较 好。1454~1392,1189~1132,1072~1070cm-1处分别属于属于甲基/亚甲基的伸缩振动、醚键C-O-C的伸缩振动和碳骨架的振动,但其强度较低[18],[19]。芳香族化合物的C-H面外弯曲振动出现在971~820cm-1处,且淀粉的强度增加高于蛋白质,表明淀粉的芳构化程度更高[17],[18]。
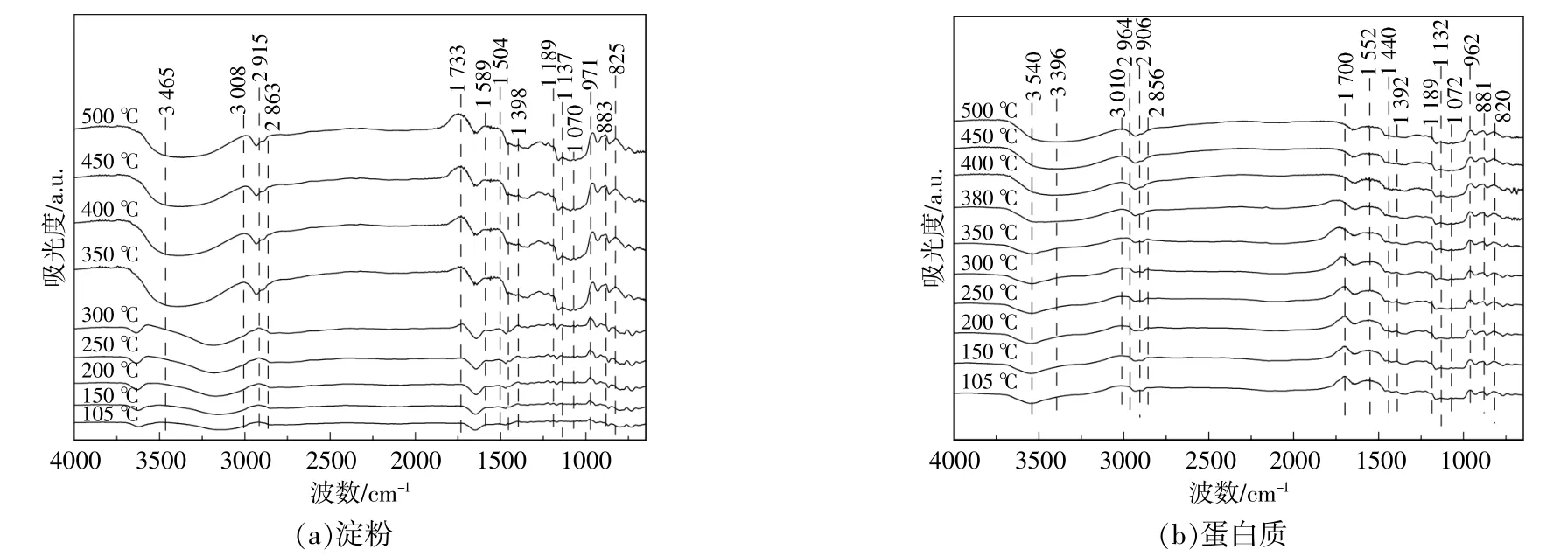
图6 原位红外光谱图Fig.6 In-situ DRIFTS characterization
根据淀粉和蛋白质原位红外光谱图的变化,可以确定两者上述官能团的变化分别发生在300~450℃以及300~400℃。淀粉和蛋白质热解焦的官能团演化规律的不同与两者的基本组成结构存在密切联系。淀粉的O-H键强度变化明显大于蛋白质,表明淀粉的脱水反应强度大于蛋白质,GC/MS结果中淀粉热解油主要组分为呋喃类衍生物和糖类中的脱水糖产物也能证实这一点。两者C=O键强度的变化差异与GC/MS结果中两者含C=O官能团化合物(如醛酮类和酯类)的含量变化一致。此外,仅在蛋白质的红外光谱图中检测到了独属于氨基酸的N-H结构。
综上所述,虽然不如GC-MS/UV-F实验可以确定产物的分布,但原位红外实验可以推断出淀粉和蛋白质的大多数化学反应分别发生在300~450℃以及300~400℃。该温度范围适用于开发生产淀粉和蛋白质相关热解化学产品的热化学工艺。
3 结论
本文针对餐厨垃圾的典型组分(淀粉和蛋白质)在不同热解温度下的热解特性及三相产物分布展开了相关研究,主要得到如下结论。
①热解温度是影响淀粉和蛋白质热解过程的重要因素。在300~700℃时,淀粉的热解油产率始终高于蛋白质,其中淀粉的热解油产率在500℃时达到最高,为62%,而蛋白质在400℃时存在最高的热解油产率(46%)。随着热解温度的进一步升高,热解油会发生二次裂解,导致热解气产率随温度的升高而增加。
②淀粉和蛋白质的热解油组成及组分分布存在明显差异,且随温度的变化而变化。在300~700℃时,淀粉热解油中的主要组分为呋喃类衍生物和糖类,而蛋白质热解油主要由含N杂环、酚类和酰胺/胺类等物质组成,且蛋白质热解油中的芳香族化合物的含量要显著高于淀粉热解油。
③在淀粉和蛋白质热解过程中,其表面官能团的变化差异由两者不同的结构组成所引起。随着热解温度升高,蛋白质结构遭到破坏,会导致N-H键和氨基酸结构的C=O键强度降低,而淀粉中酮类结构的C=O键的热稳定性较好,在高温下,C=O键的强度会有所增加。淀粉和蛋白质的大多数化学反应分别发生在300~450℃以及300~400℃。该温度范围适用于开发生产淀粉和蛋白质相关热解化学产品的热化学工艺。

