β-葡聚糖的营养健康功能研究进展
郭 瑞,周 爽,王文秀,宁方杰,李青原,刘志刚✉
(西北农林科技大学 食品科学与工程学院,陕西 杨凌 712100)
葡聚糖是自然界中最常见的一类以葡萄糖单体聚合而成的高分子多糖链,以D-吡喃型葡萄糖为基本单元,其结构具有多样性,糖苷键通常类型有:(1→3)、(1→4)、(1→6)三种类型,分为 α型和β型[1-2]。α-葡聚糖为带状单链结构,沿着纤维轴呈无螺旋状伸展,基本不具备生物活性,代表物质如给人体提供主要能量的淀粉等。β-葡聚糖系由合成前体物质尿苷二磷酸葡萄糖经酶催化而成的多聚体[3-4]。近年来,β-葡聚糖因其优良理化性质成为了食品领域的研究热点,尤其是随着分离纯化、结构鉴定、功能表征等研究技术的更新应用,β-葡聚糖的特殊生理活性和药用价值也被不断发现。本文介绍了近年来β-葡聚糖在生物学功能方面的研究现状,着重讨论了其对血糖血脂、机体免疫力、神经发育及肠道功能等方面的调控作用,为β-葡聚糖的进一步开发利用提供理论参考。
1 β-葡聚糖的来源及构效关系
β-葡聚糖的来源十分广泛,可从海藻、小麦、燕麦、大麦等多种天然植物以及酵母、产碱杆菌与可食用真菌等微生物中获得[5]。不同来源的β-葡聚糖,其糖苷键类型、分子结构、分支位置等方面存有差异(见表1)。植物来源的β-葡聚糖主要存在 β-(1→3)和 β-(1→4)两种糖苷键,谷物 β-葡聚糖分子中由 β-(1→4)糖苷键连接的葡萄糖残基,常被单个的 β-(1→3)糖苷键分隔,从而形成了纤维三糖(DP3)和纤维四糖(DP4)片段,DP3和DP4的比例也成为了谷物β-葡聚糖重要的结构特性[6]。微生物来源的β-葡聚糖常以β-(1→3)和 β-(1→6)糖苷键连接而成[7]。分离自酵母、猴头菇等真菌的 β-葡聚糖一般具有类似的分子结构,即含有 β-(1→3)糖苷键连接的葡萄糖残基构成的主链和由 β-(1→6)糖苷键连接而成的分支;而来自农杆菌的 curdlan是一种不含分支,仅由β-(1→3)糖苷键连接而成的线性β-葡聚糖[8]。糖苷键的含量和聚合度还影响着β-葡聚糖的溶解性、分子量等理化特性。水溶性 β-葡聚糖中 β-(1→3)与β-(1→4)糖苷键含量之比为 1∶(2.3~2.6),而非水溶性β-葡聚糖中相应糖苷键含量之比约为1∶4.2[9]。β-葡聚糖的分子量通常分布于约103~106kDa之间,并随品种、产地、提取方法和测定方法不同而有一定差异[10]。
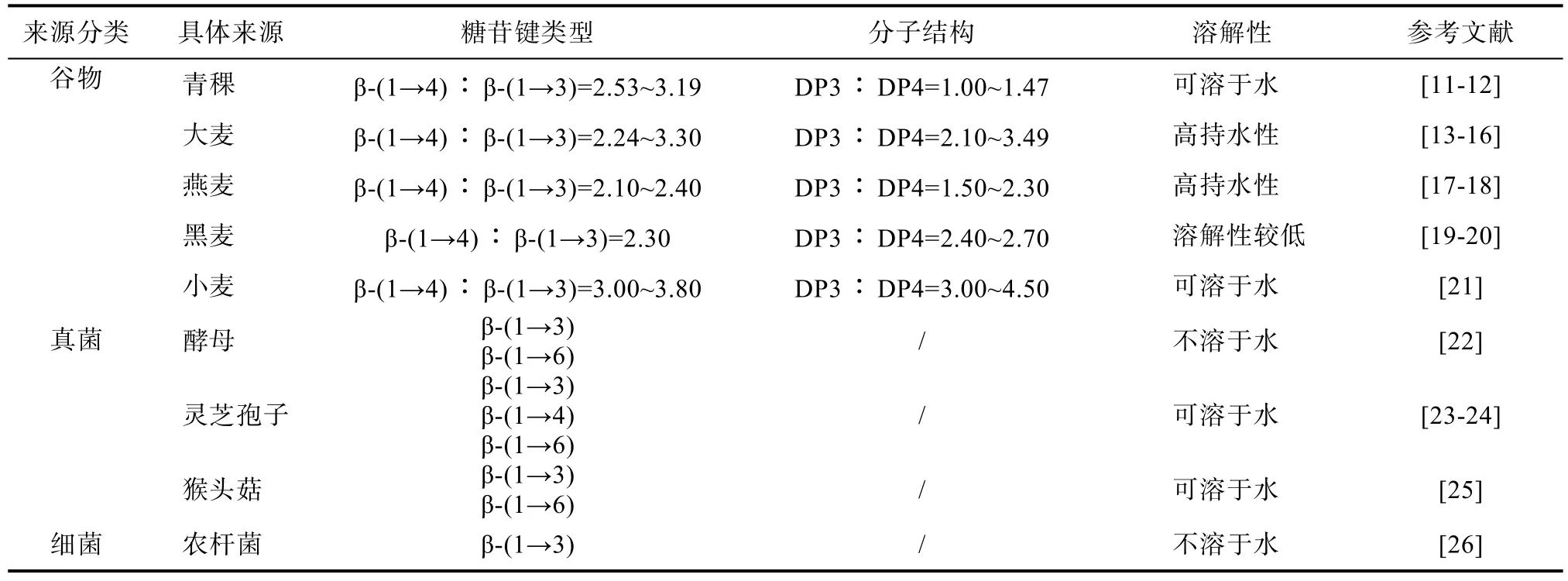
表1 不同来源β-葡聚糖的结构Table 1 Structure of β-glucan from different sources
2 β-葡聚糖的生理功能
随着人民生活水平的提高和高脂高糖等西式饮食文化的流行,慢性代谢疾病的发病率不断攀升,通过饮食控制改善身体机能的方法越来越受到重视。我国为推进建设健康中国、提高人民健康水平,于2016年提出的《“健康中国2030”规划纲要》中指出:利用营养干预,逐步解决部分人群营养不足与过剩并存问题。研究表明,β-葡聚糖可在改善健康和预防慢性非传染性疾病(如糖尿病、高胆固醇血症、肥胖、癌症和神经退行性疾病)等方面发挥着关键作用[27]。美国食品药品监督管理局于 2007年批准了 β-葡聚糖作为安全的食品添加剂[28],目前,中国、日本、美国、澳大利亚等 45个国家均已批准使用 β-葡聚糖[10],对β-葡聚糖分子特性与精准营养相关性方面的研究及功能食品的研发已成为各国营养学界、药理学界的关注热点。
2.1 β-葡聚糖调控血糖的作用研究
β-葡聚糖生理功能的类型和强度通常归因其分子结构(主侧链的组成、三维构象和分子量大小等)和理化特性(溶解度、持水性、膨胀性、黏度及发酵性等)[29]。已有大量研究表明β-葡聚糖具有良好的降血糖的作用,潜在机制可能为:
干扰机体对膳食营养成分的吸收:β-葡聚糖与水分子的相互作用增加了溶液的黏度和肠粘膜表面水层厚度,降低了食糜通过小肠的速度,减缓了营养物质(如糖、氨基酸等)与消化酶底物的结合[29-31];另外,β-葡聚糖还会吸附钙、铁、锌等离子和有机质,从而影响这类物质的代谢水平。β-葡聚糖的黏性和浓度与其相对分子质量大小有密切相关性,黏性越高(分子量越大)降血糖潜力越大[32],Wood等发现分子量介于 1×105~8×105之间的β-葡聚糖对血糖的调控作用较强[33]。
β-葡聚糖还可通过保护胰岛 β细胞、抑制糖代谢相关酶等以减少血糖升高[34]。Shen等研究发现燕麦β-葡聚糖通过增加胰岛素和胰高血糖素样肽-1的分泌调节糖脂代谢,减轻糖尿病模型小鼠的胰岛素抵抗[35]。Liu等发现燕麦β-葡聚糖可修复并改善胰岛β细胞和组织结构的完整性,保护肝源性糖代谢,改善II型糖尿病模型小鼠的糖耐量[36]。此外,Yokoyama等和Juorch等的研究显示,β-葡聚糖可显著降低健康人群的餐后血糖值和胰岛素水平[37-38]。郑等发现,药物Oatrim(含燕麦β-葡聚糖)能有效降低I型和II型糖尿病患者的餐后血糖浓度和胰岛素水平,这可能与β-葡聚糖对α-淀粉酶、α-葡萄糖苷酶和转化酶活性的抑制有关[39-40]。
2.2 β-葡聚糖调控脂代谢的作用研究
自1963年荷兰科学家Groot等指出β-葡聚糖能有效降低体内胆固醇的合成后,大量的动物实验和人体临床学研究就证实了该结论[41]。β-葡聚糖对胆固醇的影响主要在于能显著降低血浆中总胆固醇和低密度脂蛋白胆固醇,而对高密度脂蛋白和甘油三酯没有明显影响,同时也不影响胆固醇在脂蛋白中比例[42]。目前相关机理尚不清楚,存在以下五种假说:①β-葡聚糖可以结合胆汁酸并外排,从而促进胆固醇向胆汁酸转化,抑制了血清中胆固醇的聚集[43];②β-葡聚糖可被肠道中微生物发酵而产生短链脂肪酸(Short Chain Fatty Acids,SCFAs),如乙酸、丁酸等,这些物质可抑制肝脏中胆固醇的合成[44];③β-葡聚糖可调节脂肪酸、甘油酯等胆固醇合成和代谢的相关酶的活性,调节脂质代谢和胆固醇代谢,同时可以促进低密度脂蛋白胆固醇分解[45];④β-葡聚糖在小肠内形成高黏性溶液,阻碍胆汁的乳化作用和胆汁酸的再吸收[45];⑤β-葡聚糖可通过调节巨噬细胞-胆固醇轴进而调节胆固醇代谢[46]。
Drozdowski等研究发现分离自燕麦和糯大麦中的高粘度β-葡聚糖可通过下调脂肪酸合成和胆固醇代谢相关基因的表达,减少肠道对长链脂肪酸和胆固醇的摄取[47]。Wang和 Sunberg等则利用β-葡聚糖酶,验证了β-葡聚糖是使大鼠和仓鼠体内血浆胆固醇和低密度脂蛋白水平降低的主要功能成分[48]。Thandapilly等研究发现高分子量的大麦β-葡聚糖可促使轻度高胆固醇血症患者粪便胆汁酸排泄量和总SCFAs浓度增加[49]。
2.3 β-葡聚糖免疫调节的作用研究
近年来的研究表明,β-葡聚糖作为一种天然的免疫调节剂,可以结合并激活免疫细胞,分泌细胞因子,参与宿主的特异性免疫与非特异性免疫,从而提高机体免疫功能[50-51]。Jin等发现燕麦β-葡聚糖可以调节免疫应答,使小鼠血清免疫球蛋白增加,并刺激抗炎因子的分泌,从而提高小鼠免疫力[52]。Yun等发现β-葡聚糖能够有效地改变小鼠肠系膜淋巴结和派氏淋巴结的细胞数量,增强了小鼠对金黄色葡萄球菌或大肠杆菌感染的抗性[53]。Salah等研究发现 β-葡聚糖可以调节罗非鱼的免疫相关基因,抵抗鱼类链球菌的感染[54]。Golisch等发现真菌 β-葡聚糖被巨噬细胞内化后与中性粒细胞结合,由此产生的活化粒细胞能够杀死部分肿瘤细胞[2]。
2.4 β-葡聚糖改善脑功能的作用研究
已有大量研究发现,菊粉、低聚果糖等膳食纤维及它们的代谢产物具有潜在的脑功能保护作用。Haider等的研究表明,β-葡聚糖可通过抑制中枢神经系统内乙酰胆碱的水解减轻东莨菪碱诱导的大鼠认知缺陷[55]。高脂低纤维饮食会导致小鼠小胶质细胞的激活及突触损伤,而饮食补充β-葡聚糖可以优化脑部突触超微结构和相关信号通路,减轻肥胖小鼠的神经炎症和认知能力下降[56-57]。Xu等的研究表明,酵母β-葡聚糖改善了痴呆模型小鼠的神经炎症和脑胰岛素抵抗[58]。Hu等证明了长期补充β-葡聚糖显著改善了前额叶皮层中的突触超微结构,增强识别记忆的能力[59]。更为重要的是,已有临床研究表明,3至18岁的孤独症儿童在摄入含有β-葡聚糖的食品补充剂后,行为模式(自闭症评定量表分数显著降低)和α-突触核蛋白的表达水平得到显著改善[60]。
2.5 β-葡聚糖对肠道微环境的作用研究
人体肠道内的大量共生菌构成的微生物屏障可以抵抗病原菌的入侵,并提供重要的保护作用,而肠道内微生物群落的变化也显著影响着宿主的生理功能[27]。β-葡聚糖作为一类重要的益生元,可对胃、肠道内的微生物群产生积极影响。由于人体内缺少β-葡聚糖酶,β-葡聚糖不能被消化道直接消化,但却能被大肠内益生菌分泌的糖苷酶降解吸收利用,因此,β-葡聚糖选择性地刺激了益生菌的活力和增殖,同时,一些益生菌在自身代谢中产生的乳酸等物质降低了肠道的pH,抑制了有害菌的生长和繁殖[61]。另一方面,β-葡聚糖在结肠中被厌氧菌分解代谢产生的 SCFAs为结肠粘膜细胞提供了营养[62],促进肠上皮细胞、肠道T细胞的增殖[63]。SCFAs还可以抑制葡萄糖苷酶、葡萄糖醛酸酶和脲酶等肠癌诱发因子的活性,并抑制第一级胆酸向第二级胆酸的转化,增加次级胆汁酸的排出,具有预防结肠癌的作用[64-65]。
申瑞玲等研究发现燕麦β-葡聚糖可促进小鼠肠道中的双歧杆菌和乳酸杆菌增殖,并抑制大肠杆菌的繁殖,改善了肠道环境[66]。Pieper等研究发现,含β-葡聚糖的饲料有利于断奶仔猪肠道内产丁酸的益生菌的繁殖[67],丁酸可以为肠上皮细胞提供能量,利于保持肠道黏膜完整性,并在细胞实验中表现出抑制癌细胞活性的作用[68]。SCFAs还能增加大鼠结肠粘液层的厚度,维护肠道的正常功能[69]。
3 总结
β-葡聚糖在促进健康和预防疾病方面发挥着重要作用,对控制餐后血糖和减弱胰岛素反应、降低胆固醇和高血脂、增强机体免疫力和肠脑健康保护等方面有着积极影响,这也为其在功能性食品、医疗保健、食品添加剂等健康产业领域的开发赋予了巨大的潜能。近年来的研究多从β-葡聚糖原料来源、加工方式、分子大小或黏度高低等方面,采用体内外实验,从生化指标、代谢调控等方面对营养功效进行表征,但对于β-葡聚糖各种生物学活性机制的研究还不够明晰,未来研究可联合代谢组学、基因组学和转录组学等新技术方法去进一步诠释其营养机制,为β-葡聚糖新型健康食品研发提供更多的科学依据。

