慢加急性肝衰竭诊断标准的研究进展
王霞,杨晋辉,郑梦瑶,江婷,徐智媛,马红琳
慢加急性肝衰竭(ACLF)指在慢性肝病基础上遭受急性打击后,出现急性肝功能失代偿,以多器官/系统功能衰竭、短期高死亡率和严重全身炎性反应为主要特征的一组独特的临床综合征[1]。一项大型荟萃分析表明,ACLF的全球患病率约为35%,ACLF患者90 d死亡率约为58%[2]。由于不同国家或地区ACLF的病因、诱因及临床特征等不同,目前全球尚无统一的ACLF诊断标准。临床医生在识别ACLF时常感到困惑,从而导致难以实现对ACLF的早期精准干预。因此,本文通过回顾国内外较为常用的ACLF定义,以及ACLF诊断标准相关研究,分析各ACLF诊断标准之间的差异,以期帮助临床医生更好地认识ACLF、优化临床决策,进而改善ACLF患者的临床结局,减轻患者的家庭经济负担,促进医疗资源合理利用。
1 国内外ACLF的诊断标准
1995年日本的OHNISHI等[3]将ACLF描述为一种肝脏同时遭受急、慢性打击的情况。此后的20多年间,亚太肝病学会(APASL)、欧洲肝病学会(EASL)、北美终末期肝病联盟(NACSELD)等基于国家(地区)层面的队列研究相继发布了ACLF的定义及诊断标准。
1.1 APASL发布的ACLF诊断标准 在2008年的亚太肝病学会年会上,ACLF工作组的专家们系统回顾了已发表的文献,分享了20多个国家的ACLF案例。考虑在以往的ACLF定义下,病情较重的患者更易被识别,而病情正在发展或通过接受早期诊治疾病能被逆转,甚至治愈的患者可能会被遗漏[4],ACLF工作组的专家们最终达成一致,将ACLF定义为在(先前诊断或未诊断)慢性肝病基础上出现的急性肝功能损伤,以黄疸〔血清总胆红素(TBil)≥5 mg/dl〕和凝血功能障碍〔国际标准化比值(INR)≥1.5或凝血酶原活动度(PTA)<40%〕为最初表现,并且28 d内并发腹腔积液和/或肝性脑病[4]。APASL而后基于亚太肝病学会慢加急性肝衰竭研究联盟(AARC)开展的多项前瞻性多中心队列研究结果,相继在2014、2019年更新了ACLF专家共识[5-6],并进一步强调了ACLF的诊断要点,主要包括:(1)急性肝损伤的时间窗,强调了ACLF患者高28 d死亡率。(2)慢性肝病的界定,包括肝硬化与非肝硬化慢性肝病(病毒性、酒精性及非酒精性脂肪性肝病等所致的慢性肝炎或肝硬化),既往发生过肝硬化失代偿的患者应被排除。(3)急性诱发因素,主要考虑肝内因素,如嗜肝病毒的再激活、药物等,AARC认为目前少有研究结果能为感染本身会导致黄疸及肝衰竭这一观点提供理论和证据支持,故将感染视为ACLF的并发症。(4)ACLF的可逆性,即血清TBil降至5 mg/dl以下,凝血功能障碍逆转(INR降至<1.5),肝性脑病和/或腹腔积液消退,肝储备功能改善,肝纤维化减轻,门静脉压力降低。AARC指出,ACLF的中位逆转时间为30 d;AARC开展的队列研究结果显示,在生存时间超过90 d的ACLF患者中,有70%的患者生存时间可超过1年。(5)疾病严重程度评估,AARC提出的AARC评分系统被认为可有效地预测病情发展及预后,其主要由5项参数组成,分别为血清TBil、血肌酐、血清乳酸、INR和肝性脑病,具有简便、易于在床旁使用的特点。AARC评分系统在预测ACLF患者28 d死亡率方面优于常用的终末期肝病模型(MELD)和慢性肝衰竭-序贯器官衰竭评估(CLIF-SOFA)评分,还可以在第1周内可靠地预测患者对肝移植等干预措施的需求情况[7]。与其他预后评分系统相比,AARC评分系统在预测非亚洲ACLF患者90 d和180 d死亡率方面也同样具有良好的价值[8]。(6)2019年版共识认为现有的ACLF定义可用于儿童ACLF的诊断,AARC评分系统也可用于预测ACLF患儿的预后。印度的一项多中心研究显示,在APASL发布的ACLF诊断标准、AARC评分系统下,儿童ACLF的总体患病率为13.4%,ACLF患儿的短期死亡率为29.8%,并且AARC评分≥11分的患儿可被认为是紧急肝移植候选者[9]。尽管AARC开展的研究中纳入的慢性肝病患者的主要病因是乙型肝炎病毒(HBV)感染,与欧美、日本等国家(地区)慢性肝病人群的病因及临床特征存在明显差异,但来自上述国家(地区)的相关研究也证实采用APASL标准可以识别出病情轻或正在发展的早期ACLF患者[10-11]。
1.2 EASL发布的ACLF诊断标准 鉴于既往ACLF诊断标准的形成多基于专家共识,缺乏循证医学证据支持,2011年CANONIC研究团队在欧洲8个国家29家肝病中心开展了一项前瞻性研究,研究纳入的主要为酒精性肝病及丙型肝炎病毒(HCV)感染所致的肝硬化患者[1]。该研究表明,ACLF不同于单纯的急性失代偿肝硬化,其以多器官/系统功能衰竭和严重全身炎性反应为临床特征,ACLF患者短期死亡率比急性失代偿肝硬化患者高15倍[1]。EASL将ACLF定义为在肝硬化的基础上出现急性肝功能失代偿,以多器官/系统(肝脏、脑、肾脏、凝血系统、呼吸系统、循环系统)功能衰竭和短期高死亡率(28 d死亡率>15%)为主要特点。此外,CANONIC团队通过改良序贯器官衰竭(SOFA)评分建立了CLIF-SOFA评分,将其用于评估病情的严重程度,根据器官/系统(肝脏、脑、肾脏、凝血系统、呼吸系统、循环系统)功能衰竭情况对ACLF进行分级。非ACLF:(1)无器官/系统功能衰竭;(2)非肾脏的单一器官/系统功能衰竭且血肌酐<1.5 mg/dl且不伴有肝性脑病;(3)单一脑衰竭合并血肌酐<1.5 mg/dl。ACLF 1级:(1)单一肾衰竭;(2)非肾脏的单一器官/系统功能衰竭合并血肌酐为1.5~1.9 mg/dl,伴或不伴Ⅰ/Ⅱ级肝性脑病;(3)单一脑衰竭(Ⅲ/Ⅳ级肝性脑病)合并血肌酐为 1.5~1.9 mg/dl。ACLF 2 级:2个器官/系统功能衰竭。ACLF 3级:≥3个器官/系统功能衰竭。ACLF 1~3级患者的28 d死亡率分别为22%、32%、76%[1]。值得注意的是,EASL发布的ACLF诊断标准中的慢性肝病特指肝硬化,并且血清TBil≥12 mg/dl是诊断肝衰竭的唯一指标,对凝血系统功能衰竭(INR>2.5或血小板计数≤20×103/μL)的定义也更为严苛。同时考虑了肝内、外诱因,将细菌感染、消化道出血视为ACLF最主要的诱发因素。EASL发布的ACLF诊断标准是ACLF研究领域首个基于循证医学证据制定的诊断标准,但由于该研究纳入的慢性肝病人群主要为酒精性、HCV感染相关的肝硬化患者,对其他病因所致的肝病人群的适用性尚存疑问。近期,中国、印度及新加坡等国家学者发表的相关研究成果证实EASL发布的ACLF诊断标准也能较好地预测其他病因所致的肝病人群短期死亡率[10-14]。
1.3 NACSELD发布的ACLF诊断标准 NACSELD通过对北美8个肝病中心的感染相关肝硬化住院患者进行调查,发现细菌或真菌感染极大地增加了肝硬化患者的并发症发生风险及死亡风险,并使其最终走上肝移植的道路[15]。鉴于既往无感染相关的ACLF(I-ACLF)的诊断标准,为了改善患者预后和医疗资源分配,NACSELD制定了一个简单、易操作的诊断标准。NACSELD在18个肝病中心对因感染而住院的肝硬化患者进行了一项前瞻性研究[16],将I-ACLF定义为在肝硬化基础上并发感染且出现≥2个器官/系统(循环系统、脑、肾脏、呼吸系统)功能衰竭。各器官/系统功能衰竭的判断标准依次为休克(循环系统)、Ⅲ/Ⅳ级肝性脑病(脑)、需要接受肾脏替代治疗(肾脏)、需要机械通气设备支持(呼吸系统)。NACSELD开展的研究发现,I-ACLF患者的生存率与肝外功能衰竭的器官/系统数量密切相关,有1、2、3、4个器官/系统功能衰竭的I-ACLF患者,30 d生存率分别为72.6%、51.3%、36%、23%。一项纳入1 079例感染相关肝硬化患者和1 596例非感染相关肝硬化患者的多中心前瞻性研究结果表明,NACSELD发布的ACLF诊断标准对未合并感染的肝硬化住院患者同样适用[17]。一项美国的全国性队列研究也验证了NACSELD发布的ACLF诊断标准在预测失代偿性肝硬化患者短期生存率方面的表现较为出色,运用此诊断标准可以筛选出亟须肝移植的患者[18]。由于NACSELD开展的研究中研究对象主要为酒精性和HCV相关的肝硬化患者,且NACSELD发布的ACLF诊断标准中提及的器官/系统功能衰竭也并不包括肝衰竭和凝血系统功能衰竭,故较少有学者将NACSELD发布的ACLF诊断标准应用于中国肝病人群相关研究。近期,中国学者通过比较EASL与NACSELD发布的ACLF诊断标准在预测肝硬化患者预后中的表现,发现NACSELD发布的ACLF诊断标准在预测肝硬化患者短期死亡率方面的准确性较高,但灵敏度较低[13]。
1.4 日本的ACLF诊断标准 日本的一项全国性调查结果显示[19],日本肝硬化患者的主要病因是丙型病毒性肝炎(占60.9%),日本肝硬化患者的临床特征可能与欧洲和美国肝硬化患者相似,与中国、印度等亚洲国家的肝硬化患者不同。日本肝病人群ACLF的急性诱发因素主要为酗酒,与欧美肝病人群又存在一定差异。为了建立适用于日本肝病人群的ACLF诊断标准,日本难治性肝病研究小组基于APASL、EASL及中华医学会(CMA)提出的ACLF诊断标准进行了一项多中心回顾性研究,于2018年发布了日本的ACLF诊断标准:肝硬化患者且Child-Pugh评分为5~9分,在急性打击下28 d内出现严重肝功能恶化(血清TBil≥5.0 mg/dl,PTA≤40%或INR≥1.5)[11,20]。对于ACLF严重程度的评估,日本难治性肝病研究小组认为采用APASL、CMA制定的标准不能实现对ACLF的严重程度分级,因此推荐参考CLIF-SOFA评分系统,根据6个器官/系统功能衰竭情况评估ACLF的严重程度。日本一项全国性研究对本土ACLF诊断标准进行了验证,发现在该标准下日本ACLF的患病率为37%,无肝移植生存率为48%,并指出该诊断标准有助于识别遭受急性打击后预后不良的肝硬化患者[21]。由于日本ACLF诊断标准的颁发时间较晚,且有待在更多的大型前瞻性队列研究中验证,故目前国际上较少使用。
1.5 中国的ACLF诊断标准 CMA在2006年版《肝衰竭诊治指南》中首次提出ACLF这一概念,指南发布以来先后经过了两次(2012、2018年)修订[22-24]。(1)ACLF定义:在慢性肝病基础上,由各种诱因引起以急性黄疸加深(血清TBil≥10倍基线值,或每天上升≥17.1 μmol/L)和凝血功能障碍(PTA≤40%或INR≥1.5)为肝衰竭主要表现的综合征,可合并肝性脑病、腹腔积液、感染、肝肾综合征等并发症。(2)分期方法:为了反映疾病的严重程度,2006年版指南将ACLF分为早期、中期、晚期。国内的一项研究也表明,此分期方法可用于区分不同阶段的ACLF患者,利用此分期方法可更好地预测ACLF患者的90 d死亡率并筛选优先级肝移植患者[25]。2012年版指南在2006年版指南的基础上提出了ACLF前期这一概念,2018版指南进一步将ACLF前期定义为出现严重消化道症状,黄疸加深(血清TBil为85.5~171.0 μmol/L),有出血倾向(40%<PTA≤50%或INR<1.5)。但是也有学者认为,在此定义下,HBV相关的ACLF前期患者检出率较低,不适用于中国临床实践[26]。中国慢加急性肝衰竭联盟计划在中国14家三级甲等医院开展前瞻性队列研究对这一概念进行验证[27]。此外,2018年版指南在各分期的定义中加入了肝外器官/系统功能衰竭情况。(3)分型:基于2014年世界胃肠病组织(WGO)提出的ACLF的分型[28],2018年版指南根据不同慢性肝病基础将ACLF分为3型:A型,在慢性非肝硬化肝病基础上发生的ACLF;B型,在代偿期肝硬化基础上发生的ACLF(通常在4周内发生);C型,在失代偿期肝硬化基础上发生的ACLF。穆秀颖等[29]的研究结果表明,3型患者的临床特点、预后,以及影响其预后的危险因素均有差异,A、B、C型ACLF患者的28 d死亡率分别为22.2%、27.1%、37.6%,影响A、B型ACLF患者预后的独立因素包括反映肝脏坏死的实验室指标水平和并发症发生情况,影响C型ACLF患者预后的独立因素仅限于并发症发生情况。因此,基于不同慢性肝病基础对ACLF进行分型,有利于对患者进行管理和诊治,适用于中国HBV感染相关的ACLF(HBV-ACLF)患者。2020年,徐曼曼等[30]提出一种新的ACLF动态转归分型,根据ACLF的病情发展过程,将其分为快速进展型、快速恢复型、缓慢进展型、缓慢恢复型、缓慢持续型,使用此动态分型方法不仅可以区分出不良预后患者肝移植的紧迫性,还可以区分生存患者恢复时间的长短,有利于医务人员更好地制定分级诊疗策略及院外随访计划。
考虑到中国为HBV感染高发地区,为了制定HBV-ACLF的诊断标准,中国重症乙型肝炎研究小组(COSSH)在中国13家三级甲等医院开展了一项前瞻性队列研究[31]。研究发现,HBV再激活是诱发HBVACLF的常见潜在事件,HBV-ACLF患者的短期死亡率(肝硬化52.1%、非肝硬化60.2%)明显高于非HBVACLF患者(28.0%)。COSSH将HBV-ACLF定义为一种与HBV感染相关的使慢性肝病患者(无论是否存在肝硬化)具有短期高死亡率的复杂综合征,其特征是肝功能急剧恶化和多器官/系统功能衰竭;并指出HBV相关慢性肝病患者,只要满足血清TBil≥12 mg/dl和INR≥1.5均应被诊断为ACLF。与EASL发布的ACLF分级标准相似,COSSH也根据肝脏及肝外器官/系统功能衰竭情况,将ACLF分为3级。ACLF 1级:(1)单一肾衰竭(血肌酐≥2 mg/dl);(2)单一肝衰竭伴INR≥1.5或肾损伤(血肌酐为1.5~1.9 mg/dl)或Ⅰ/Ⅱ级肝性脑病;(3)单一器官/系统(凝血系统、呼吸系统、循环系统)功能衰竭伴肾损伤或Ⅰ/Ⅱ级肝性脑病;(4)单一脑衰竭伴肾损伤。ACLF 2级:2个器官/系统(肝脏、凝血系统、肾脏、呼吸系统、循环系统、脑)功能衰竭。ACLF 3级:≥3个器官/系统功能衰竭。ACLF 1~3级患者的28 d死亡率分别为21%、61%、93%。与EASL发布的诊断标准相比,COSSH发布的诊断标准将凝血功能障碍定义为INR≥1.5(与APASL发布的诊断标准一致),将适用人群扩大至未发生肝硬化的患者,这一新标准的运用使ACLF的诊出率增加了近20%,使更多的患者拥有了早期接受治疗的机会,有助于降低ACLF患者的死亡率[31]。COSSH还开发了可用于HBV-ACLF患者预后预测的评分系统——COSSH评分,该评分系统纳入了年龄、肝性脑病等级等指标,与其他经典评分相比,COSSH评分可以帮助医务人员更好地预测中国HBV-ACLF患者的短期预后[32]。
2 ACLF诊断标准比较
2.1 东西方ACLF诊断标准的主要差异 目前,各个国家(地区)采用的ACLF诊断标准大相径庭,主要原因是各个国家(地区)慢性肝病人群的病因不同。欧美(西方)人群慢性肝病的病因主要以酒精性肝病为主,ACLF的主要临床特征为全身多器官/系统功能衰竭,肾脏衰竭较早出现;在中国及大部分亚洲国家(东方),慢性肝病人群的病因以病毒性肝炎为主,ACLF患者早期以肝衰竭(黄疸、凝血功能障碍、腹腔积液、肝性脑病)为主要临床表现,仅在疾病晚期才出现其他器官/系统功能损伤或衰竭。东西方ACLF诊断标准的不同之处主要体现在以下5方面:(1)制定ACLF诊断标准的目的。东方制定ACLF诊断标准的目的主要是为了早期识别ACLF患者,及时对其进行干预,进而最大限度地预防其发展为多器官/系统功能衰竭患者;而西方制定ACLF诊断标准的目的则主要是为了筛选出亟须肝移植的患者,优化医疗资源分配。(2)对慢性肝病基础的界定。APASL发布的ACLF诊断标准适用人群不包括既往发生过肝硬化失代偿的患者,EASL与NACSELD发布的ACLF诊断标准则仅适用于肝硬化患者,CMA发布的ACLF诊断标准既适用于肝硬化患者又适用于非肝硬化患者。(3)对急性诱发因素的界定。ACLF的急性诱发因素主要包括肝内与肝外因素。由于东方人群慢性肝病的发生主要与嗜肝病毒感染有关,急性诱发因素多为肝内因素,如病毒的再激活、病毒重叠感染、酒精、药物等,欧美则认为感染、酗酒、消化道出血等肝外因素为ACLF的主要诱发因素。(4)对器官/系统功能衰竭的界定。各诊断标准对TBil水平、凝血系统功能衰竭等的定义不同。另外,EASL将肾衰竭定义为血肌酐≥2 mg/dl,将肾功能损害定义为血肌酐为1.5~1.9 mg/dl,NACSELD将肾衰竭界定为需要接受肾脏替代治疗;对于呼吸及循环衰竭,CMA与AARC均认为其是ACLF的晚期并发症,故未将其列入诊断标准内容。(5)对ACLF严重程度的评估。基于不同的肝病人群提出不同的预后评估模型[1,5,16,24,31],见表1。
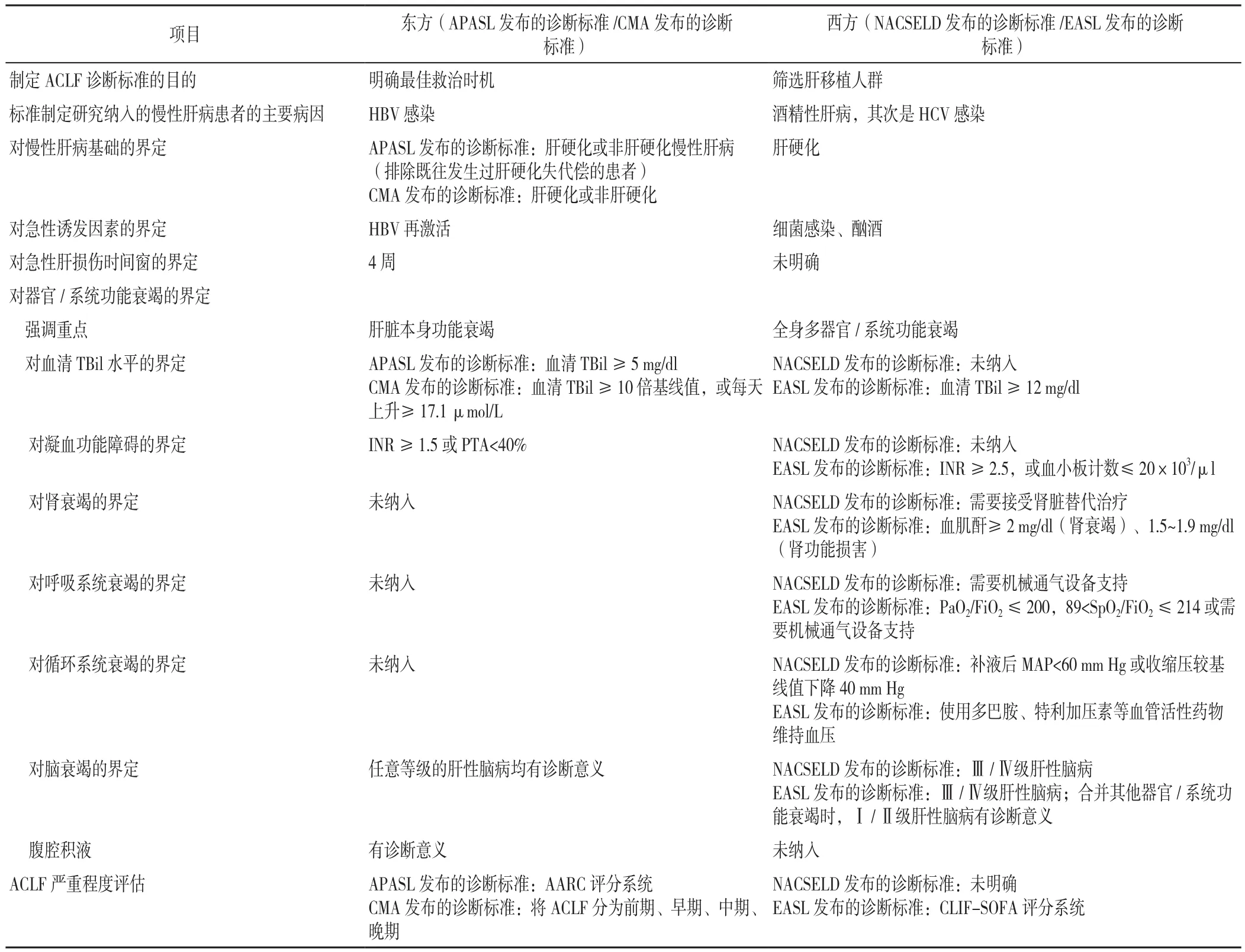
表1 东西方ACLF诊断标准的比较Table 1 Differences between eastern and western diagnostic criteria of ACLF
鉴于东西方对ACLF定义及诊断标准未达成一致,为了更好地定义ACLF,2014年WGO通过整合东西方对ACLF的定义[28],初步将ACLF定义为慢性肝病患者(有或无先前诊断的肝硬化)在急性打击下,出现急性肝功能失代偿、肝功能衰竭(表现为黄疸和INR延长),伴≥1个肝外器官/系统功能衰竭,导致从发病起28 d内,或至多3个月内病死率增加的一组临床综合征。WGO还推荐根据不同慢性肝病基础将ACLF分为A、B、C 3种类型,A型是在以慢性肝炎为代表的非肝硬化慢性肝病基础上发生的ACLF,B型为在代偿期肝硬化基础上发生的ACLF,C型为在失代偿期肝硬化基础上发生的ACLF。穆秀颖等[29]的研究结果表明,该分型方法的运用有助于中国医务人员对HBV-ACLF患者进行管理和诊治。遗憾的是,WGO给出的ACLF诊断标准不够具体、细化,如慢性肝病、急性诱发事件、器官/系统功能衰竭等的定义均不确切。但值得注意的是,WGO针对ACLF的定义,提出了以下建议:(1)应与急性肝衰竭(ALF)相区分;(2)应与失代偿性肝硬化相区分;(3)应对ACLF病理生理学进行定义;(4)应利用明确的临床体征和实验室或其他检查指标来确认诊断并排除其他疾病;(5)应开发一个有效的临床评分系统来评估ACLF的严重程度。期待通过全球性、前瞻性的队列研究实现此定义的开发,最终使其能够适用于世界各地。
2.2 ACLF诊断标准在预测ACLF患者预后方面的表现比较 印度一项研究发现,与EASL发布的诊断标准下的ACLF患者相比,APASL发布的诊断标准下的ACLF患者生存率更高;而在EASL发布的诊断标准下,ACLF患者器官/系统功能衰竭情况与短期高死亡率的关系更加明显[10]。DHIMAN等[33]的研究发现,EASL发布的诊断标准下的ACLF患者28、90 d死亡率明显高于非ACLF患者,而APASL发布的诊断标准下的ACLF患者与非ACLF患者28 d死亡率差异不大,其原因可能是APASL发布的ACLF诊断标准未涉及非肝器官/系统功能衰竭或非肝损伤,因此不能帮助临床医生识别仅有肝外器官/系统功能衰竭且具有高死亡风险的患者。新加坡一项研究结果表明,与EASL发布的诊断标准下的ACLF患者相比,符合APASL发布的诊断标准的ACLF患者90 d生存率更高,这主要是由于在EASL发布的诊断标准下,ACLF均由肝硬化发展而来,而APASL还关注到尚未发生肝硬化的慢性肝病患者[12]。美国一项大型研究证实,与NACSEID发布的诊断标准相比,EASL发布的诊断标准在ACLF患者识别方面具有更高的灵敏度,在预测ACLF患者30 d死亡率方面具有更好的表现,且EASL发布的诊断标准下的ACLF 3级患者的死亡率与NACSEID发布的诊断标准下的ACLF患者死亡率相似[14]。LEÃO 等[34]通过比较 EASL、NACSELD和APASL发布的诊断标准在预测ACLF患者死亡率方面的表现,发现与NACSELD和APASL发布的诊断标准相比,EASL发布的诊断标准在预测ACLF患者28、90 d的死亡率方面具有更好的性能。中国学者CAO等[13]通过比较EASL与NACSELD发布的诊断标准在预测ACLF患者预后中的表现,发现在预测ACLF患者7 d死亡率方面,NACSELD发布的诊断标准优于EASL发布的诊断标准,而在预测ACLF患者28、90 d死亡率方面,EASL发布的诊断标准优于NACSELD发布的诊断标准;并且CAO等[13]提出可以将NACSELD发布的诊断标准用于快速识别入院后死亡风险较高的肝硬化患者,即对于符合NACSELD发布的诊断标准的ACLF患者,可考虑将其收治入重症监护室(ICU)并对其进行密切监护,或对其进行姑息治疗;对于不符合NACSELD发布的诊断标准的肝硬化患者,可进一步使用EASL发布的ACLF诊断标准对其进行风险评估,若其符合EASL发布的ACLF诊断标准,可建议其早期接受肝移植治疗,以降低其死亡率。
通过对EASL、NACSELD及APASL发布的诊断标准用于预测中国ACLF患者28、90 d死亡率方面的相关研究进行回顾[13,31,35-38],发现三大国际诊断标准在中国肝病人群相关研究中得到了广泛使用,而国外基于CMA及COSSH发布的ACLF诊断标准开展的研究较少。日本一项全国性研究结果表明[11],血清TBil≥10 mg/dl的 ACLF 患者的预后情况与血清 TBil为 5~10 mg/dl的ACLF患者相比无明显差异,APASL发布的诊断标准更适用于早期识别日本的ACLF患者,而EASL发布的诊断标准可用于评估ACLF患者的病情严重程度。中国学者通过利用COSSH与EASL发布的诊断标准预测伴或不伴肝硬化的ACLF患者的预后[31],发现无论对于伴肝硬化的ACLF患者,还是不伴肝硬化的ACLF患者,EASL发布的诊断标准均能帮助医务人员早期识别ACLF,而COSSH发布的诊断标准则能帮助医务人员更好地预测不伴肝硬化的ACLF患者的预后。基于上述国内外相关队列研究的回顾,本研究发现APASL发布的诊断标准可用于早期识别ACLF患者,COSSH、EASL、NACSELD发布的诊断标准在预测ACLF患者器官/系统功能衰竭情况与短期高死亡率方面表现较好,可用于早期筛选出病情危重、需要接受重症监护或者肝移植治疗的ACLF患者。不难发现,在同一研究人群中,不同ACLF诊断标准下的ACLF患者死亡率差异较大,即使是在相同的ACLF诊断标准下,不同研究队列中的ACLF患者预后情况亦存在明显的差异(表2)。因此,在临床实际工作中,临床医生在识别ACLF患者时,需要综合考虑后,再决定选用何种诊断标准。在筛选高危患者及亟须肝移植的患者时,可参照美国胃肠病学院新版指南的建议,通过CLIF-SOFA或NACSELD器官功能衰竭评分评估病情的严重程度[39];可采用COSSH评分评估HBV-ACLF患者病情的严重程度,使需要接受重症监护或者肝移植治疗的ACLF患者尽早受益。
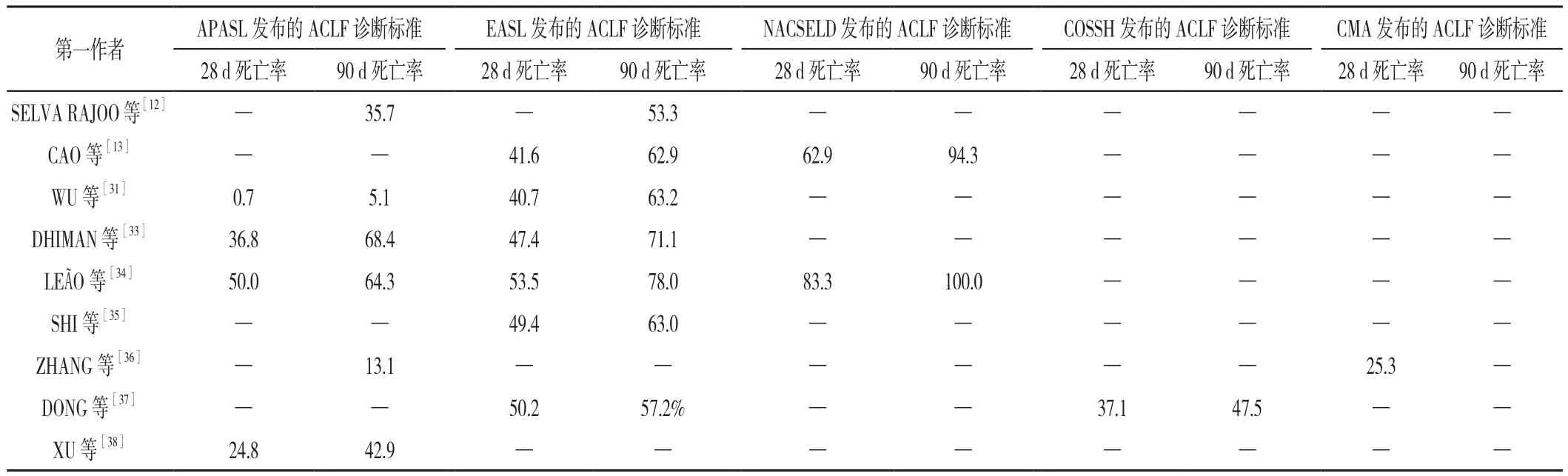
表2 五种ACLF诊断标准下ACLF患者的预后预测情况(%)Table 2 The performance of five diagnostic criteria for ACLF in the prediction of prognosis in ACLF patients
3 小结
ACLF是发生在慢性肝病伴或不伴肝硬化患者中的一种潜在可逆性疾病,在未及时得到基础肝病治疗、肝脏支持治疗或者肝移植治疗的情况下,可能会导致患者出现多器官/系统功能衰竭、在3个月内死亡[39]。目前全球尚无公认的ACLF诊断标准,国内外ACLF的诊断标准存在着较大差异,临床医生在实际工作中选用何种ACLF诊断标准应根据患者慢性肝病的病因、临床特征等因素综合考虑。临床医生要尽可能地早期识别ACLF患者,并在评估患者病情严重程度的基础上,优化一般内科治疗,并审慎地做出将其收治入ICU、对其进行姑息治疗/肝移植治疗等临床决策。同时,应加强地区间的合作,针对不同病因的ACLF开展全球性的研究。建立全球统一的ACLF诊断标准也是各国研究者未来共同致力于实现的目标。由于全球慢性肝病流行病学正在发生改变[40],下一步应该针对不同病因的ACLF患者,在中国人群中开展多中心前瞻性研究,进一步完善与ACLF定义与诊断相关的要素(病因、急性诱发因素、临床特征等)的循证医学证据链,进而为建立全球统一的ACLF诊断标准提供更多的中国智慧。
作者贡献:王霞负责文献/资料的收集、整理及论文撰写;杨晋辉负责文章质量和审校;郑梦瑶、江婷、徐智媛负责论文的修改;马红琳协助整理文献/资料。
本文无利益冲突。

