生物活性导向分离山楂炭中止血活性成分及其作用机制研究
田 瑞 ,王峥涛,谢 燕*
1.上海中医药大学中药研究所,上海 201203
2.上海中医药大学公共健康学院,上海 201203
山楂为蔷薇科植物山楂Crataegus pinnatifidaBge.或山里红C.pinnatifidaBge.var.majorN.E.Br.的干燥成熟果实[1],含有丰富的黄酮类、有机酸类、萜类、多糖类等化学成分[2],味酸性温,具有健脾胃、助消化、通畅血脉、行气散瘀的功效[3-4],可用于肉食积滞、心血管疾病、疝气、胸痹,妇女产后瘀阻腹痛、痛经等疾病的治疗[5]。山楂炭为临床常用的山楂炮制品,是将山楂饮片经武火炮制成表面焦黑色、内部焦褐色而得。山楂在炮制成山楂炭后,其性味转为苦涩,收敛能力增强,由山楂通畅血脉、消散瘀滞的活血作用转变为偏于收涩的止血作用,常被用于肠风下血等症状。现代研究发现,山楂炭能够较好地治疗慢性结肠炎、溃疡性结肠炎、结直肠癌便血等疾病[6]。目前,采用HPLC、紫外分光光度法等对山楂炮制前后的化学成分分析发现,山楂制炭后其黄酮类、有机酸类、鞣质类成分均大幅降低,钙离子含量有所增加,这可能与山楂炭产生止血作用有关[7-9],但其发挥止血作用的活性成分仍不明晰,还需进一步探究。
以活性评价为导向进行化学成分分离是发现并确定中药中化学活性成分的一种有效方法,即在化学成分的分离纯化过程中,通过药效实验定位中药活性成分所在部位或流分,并有针对性地对所确定的活性部位或流分进行分离纯化,最终获得中药化学活性成分[10]。这极大地提高了活性成分的分离效率,许多结构明确的中药药效成分都是通过该方法获得[11-12],如临床应用广泛的抗疟药物青蒿素、具有广谱抗肿瘤作用的喜树碱等[13]。因此,本研究以止血活性为导向,采用体内外止血药效实验与化学成分分离技术相结合的方法,从山楂炭中分离纯化得到发挥止血作用的活性成分,并对其进行结构鉴定,初步探讨其作用机制,为山楂炭的临床合理用药、质量控制等提供理论参考和依据。
1 材料
1.1 动物
SPF 级雄性SD 大鼠(体质量300~350 g,合格证号20180006030200)、雌性及雄性ICR 小鼠(体质量18~22 g,合格证号20180006021172)均购自上海西普尔-必凯实验动物有限公司,许可证号SCXK(沪)2018-0006。动物在上海中医药大学动物实验中心标准条件下饲养,自由进食饮水。动物实验经上海中医药大学伦理委员会批准(批准号PZSHUTCM200522002)。
1.2 药材
山楂购自上海康桥中药饮片有限公司,经上海中医药大学吴立宏教授鉴定为蔷薇科植物山楂C.pinnatifidaBge.的干燥成熟果实,按《上海市中药饮片炮制规范》2018 年版炮制成山楂炭。
1.3 药品与试剂
云南白药胶囊(批号ZFA2116)购自云南白药集团股份有限公司;芦丁对照品(批号20160527,质量分数为95%)购自陕西绿清生物工程有限公司;金丝桃苷对照品(批号C5-1007,质量分数为98%)购自上海中药标准化研究中心;绿原酸(批号110753-201716,质量分数为99.3%)、槲皮素对照品(批号100081-200907,质量分数为97.40%)购自中国食品药品检定研究院;柱层析硅胶购自青岛海洋化工有限公司;Sephadex LH-20 购自美国GE 公司;活化部分凝血活酶时间(activated partial thromboplastin time,APTT)试剂盒(批号562633)、凝血酶原时间(prothrombin time,PT)试剂盒(批号565764)、凝血酶时间(thrombin time,TT)试剂盒(批号50728)、纤维蛋白原(fibrinogen,FIB)试剂盒(批号565087)购自日本希森美康株式会社;二磷酸腺苷(adenosine diphosphate,ADP,批号S30GR162961)购自上海源叶生物科技有限公司;羧甲基纤维素钠(carboxymethylcellulose sodium,CMC-Na)、乙醇、石油醚、醋酸乙酯、正丁醇等购自国药集团化学试剂有限公司,均为分析纯;磷酸(HPLC 级)购自CNW 公司;甲醇、乙腈(HPLC级)购自美国Thermo Fisher Scientific 公司。
1.4 仪器
1260II 型高效液相色谱仪(美国Agilent 公司);Ultrashield™ 400 Plus 400M 核磁共振波谱仪(瑞士Bruker 公司);CS-5100 型全自动凝血仪(日本希森美康株式会社);AggRAM 型血小板聚集仪(美国Helena 公司);LC-3000 型半制备高效液相色谱仪(北京创新通恒科技有限公司)。
2 方法
2.1 HPLC 分析
2.1.1 对照品溶液的制备 称取绿原酸、芦丁、金丝桃苷、槲皮素对照品适量,置于10 mL 量瓶中,用少量甲醇溶解后,稀释至刻度,混匀,即得。
2.1.2 供试品溶液的制备 精密称取生山楂及山楂炭细粉各1 g,分别置于具塞量瓶中,加入70%甲醇20 mL,称定质量,超声处理30 min,放冷,补足质量,取上清液,13 000 r/min 离心10 min,取上清液,0.22 μm 微孔滤膜滤过,即得。
2.1.3 色谱条件 Kromasil 100-5 C18色谱柱(250 mm×4.6 mm,5 μm),流动相为0.2%磷酸水溶液(A)-乙腈(B),梯度洗脱:0~20 min,9% B;20~30 min,9%~17% B;30~45 min,17% B;45~55 min,17%~30% B;55~60 min,30%~42% B;60~80 min,42% B。检测波长350 nm;进样量10 µL;柱温30 ℃;体积流量1 mL/min。
2.2 小鼠体内止血时间及凝血时间测定
2.2.1 样品溶液的制备
(1)生山楂、山楂炭、活性炭水煎液的制备:分别称取生山楂、山楂炭、活性炭粗粉各30 g,加水300 mL,浸泡30 min 后,煎煮1 h,滤过;第2次加水200 mL,煎煮30 min,滤过,将2 次所得滤液合并,减压浓缩至每毫升相当于原药材60 mg,即得。
(2)山楂炭醇提液的制备:称取山楂炭粗粉30 g,加入75%乙醇300 mL 加热回流提取3 次,每次2 h,趁热滤过,合并3 次所得滤液,减压浓缩至每毫升相当于原药材60 mg,无醇味。
2.2.2 动物分组及给药 ICR 小鼠60 只随机分为空白组、云南白药(0.375 g/kg)组、活性炭水煎液(3.0 g/kg)组、生山楂水煎液(3.0 g/kg)组、山楂炭水煎液(3.0 g/kg)组和山楂炭醇提液(3.0 g/kg)组,每组10 只,雌雄各半。动物适应性饲养3 d 后,空白组ig 纯水,各给药组ig 相应药物,1 次/d,连续7 d。
2.2.3 小鼠止血时间测定 末次给药后1 h,采用剪尾法测定各组小鼠止血时间。小鼠麻醉后,于距鼠尾5 mm 处剪断,观察小鼠尾部出血情况,待血液自行溢出时开始计时,每隔15 s 用滤纸吸附1 次,直至没有血液流出(滤纸吸附时无血迹),停止计时,即为止血时间。
2.2.4 小鼠凝血时间测定 末次给药后1 h,采用毛细管法测定小鼠凝血时间。小鼠麻醉后,用毛细管(长10 cm,内径1 mm)在小鼠眼球后静脉丛取血,自血液进入毛细管时开始计时,每隔15 s 折断毛细管约0.5 cm,缓慢向左右拉开,观察折断处是否出现血凝丝,当出现血凝丝时,立即在另一端折断验证,至两端均出现血凝丝时停止计时,即为凝血时间。
2.3 山楂炭不同极性部位的分离
称取山楂炭粗粉1 kg,加入75%乙醇10 L 加热回流提取3 次,每次2 h,趁热滤过,合并3 次所得滤液,减压浓缩至500 mL,取50 mL 水浴蒸干后,减压干燥,得山楂炭醇提物(21.15 g),保存在干燥器内备用。取剩余450 mL 山楂炭醇提液,依次用等量的石油醚、醋酸乙酯、水饱和正丁醇萃取5 次。将得到的石油醚、醋酸乙酯、水饱和正丁醇萃取液及水溶液减压浓缩,水浴蒸干后,真空干燥至恒定质量,得石油醚部位(9.72 g)、醋酸乙酯部位(31.14 g)、正丁醇部位(26.73 g)、水部位(130.14 g)。
2.4 山楂炭不同极性部位对小鼠体内止血时间及凝血时间的影响
2.4.1 动物分组及给药 ICR 小鼠70 只随机分为空白组、云南白药(0.375 g/kg)组、山楂炭醇提物(3.0 g/kg,以生药量计)组、石油醚部位(3.0 g/kg,以生药量计)组、醋酸乙酯部位(3.0 g/kg,以生药量计)组、正丁醇部位(3.0 g/kg,以生药量计)组和水部位组(3.0 g/kg,以生药量计),每组10 只,雌雄各半。动物适应性饲养3 d 后,空白组ig 0.5%CMC-Na 溶液,各给药组ig 相应药物,1 次/d,连续7 d。
2.4.2 小鼠止血时间及凝血时间测定 按照“2.2.3”及“2.2.4”项下方法进行小鼠止血时间及凝血时间的测定。
2.5 山楂炭止血作用化学物质的分离及鉴定
取“2.3”项下所得醋酸乙酯部位进行硅胶柱色谱分离,以石油醚-醋酸乙酯为洗脱剂进行梯度洗脱(4∶1、2∶1、1∶1、1∶2、1∶4),将所得流分进行薄层鉴别,合并相同流分,得到21 个流分(Fr.1~21)。
将Fr.1~21 减压干燥后取适量,用含50%乙醇生理盐水溶解,0.22 μm 微孔滤膜滤过,配制成每毫升相当于生药0.3 g 的供试药液。以含50%乙醇生理盐水为空白对照,采用试管法[14]考察各流分对大鼠体外全血凝固时间的影响。取雄性SD 大鼠,麻醉后,采用一次性真空采血管(0.109 mol/L 枸橼酸钠)进行腹主动脉取血,得抗凝全血。取0.1 mL 供试药物和0.5 mL 抗凝全血加入至洁净玻璃试管中,平行6 份,混匀,37 ℃水浴中孵育1 min,再向试管内加入0.1 mL 相同温度的0.025 mol/L CaCl2溶液,混匀,立即计时,每隔15 s 倾斜试管1 次。当倾斜试管时血液凝固在底部无法流动,停止计时,即为体外全血凝固时间。
将上述所得具有止血活性的流分采用Sephadex LH-20 及半制备HPLC 进行分离纯化,得到山楂炭中发挥止血作用的化合物,并结合核磁共振波谱的结果对其进行结构鉴定。
2.6 体外凝血四项及血小板聚集率测定方法
称取松柏醛20 mg,加2 mL 甲醇使溶解,得松柏醛的甲醇溶液(10 mg/mL),分别吸取50、100、200 μL,除去甲醇后,加入2 mL 生理盐水,超声溶解,将松柏醛配制成质量浓度为0.25、0.5、1.0 mg/mL 的溶液,即为松柏醛低、中、高质量浓度组。
取雄性SD 大鼠,麻醉后,用一次性真空采血管(0.109 mol/L 枸橼酸钠)进行腹主动脉取血,得抗凝全血,3000 r/min 离心10 min,取上层抗凝血浆。将供试药液与抗凝血浆按1∶4 的比例混匀,37 ℃孵育3 min 后,置于一次性样品杯中,用全自动凝血分析仪对其APTT、PT、TT、FIB 进行测定,以生理盐水为空白对照,每组平行6 份。
取雄性SD 大鼠,麻醉后,用一次性真空采血管(0.109 mol/L 枸橼酸钠)进行腹主动脉取血,将所得抗凝全血1000 r/min 离心10 min,取上层富血小板血浆(PRP);将剩余全血3000 r/min 离心10 min,取上层贫血小板血浆(PPP);用PPP 稀释调整PRP 中血小板浓度为1.5×108个/mL,备用。吸取供试品10 μL 与稀释后的PRP 215 μL 混合,37 ℃孵育3 min 后,加入25 μL 浓度为10 μmol/L 的ADP激动剂,立即放入血小板聚集仪测试,记录聚集曲线,得血小板聚集率。每组平行6 份。
2.7 统计学分析
3 结果
3.1 山楂及山楂炭HPLC 图谱对比
如图1 所示,山楂在炮制成山楂炭后,极性较大成分的含量降低,而小极性成分的含量有所增加。山楂中原本含量较高的成分如绿原酸、金丝桃苷等显著降低或消失,这可能与炮制过程中的高温使山楂中一些极性大的成分破坏或降解,生成小极性成分有关。此外,山楂炭的HPLC 图谱在tR=48.5、49.7 min 处出现2 个新的特征峰,表明在炮制过程中山楂中的一些成分可能在高温下发生降解或转化而生成新的成分。
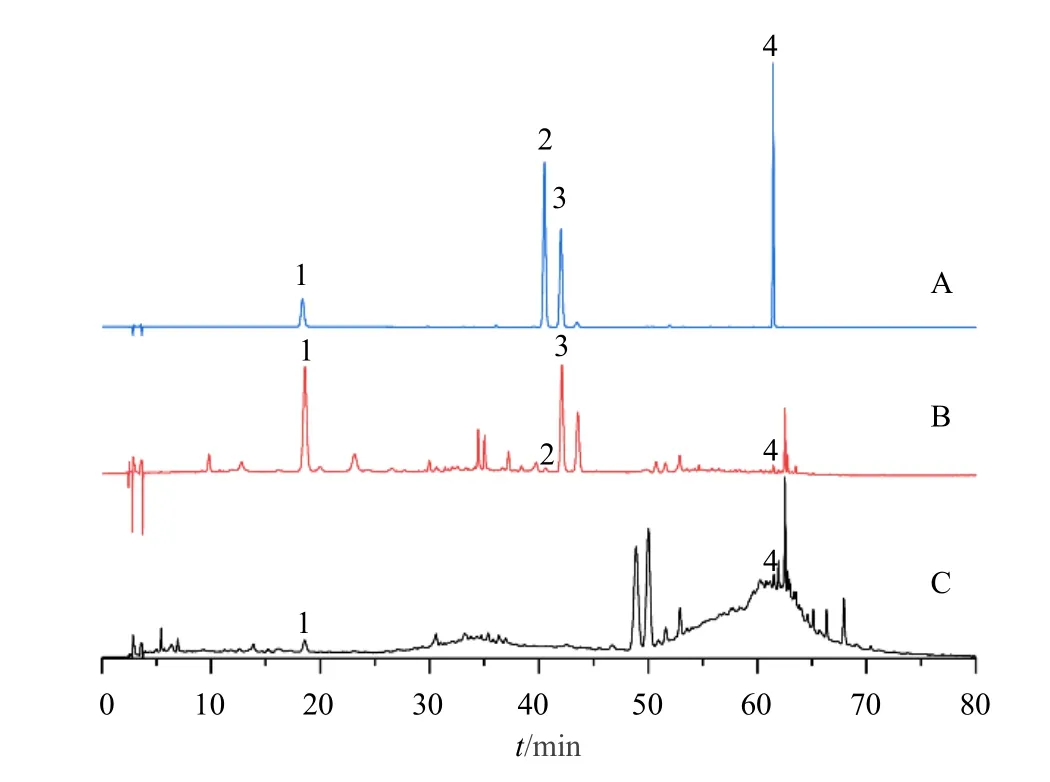
图1 混合对照品 (A)、生山楂 (B) 及山楂炭 (C) 的HPLC图谱Fig.1 HPLC chromatograms of mixed reference substance(A),Crataegi Fructus (B) and hawthorn charcoal (C)
3.2 山楂与山楂炭体内止血及凝血作用比较
如表1 所示,与空白组比较,各给药组的止血时间和凝血时间均有所降低,表明各组均具有一定的促进止血及凝血效果,其中云南白药组、山楂炭水煎液组、山楂炭醇提液组的效果较好,具有显著性差异(P<0.01),山楂炭醇提液组止血作用最强;活性炭水煎液组及生山楂水煎液组的止血作用较弱。山楂炭水煎液组的止血时间及凝血时间较生山楂水煎液组分别缩短了47.88%和41.64%,表明山楂在炮制成山楂炭后,止血作用大幅增加。活性炭组的止血时间及凝血时间均较各山楂炭组长,说明山楂炭的促凝作用可能还与山楂炭中炭素以外的物质有关。山楂炭醇提液组的止血时间及凝血时间均较山楂炭水煎液组进一步降低,表明山楂炭醇提液中的止血活性成分含量较其水煎液中更多。
表1 山楂炭对小鼠止血时间及凝血时间的影响 (,n=10)Table 1 Effect of hawthorn charcoal on bleeding time and coagulation time in mice (,n=10)
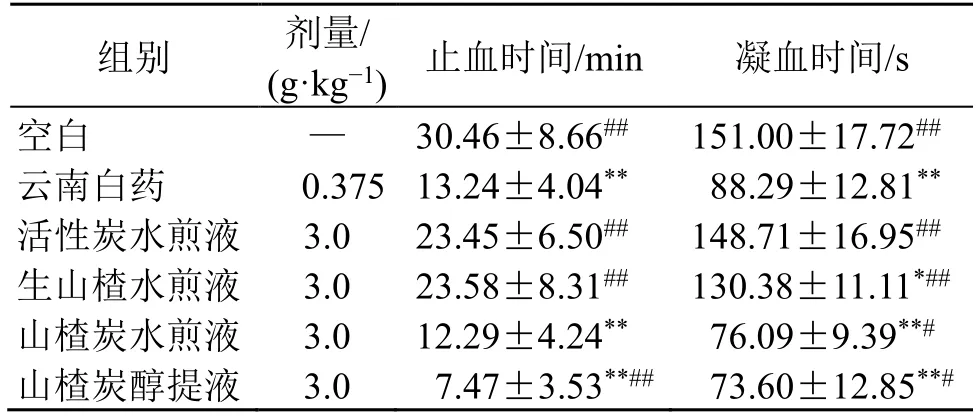
表1 山楂炭对小鼠止血时间及凝血时间的影响 (,n=10)Table 1 Effect of hawthorn charcoal on bleeding time and coagulation time in mice (,n=10)
与空白组比较:*P<0.05 **P<0.01 ***P<0.001;与云南白药组比较:#P<0.05 ##P<0.01,下表同*P < 0.05 **P < 0.01 ***P < 0.001 vs blank group;#P < 0.05 ##P <0.01 vs Yunnan Baiyao group,same as below tables
3.3 山楂炭不同极性部位体内止血及凝血作用评价
如表2 所示,与空白组比较,各实验组止血时间均显著降低(P<0.01),表现出明显的止血作用,其中山楂炭醋酸乙酯部位组止血时间最短,其止血作用最好。与止血时间结果相似,与空白组比较,云南白药组、山楂炭醇提物组、山楂炭石油醚组、山楂炭醋酸乙酯组均能缩短小鼠体内凝血时间(P<0.05、0.01),具有显著的促凝效果;而山楂炭正丁醇部位组及水部位组的凝血时间与空白组接近,未表现出明显的促凝效果。此外,山楂炭醋酸乙酯部位组的小鼠体内止血时间及凝血时间均较云南白药组更短,在4 个极性部位中表现出最好的体内止血作用,说明其为山楂炭发挥体内止血作用的有效部位。
表2 山楂炭不同极性部位对小鼠止血时间和凝血时间的影响 (,n=10)Table 2 Effect of different polar parts of hawthorn charcoal on bleeding time and coagulation time in mice (,n=10)

表2 山楂炭不同极性部位对小鼠止血时间和凝血时间的影响 (,n=10)Table 2 Effect of different polar parts of hawthorn charcoal on bleeding time and coagulation time in mice (,n=10)
3.4 山楂炭醋酸乙酯部位各流分体外凝血作用评价
将收集所得Fr.1~21 进行体外凝血效果考察,如图2 所示。与空白组比较,Fr.2、5、9、15 可降低体外全血凝固时间(P<0.05、0.01),表现出促进凝血的效果,Fr.4、8 可显著延长体外全血凝固时间(P<0.05、0.01),表现出抑制凝血的效果,其余流分对凝血效果影响不明显。其中,Fr.5、15 显示出显著的促进凝血的效果,推测其为山楂炭止血作用的药效流分。

图2 山楂炭醋酸乙酯部位各流分对体外全血凝固时间的影响 (,n=6)Fig.2 Effect of different fractions from ethyl acetate parts of hawthorn charcoal on in vitro whole blood coagulation time(,n=6)
3.5 山楂炭醋酸乙酯部位分离流分的HPLC 图谱
如图3 所示,山楂炒炭后新生成的成分(tR=48.5、49.7 min)分别主要存在于Fr.5 和Fr.8 中,而在Fr.15 中未发现明显的特征峰,结合Fr.5 显著的促进止血作用,推测tR=48.5 min 处的新生成成分可能与山楂炭止血作用有关;而Fr.8 并未表现出止血作用,推测tR=49.7 min 处的新生成成分不具有止血活性,因此,对tR=48.5 min 处的成分进行进一步分离纯化。
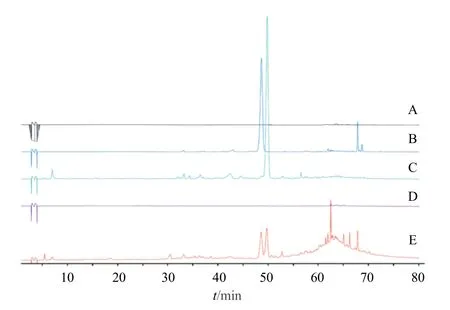
图3 Fr.2 (A)、Fr.5 (B)、Fr.8 (C)、Fr.15 (D) 及山楂炭醋酸乙酯部位 (E) 的HPLC 图谱Fig.3 HPLC chromatograms of Fr.2 (A),Fr.5 (B),Fr.8 (C),Fr.15 (D) and ethyl acetate extract of hawthorn charcoal (E)
3.6 山楂炭止血药效成分的分离及鉴定
对有明显止血作用的Fr.5 进行一系列分离后,得到山楂炭中发挥止血作用的化学物质,即tR=48.5 min 的化学成分,并对其结构进行鉴定。该化合物为淡黄色油状物;m/z177 [M-H]-,分子式为C10H10O3。1H-NMR(CD3OD,400 MHz)δ: 9.58 (1H,d,J=7.8 Hz,H-9),7.56 (1H,d,J=16.0 Hz,H-7),7.16(1H,d,J=8.1 Hz,H-6),6.87 (1H,d,J=8.2 Hz,H-5),6.69 (1H,dd,J=16.0,7.8 Hz,H-8),3.91 (3H,s,3-OCH3);13C-NMR(CD3OD,100 MHz)δ: 126.2 (C-1),110.7 (C-2),150.3 (C-3),148.1 (C-4),115.2 (C-5),123.8 (C-6),154.9 (C-7),125.3 (C-8),194.8 (C-9),55.1(3-OCH3)。根据上述波谱数据,通过与文献报道[15]对比,确定该化合物为松柏醛(图4)。
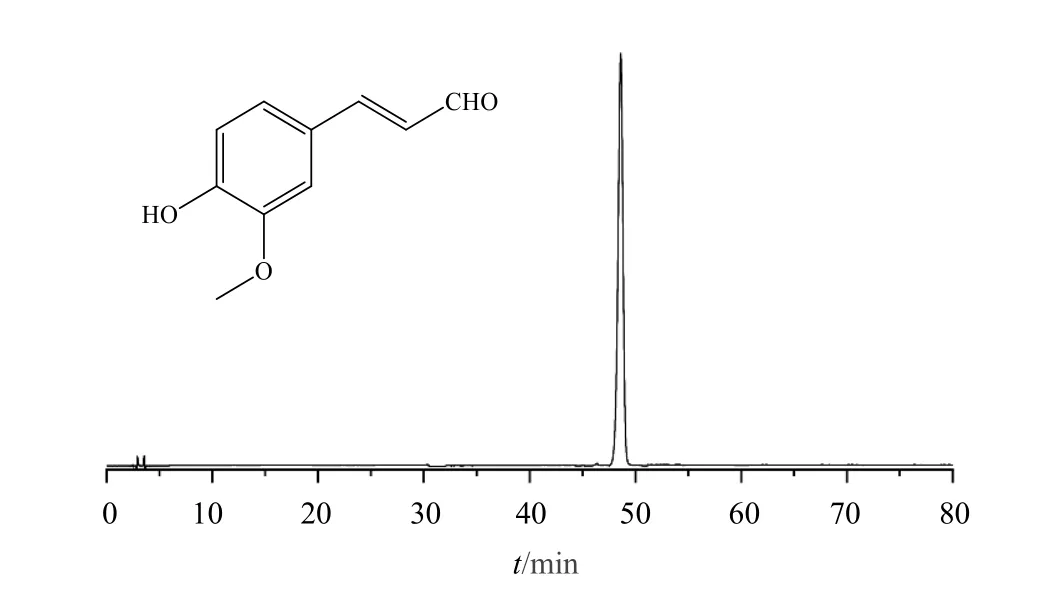
图4 松柏醛的化学结构式及HPLC 图谱Fig.4 Chemical structure and HPLC chromatogram of coniferaldehyde
3.7 松柏醛对体外凝血四项及血小板聚集率的影响
如表3 所示,不同质量浓度的松柏醛作用于血浆后,所测得的APTT 及PT 与对照组比较无明显变化,表明其对外源性及内源性凝血途径无影响;但中、高质量浓度的松柏醛可以显著降低TT(P<0.05、0.001),且与其质量浓度呈正相关,表明松柏醛的凝血作用与其影响共同凝血途径相关;并且松柏醛还能够显著增加FIB 含量(P<0.05、0.001),且呈剂量相关性,表明松柏醛的促凝作用可能与激活纤维蛋白原有关;此外,松柏醛能够显著提高血小板聚集率(P<0.05、0.01),呈剂量相关性,表明松柏醛可以促进血液中血小板的聚集,从而发挥止血作用。
表3 松柏醛对APTT、PT、TT、FIB 及血小板聚集率的影响 (,n=6)Table 3 Effect of coniferaldehyde on APTT,PT,TT,FIB and platelet aggregation rate (,n=6)

表3 松柏醛对APTT、PT、TT、FIB 及血小板聚集率的影响 (,n=6)Table 3 Effect of coniferaldehyde on APTT,PT,TT,FIB and platelet aggregation rate (,n=6)
4 讨论
中药在炮制过程中其化学成分发生较大的改变,这可能是其炮制前后药效发生改变的主要原因。中药在炒炭过程中,其化学成分会发生较大的改变,大量化合物发生裂解、脱水、美拉德等反应,转化为具有止血活性的新成分,从而使炭药具有更好的止血作用,如侧柏[16]、荷叶[17]在炮制成炭药后,其所含黄酮苷受热大部分分解为槲皮素等黄酮苷元类成分,可以显著降低APTT 或PT,发挥止血作用。此外,一些中药在制炭过程中,某些成分在高温下发生改变,转化为新的化学成分,如蒲黄[18]中槲皮素和鼠李糖在炮制过程中转化为新成分huaicarbon A/B,且具有良好的止血活性。生山楂的活性成分主要为黄酮类及有机酸类成分[19],本研究选择黄酮类成分金丝桃苷、芦丁、槲皮素,有机酸类成分绿原酸进行HPLC 图谱考察,结果发现山楂在炮制成山楂炭后其黄酮及有机酸类成分大幅下降,说明山楂炭的止血作用与黄酮及有机酸类成分的相关性不大。但同时发现,与生山楂相比,山楂炭中有新成分生成,且这些成分主要为小极性化合物,可能是生山楂由活血作用转变为止血作用的一大原因。
炭药在炮制过程中产生的炭素(活性炭)具有良好的吸附作用,有助于激活凝血因子及血小板因子,被认为是炭药止血作用的物质基础之一[20]。本研究考察活性炭对小鼠的体内止血作用发现,其能降低小鼠体内止血及凝血时间,但并不具有显著性。而山楂炭及其醋酸乙酯部位均表现出较云南白药组更强的止血作用,因此推测山楂炭中发挥止血作用的物质包括但不限于活性炭(炭素)。并且发现山楂炭醇提液具有更好的止血作用,这可能是由于乙醇回流与常规的水煎煮相比能够有效地提取出山楂炭中的黄酮类、三萜类等小极性化合物[21-22],表明山楂炭中的小极性成分可能与山楂炭止血作用有关。
本研究以生物活性为导向分离药效成分:采用柱色谱分离与药效实验相结合,筛选得到山楂炭的药效部位——醋酸乙酯部位,并对其进一步分离,筛选得到山楂炭止血化学成分所在流分,再根据HPLC 图谱对其中可能的化学成分进行分离纯化,并通过波谱技术进行鉴定,最终得到具有止血活性的苯丙素类化合物松柏醛。结合HPLC 图谱分析,认为松柏醛即为山楂炭HPLC 图谱中tR=48.5 min的新生成成分;松柏醛几乎不存在于生山楂中,但在山楂炭中的含量明显提升,可能是生山楂中的木质素类成分在高温炮制过程中β-O-4 化学键发生断裂而生成[23-24];且松柏醛表现出良好的止血作用。因此,推测松柏醛是山楂炭止血作用的物质基础之一。
凝血四项是目前评价出血性疾病的重要指标,不同的检测项目所反映的凝血作用途径也不同,PT反映血浆中凝血因子II、V、VII 和X 的水平,是临床上反映外源性凝血系统的常用检测方法;APTT能反映血浆凝血因子VIII、IX、XI 和XII 的水平,是内源性凝血系统最常用的筛选试验;TT 主要反映凝血共同途径纤维蛋白原转变为纤维蛋白的过程中,是否存在纤维蛋白原异常、以及是否发生纤溶、存在抗凝物的情况;FIB 是血凝块的重要结构组成,它能反映血液中的纤维蛋白原含量[25]。血小板具有黏附、聚集等生理特性,也是影响凝血的关键因素,当出现血管损伤时,血小板会黏附在受损的血管壁上,使血小板聚集以抑制血液的流出[26]。凝血四项及血小板聚集率的结果显示,松柏醛能够促进血小板的聚集,主要通过激活纤维蛋白原与共同凝血途径发挥凝血作用,而与外源性及内源性凝血途径相关性不大。
综上,本研究确定山楂炭不同极性部位中,醋酸乙酯部位为山楂炭发挥止血作用的药效部位;并以止血活性为导向从山楂炭醋酸乙酯部位中分离得到松柏醛,其可以通过共同凝血途径、激活纤维蛋白原系统及促进血小板聚集而发挥止血作用。初步明确了山楂炭中发挥止血作用的物质基础及山楂炒炭止血的机制,为山楂炭的临床应用提供理论依据,同时为丰富中药炭药物质基础及其作用机制的研究提供一定借鉴。
利益冲突所有作者均声明不存在利益冲突

