GLP-1R基因多态性与糖脂代谢关系及对儿童单纯性肥胖的影响
冯雪连,王 桢,张锐波,郑 昆,郭毅刚,宋 斌
(十堰市太和医院 湖北医药学院附属医院 1.儿科一病区;2.血液内科,湖北 十堰 442000)
研究显示,全球约有5%的儿童肥胖,且仍处于上升趋势,其中95%左右为儿童单纯性肥胖(childhood simple obesity,CSO)[1-2]。由于CSO患儿体内脂肪积聚过多,不仅影响其正常生长发育,还会对骨骼、消化、内分泌、心理智力等多个系统造成严重危害,并增加成年期慢性疾病的患病风险,因此,对CSO进行研究意义重大[3]。胰高血糖素样肽1受体(glucagon-like peptide-1 receptor,GLP-1R)系G蛋白偶联受体家族成员,由463个氨基酸组成,可调节胰岛素合成分泌,其基因多态性被证实影响腰围、体脂分布、脂肪量对饮食干预的反应性,并能影响糖尿病患者利拉鲁肽治疗后体重下降效果,但在CSO领域研究较少,且可供了解的临床资料十分有限[4-5]。基于此,本研究尝试探讨GLP-1R基因多态性与糖脂代谢关系及对CSO的影响,以期为CSO防治、管理等提供客观支持,现报道如下。
1研究对象与方法
1.1研究对象
选取2020年2月至2022年2月在十堰市太和医院就诊的91例CSO患儿(CSO组)及同期91例非CSO健康儿童(对照组)。CSO组中,女46例,男45例;年龄为4~12岁,平均(7.25±1.59)岁;汉族77例,少数民族14例;城市40例,农村51例。对照组中,女41例,男50例;年龄为4~12岁,平均(7.30±1.62)岁;汉族73例,少数民族18例;城市47例,农村44例。两组的性别、年龄、民族、区域基线资料均衡可比(P>0.05)。
1.2纳入与排除标准
纳入标准:①CSO的诊断参考《中国儿童肥胖的评估、治疗和预防指南》[6];②对照组为非CSO健康儿童;③法定监护人知情同意。排除标准:①糖尿病等代谢疾病引起的肥胖;②药物不良反应引起的肥胖;③伴先天遗传疾病;④不能配合研究。
患儿法定监护人知晓研究内容,自愿签署知情同意书;研究内容经本院伦理委员会审批通过(R2020163)。
1.3方法
1.3.1糖脂代谢的检测
血糖仪(美国强生稳豪倍优型);生化分析仪(美国Dade Behring公司,DADE Dimension AR型);高效液相色谱仪(美国WATERS公司,e2695型);空腹血糖(fasting plasma glucose,FPG)、糖化血红蛋白(glycosylated hemoglobin,HbA1c)试剂盒(北京力波生物科技);低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)、总胆固醇(total cholesterol,TC)、甘油三酯(triacylglycerol,TG)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)试剂盒(上海纪宁公司)。
就诊时采集患儿空腹肘静脉血5mL,采用葡萄糖氧化酶法检测FPG,采用高效液相色谱法检测HbA1c,采用生化分析仪直接法检测LDL-C、TC、TG、HDL-C水平。
1.3.2GLP-1R基因多态性的检测
PCR仪(美国ABI,75002型);分光光度计(美国PE公司,AA-200型);血液基因组DNA提取试剂盒(福州飞净生物科技有限公司);琼脂糖(上海翊圣生物科技有限公司);PCR反应试剂盒(美国Axygen公司)。
取就诊时采集的外周血标本,血液基因组DNA提取试剂盒提取样本DNA,分光光度计检测纯度,通过Sanger双脱氧终止测序法检测GLP-1Rrs10305420、GLP-1Rrs3765467、GLP-1Rrs6923761位点的基因型。GLP-1Rrs10305420上下游引物分别为5′-TGCGCTTCCTGATTCCCA-3′、5′-AGCGGTCTCGGAGTTTCG-3′,GLP-1Rrs3765467上下游引物分别为5′-GCAGGGATAGCCCTCAGAAT-3′、5′-T G T T C C A A G G C C A G A G A G G T-3′,GLP-1Rrs6923761上下游引物分别为5′-G G G A A G G A A G-
A T T G T G G G A A G A G G-3′、5′-G G T T G G T G G T G C T T-
GCGTGGTATT-3′;95℃预变性5min,95℃变性30s,58℃低温复性30s,72℃退火延伸1min,扩增40个循环。
1.4观察指标
①比较两组的FPG、HbA1c、LDL-C、TC、TG、HDL-C;②比较两组的GLP-1R基因多态性;③比较GLP-1Rrs10305420、GLP-1Rrs3765467、GLP-1Rrs6923761位点不同基因型患儿糖脂代谢情况;④分析CSO的相关影响因素。
1.5统计学方法

2结果
2.1两组糖脂代谢指标情况
CSO组的FPG、HbA1c、LDL-C、TC与对照组比较差异均无统计学意义(P>0.05);CSO组的TG显著高于对照组,CSO组的HDL-C显著低于对照组,差异均有统计学意义(P<0.05),见表1。

表1 两组糖脂代谢指标的比较Table 1 Comparison of glucolipid metabolism indexes between the two
2.2 GLP-1R基因分型与Hardy-Weinberg平衡吻合度检验情况
GLP-1Rrs10305420位点扩张片段经测序显示有CC、CT、TT基因型;GLP-1Rrs3765467位点扩张片段经测序显示有GG、GA、AA基因型;GLP-1Rrs6923761位点扩张片段经测序显示有GG、GA、AA基因型。GLP-1Rrs10305420、GLP-1Rrs3765467、GLP-1Rrs6923761位点多态性分布见表2,均符合Hardy-Weinberg平衡(χ2值分别为0.374、1.211、0.865,P值分别为0.732、0.276、0.411)。
2.3两组GLP-1R基因多态性情况
CSO组的GLP-1Rrs10305420、GLP-1Rrs3765467位点基因型分布与对照组比较差异均有统计学意义(P<0.05);CSO组的GLP-1Rrs6923761位点基因型分布与对照组比较差异无统计学意义(P>0.05),见表2。
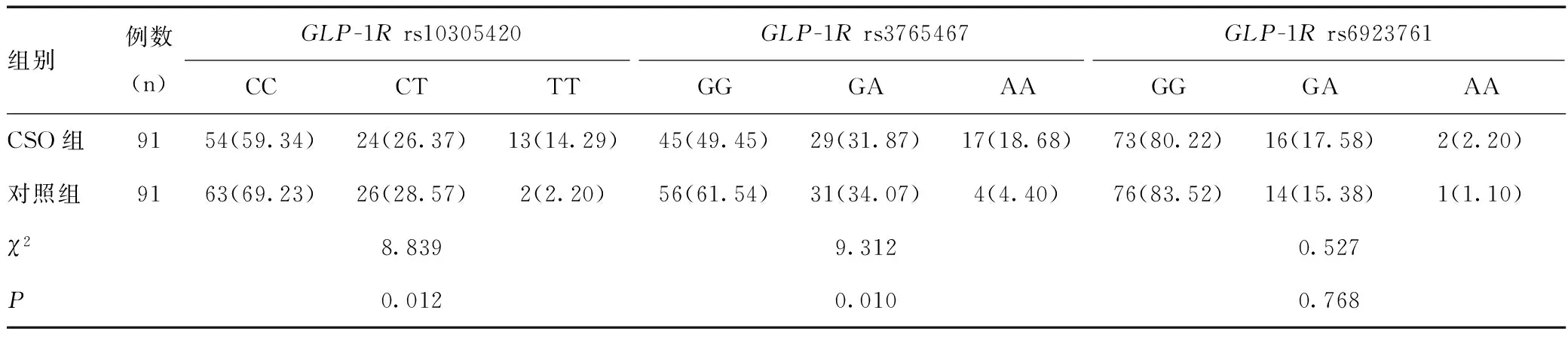
表2 两组GLP-1R基因多态性的比较[n(%)]Table 2 Comparison of GLP-1R gene polymorphisms between the two groups[n(%)]
2.4不同GLP-1R基因型糖脂代谢情况
GLP-1Rrs10305420位点CC基因型患儿的FPG、HbA1c、LDL-C、TC、TG与CT+TT基因型比较差异均无统计学意义(P>0.05);GLP-1Rrs3765467位点GG基因型患儿的FPG、HbA1c、LDL-C、TC、HDL-C与GA+AA基因型比较差异均无统计学意义(P>0.05);GLP-1Rrsrs6923761位点GG基因型患儿的FPG、HbA1c、LDL-C、TC、TG、HDL-C与GA+AA基因型比较差异均无统计学意义(P>0.05);GLP-1Rrs10305420位点CC基因型患儿的HDL-C显著高于CT+TT基因型,GLP-1Rrs3765467位点GG基因型患儿的TG显著低于GA+AA基因型,差异均有统计学意义(P<0.05),见表3。

表3 不同GLP-1R基因型患儿糖脂代谢的比较Table 3 Comparison of glucolipid metabolism in patients with different GLP-1R
2.5 CSO的多因素分析
以是否发生CSO为因变量(否=0,是=1);纳入TG(按实际值赋值)、HDL-C(按实际值赋值)、GLP-1Rrs10305420位点(携带等位基因C=1,携带等位基因T=2)、GLP-1Rrs3765467位点(携带等位基因G=1,携带等位基因A=2)作为自变量,采用Logistic回归分析CSO的相关影响因素,结果显示,TG、HDL-C、GLP-1Rrs10305420位点携带等位基因T、GLP-1Rrs3765467位点携带等位基因A均与CSO发生有关(P<0.05),见表4。
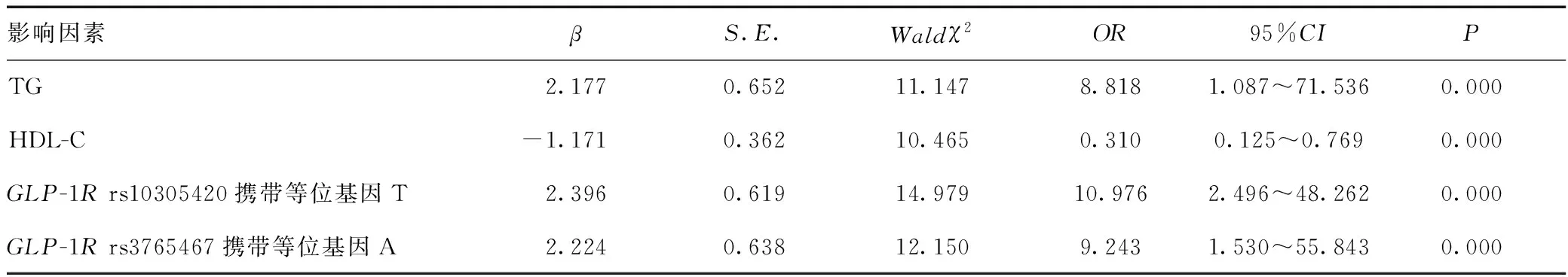
表4 CSO影响因素的Logistic分析Table 4 Logistic analysis of the factors influencing CSO
3讨论
3.1监测CSO患儿糖脂代谢的重要性
目前已明确糖脂代谢异常是肥胖的相关独立危险因素[7]。虽然CSO患儿体质量指数(body mass index,BMI)达到肥胖标准,但并未伴血糖、血脂等代谢异常,仅表现为能量代谢障碍引发的脂肪积聚过多[8]。《中国儿童代谢健康型肥胖定义与筛查专家共识》[9]显示,CSO患儿的TG<1.70mmol/L、FPG<5.6mmol/L、HDL-C>1.03mmol/L。本研究显示,CSO组与对照组糖脂代谢指标均在上述范围内;但与正常儿童相比,CSO患儿TG相对较高,HDL-C相对较低,且这种差异表现显著,可能与CSO有关。后续的多因素分析证实,TG、HDL-C均与CSO发生相关,可见对CSO患儿,应重视对其血脂指标的监测,并关注其TG、HDL-C水平,尽可能将TG控制在正常值范围下限,HDL-C保持在正常值范围上限。若临床发现患儿的TG、HDL-C在正常范围,但接近边界值,应建议患儿进行饮食管理、适当增加运动,并讲解早期干预的意义,增加患儿及其家长的重视度,同时加强随访,以减少CSO及其相关并发症的发生,保障儿童健康成长。
3.2 GLP-1R基因多态性及其与CSO的关系
GLP-1R基因可通过调节内源性胰岛素分布,发挥降糖、减重、调脂等功效[10]。尽管GLP-1R的功能对临床具有重要参考价值,但迄今为止,我国人群中GLP-1R及其相关位点多态性研究的数据十分有限。本研究通过分析发现,CSO组GLP-1Rrs10305420、GLP-1Rrs3765467位点基因型分布与对照组比较差异均有统计学意义,可能与CSO有关。多因素分析显示,GLP-1Rrs10305420位点携带等位基因T、GLP-1Rrs3765467位点携带等位基因A均与CSO发生有关。Jensterle等[11]研究显示,GLP-1R激动剂可降低糖尿病或非糖尿病患者体重;即使每日未达到最大剂量,也能使体重明显降低[12];其证实了GLP-1R在肥胖中所起的作用。在肥胖多囊卵巢综合征患者中,GLP-1R基因多态性可影响患者体重减轻效果,GLP-1Rrs10305420位点携带等位基因T患者体重无明显降低,而野生CC型患者体重则伴有明显降低,提示GLP-1Rrs10305420位点携带等位基因T是肥胖的危险因素[13],其与本研究结论存在相似之处。GLP-1Rrs10305420、GLP-1Rrs3765467均定位于第6号染色体短臂,两位点多态性改变可影响氨基酸合成[14]。其中亮氨酸可帮助燃烧内脏脂肪,这些脂肪位于机体内部,仅通过节食难以将其显著减少,GLP-1Rrs10305420位点多态性改变可将亮氨酸转变为脯氨酸,使亮氨酸合成受阻,故与CSO发生有关;谷氨酰胺可促进肌肉增长,减少机体脂肪,增强胃肠道管腔细胞对热量的消耗,GLP-1Rrs3765467位点多态性改变可将谷氨酰胺变为精氨酸,从而影响CSO的发生[15-16]。
3.3 GLP-1R基因多态性与CSO患儿糖脂代谢的关系
本研究还显示,GLP-1Rrs10305420位点CC基因型患儿的HDL-C显著高于CT+TT基因型,GLP-1Rrs3765467位点GG基因型患儿的TG显著低于GA+AA基因型,提示GLP-1Rrs10305420位点携带等位基因T可导致HDL-C降低,GLP-1Rrs3765467位点携带等位基因A可导致TG升高。李蕊等[17]对2型糖尿病患儿研究发现,GLP-1Rrs10305420位点CC基因型患儿HDL-C高于CT+TT基因型,本研究结果与之相似,但与之不同的是,本研究的对象为CSO患儿,提示GLP-1R基因多态性在不同研究对象中,对血脂代谢调控作用类似,但这仅是建立于研究结果上的一种推测,仍需后续更多研究的进一步验证。结合以上研究结果,对CSO患儿,若GLP-1Rrs10305420位点发生突变,可考虑为患儿补充亮氨酸,若GLP-1Rrs3765467位点发生突变,可酌情补充谷氨酰胺,以减小GLP-1R基因多态性改变对相关氨基酸合成的影响,促进TG、HDL-C正常代谢,减少CSO的发生,这为CSO的防治提供了一种遗传学机制和新的方法。
3.4小结
GLP-1Rrs10305420位点携带等位基因T可导致HDL-C降低,GLP-1Rrs3765467位点携带等位基因A可导致TG升高,且以上两位点多态性改变均与CSO有关,这为CSO防治提供了一种遗传学机制和新的方法。

