慢性丙型肝炎和慢性乙型肝炎患者ITPA基因多态性与聚乙二醇干扰素抗病毒治疗所致血小板减少症相关性分析
邓浩辉 楼燕 李晓强 邱玖香
聚乙二醇干扰素(Peg-IFN)是慢性丙型肝炎(CHC)和慢性乙型肝炎(CHB)患者抗病毒治疗的重要药物之一,但其不良反应显著高于直接抗病毒药物或核苷类药物,限制了其临床应用。Peg-IFN抗病毒治疗所致的血小板减少症是其常见的不良反应之一,常导致抗病毒治疗过程中药物的减量或停药,是影响抗病毒疗效的重要原因。国外学者的研究表明,CHC患者肌苷三磷酸酶(ITPA)基因多态性(SNP)与Peg-IFN抗病毒治疗所致的血小板减少症相关,但国内未见报道,另外,在CHB人群也未见相关报道。本研究探讨CHC和CHB患者肌苷三磷酸酶(ITPA)基因多态性(SNP)与Peg-IFN α-2b或α-2a抗病毒治疗所致血小板减少症的相关性,现将结果报道如下。
资料与方法
一、研究对象
本研究纳入广州医科大学附属市八医院2011年1月—2016年12月期间门诊治疗的92例CHC和87例CHB患者,纳入的患者均有完整48周随访数据并保存全血或外周血单个核细胞(PBMC)样本,CHC患者使用Peg-IFN α-2a(180 μg/周)或α-2b(80 μg/周)联合利巴韦林(RBV)抗病毒治疗,CHB患者使用Peg-IFN α-2a或α-2b单药抗病毒治疗。纳入分析的患者符合年发布的《慢性乙型肝炎防治指南(2015更新版)》和《丙型肝炎防治指南(2015更新版)》的诊断标准以及符合指南建议的抗病毒治疗指征[1-2]。排除标准:排除合并肝硬化、肝细胞癌、其他病毒性肝炎、酒精性肝病、脂肪肝、药物性肝炎和自身免疫性肝炎的患者。本研究已通过广州医科大学附属市八医院伦理委员会审查,所有纳入研究的患者均签署知情同意书。
二、肌苷三磷酸酶(ITPA)基因rs1127354位点基因多态性检测方法
(一)患者宿主基因组DNA的提取 使用QIAamp DNA Mini Kit核酸提取试剂盒(QIAGEN,德国)对患者的全血或PBMC样本进行DNA提取,具体步骤按试剂盒说明书进行,已提取的DNA立即进行PCR扩增。
(二)PCR扩增包含目的位点的基因片段 使用Primer Premier 6.0软件设计引物,具体引物序列参考我们前期的研究[3],对包含ITPA基因rs1127354位点的基因片段进行扩增,PCR反应条件如下:95 ℃预变性3 min;95 ℃15 s,55 ℃ 25 s,72 ℃ 30 s,35个循环;7 2℃延伸2 min。PCR扩增产物经琼脂糖电泳验证产物后送广州英潍捷基公司进行测序。
(三)序列分析 使用Geneious R10.0.5软件进行序列峰图分析,并根据序列测序图确定患者ITPA基因rs1127354位点SNP数据。
三、临床数据收集
收集纳入分析的使用Peg-IFN抗病毒治疗患者4、8、12、24、36和48周的血小板变化情况,以及Peg-IFN药物剂量调整情况的数据。
四、统计分析
计量资料采用均数±标准差表示,计数资料采用例数和百分比表示,使用SPSS 13.0软件进行独立样本t检验,χ2检验,重复测量数据和多变量方差分析。P<0.05为差异有统计学意义。
结 果
一、患者的一般资料
本研究纳入的92例CHC患者中,男性65例(70.6%),女性27例(29.3%),平均年龄(39.5±11.4)岁,HCV RNA (6.4±1.3)lgIU/mL,53例(57.6%)使用Peg-IFN α-2a/RBV抗病毒治疗,39例(42.3%)使用Peg-IFN α-2b/RBV抗病毒治疗。纳入的87例CHB患者中,男性63例(72.4%),女性24例(27.6%),平均年龄(37.3±11.5)岁,HBV DNA(5.9±1.4) lgIU/mL,HBeAg 抗原阳性54例(62.1%),阴性33例(37.9%),50例(57.5%)使用Peg-IFN α-2a抗病毒治疗,37例(42.5%)使用Peg-IFN α-2b抗病毒治疗。
二、患者ITPA基因rs1127354位点基因多态性
本研究纳入的92例CHC患者中,ITPA基因rs1127354位点CC型55例(59.8%),AC型31例(33.7%),AA型6例(6.5%),符合Hardy-Weinberg遗传平衡定律检验(χ2=0.322,P=0.570)。在87例CHB患者中,ITPA基因rs1127354位点CC型53例(60.9%),AC型29例(33.3%),AA型5例(5.7%),也符合Hardy-Weinberg遗传平衡定律检验(χ2=0.151,P=0.698)。
因ITPA基因rs1127354位点AA型的例数较少,参考既往研究[4],AC/AA型合并分析。以ITPA基因rs1127354位点SNP为分组,CHC和CHB患者ITPA基因rs1127354位点AA/AC型和CC型患者一般资料比较差异均无统计学意义(P>0.05,见表1和表2)。
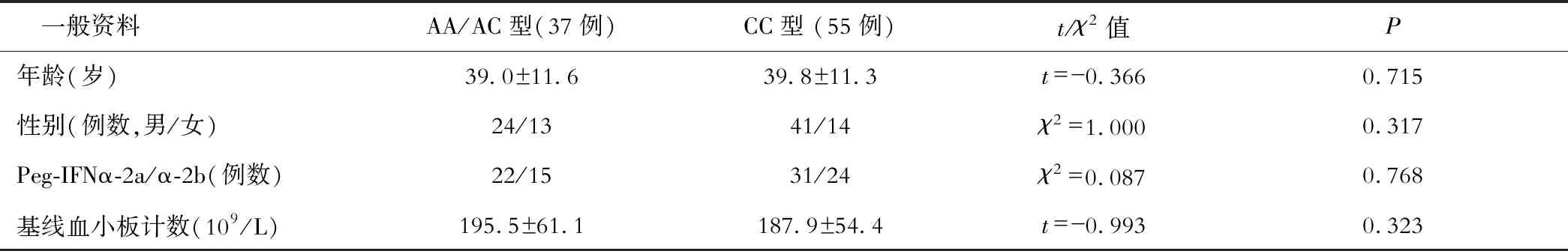
表1 CHC患者rs1127354位点AA/AC型和CC型一般资料比较
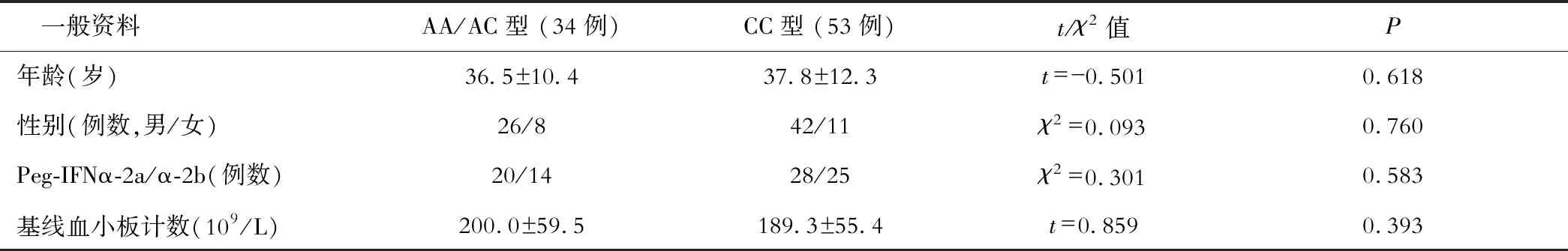
表2 CHB患者rs1127354位点AA/AC型和CC型一般资料比较
三、ITPA基因rs1127354位点SNP与Peg-IFN治疗所致血小板减少症相关性分析
在CHC患者中,rs1127354位点AA/AC型在Peg-IFN/RBV治疗后4周(F=6.195,P=0.015)和8周(F=4.304,P=0.015)血小板下降水平显著高于CC型的患者,但12、24、36和48周AA/AC型和CC型血小板下降水平差异无统计学意义(P均>0.05)。在CHB患者中,rs1127354位点SNP与Peg-IFN抗病毒治疗后各时间点血小板下降程度无显著相关性(P均>0.05)。见表3和4。
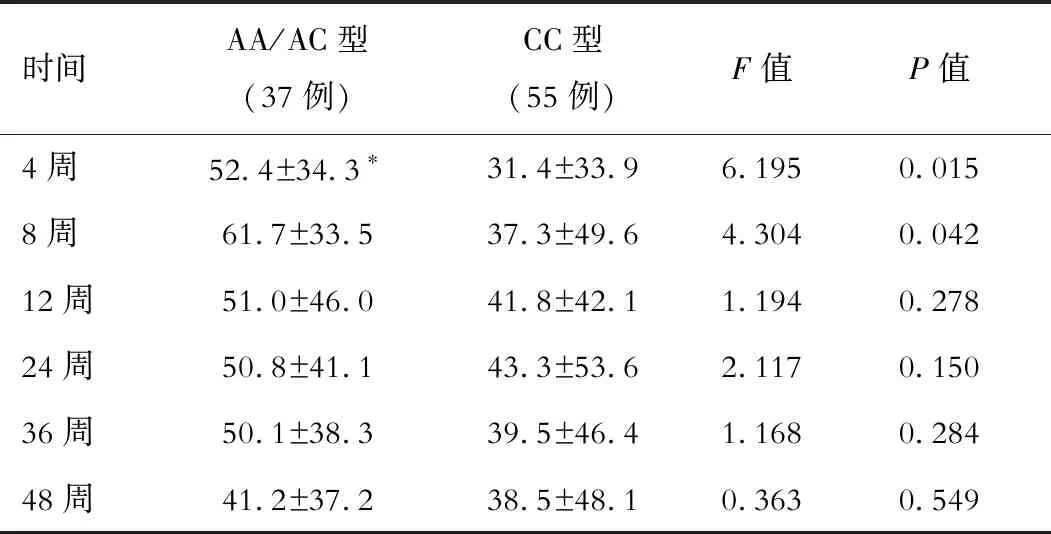
表3 CHC患者治疗过程中rs1127354位点AA/AC型和CC型血小板下降水平比较
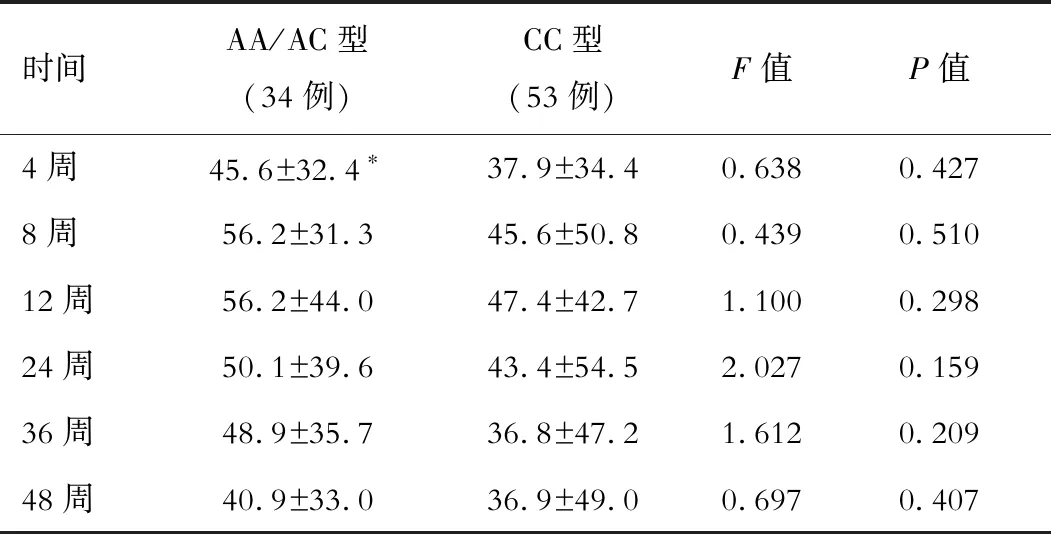
表4 CHB患者治疗过程中rs1127354位点AA/AC型和CC型血小板下降水平比较
四、ITPA基因rs1127354位点SNP与治疗过程中Peg-IFN药物减量的关系
在纳入分析的92例使用Peg-IFN/RBV抗病毒治疗的CHC患者中,28例患者在48周治疗过程中有Peg-IFN药物减量,包括16例(16/37, 43.2%)rs1127354位点AA/AC的患者和12例(12/55, 21.8%)CC型的患者,AA/AC型患者Peg-IFN药物剂量减量的构成比显著高于CC型患者(χ2=4.796,P=0.029)。在纳入分析的87例使用Peg-IFN抗病毒治疗的CHB患者中,32例患者在48周的治疗过程中有药物减量,包括13例(13/34, 38.2%)rs1127354位点AA/AC的患者和19例(19/53, 35.8%)CC型的患者,但rs1127354位点SNP与Peg-IFN药物剂量调整无显著相关性(χ2=0.051,P=0.822)。
讨 论
Peg-IFN是HCV或HBV抗病毒治疗重要的药物之一,其在CHC患者和优势的CHB人群具有良好的疗效[5-7],但其不良反应明显限制了其临床应用,主要不良反应包括骨髓抑制所致的血细胞减少症(中性粒细胞和血小板)、精神异常、自身免疫性疾病和视网膜病变等疾病[8-9],其中Peg-IFN所致血小板减少症是其常见的不良反应之一,常导致抗病毒治疗过程中药物的减量或停药,是影响抗病毒疗效的重要原因。既往的研究表明,宿主SNP与Peg-IFN的药物不良反应相关[10-11],但上述研究主要在国外CHC患者中报道,不同人种SNP的差异很大,国内外SNP与疾病状态的相关性可能并不一致,CHC宿主SNP与Peg-IFN所致血小板减少症的相关性在国内未见相关报道。另外,Peg-IFN所致血细胞减少症的主要机制与骨髓抑制有关,理论上与不同的慢性肝炎病毒感染的相关性不大,但国内外对CHB患者宿主SNP与Peg-IFN抗病毒治疗所致的血小板减少症相关性未见报道。
本研究纳入本院既往使用Peg-IFN/RBV抗病毒治疗的CHC和Peg-IFN抗病毒治疗的CHB患者进行研究,结果提示在CHC患者,ITPA基因rs1127354位点AA/AC型Peg-IFN/RBV治疗后4周和8周血小板下降程度显著高于CC型患者,但在CHB患者中,ITPA基因rs1127354位点AA/AC型和CC型在Peg-IFN抗病毒治疗后各时间点血小板下降程度无显著相关性。另外,CHC患者ITPA基因rs1127354位点AA/AC型抗病毒治疗过程中Peg-IFN药物剂量减量的构成比显著高于CC型,但CHB患者rs1127354位点SNP与Peg-IFN抗病毒治疗过程中药物剂量减量的构成比无显著差异。
既往国外学者的研究已表明,ITPA基因rs1127354位点SNP与Peg-IFN/RBV抗病毒治疗过程中RBV所致的溶血性贫血相关,其中CC型患者血红蛋白下降程度更显著[4, 12-13],且上述研究也发现,rs1127354位点SNP与Peg-IFN诱导的血小板减少症显著相关。本研究的结果也提示在国内CHC使用Peg-IFN/RBV抗病毒治疗的患者中,rs1127354位点SNP与Peg-IFN诱导的血小板减少程度显著相关,但该SNP位点与CHB使用Peg-IFN抗病毒治疗所致的血小板减少症无明显相关性。其原因可能在于rs1127354位点CC型的CHC患者由于血红蛋白下降更明显,促使红细胞生成素(EPO)的水平升高,而EPO和促血小板生成素(TPO)的氨基酸序列具有部分同源性,因此EPO有可能也作用于巨核细胞,从而促进血小板生成,由此代偿性减轻CC型患者Peg-IFN所致血小板减少症[14-15],AA/CC患者血小板下降程度高于CC型患者的机制可能与此有关。另外,血小板下降水平仅在4周和8周有差异,可能与治疗过程中不同患者SNP与药物减量机会的差异有关。在CHB患者,由于仅使用Peg-IFN单药进行抗病毒治疗,对血红蛋白的浓度无显著影响。因此,rs1127354位点SNP与CHB患者Peg-IFN抗病毒治疗所致血小板减少症无显著相关性的原因可能与此相关。
综上所述,CHC患者rs1127354位点SNP与Peg-IFN抗病毒治疗所致血小板减少症显著相关,但CHB患者rs1127354位点SNP与其无显著相关性。Peg-IFN目前仍然是CHB抗病毒治疗的重要药物,虽本研究暂未发现CHB患者rs1127354位点SNP与Peg-IFN抗病毒治疗所致血小板减少症有关,但对了解Peg-IFN治疗的毒副作用机制,指导患者的个体化治疗,从而减少药物的不良反应,并提高用药安全性有重要的意义。因此,应继续进一步研究,寻找相关的生物学标志物。
利益冲突声明:所有作者均声明不存在利益冲突。

