4 种多糖益生元对鼠李糖乳杆菌微胶囊稳定性的影响
刘炯娜,徐玉巧,范方宇
(西南林业大学生命科学学院,西南山地森林资源保育与利用教育部重点实验室,云南 昆明 650224)
鼠李糖乳杆菌(Lactobacillus rhamnosusGG,LGG)具有调节肠道益生菌菌群、增强人体免疫力的功能[1]。当益生菌活菌数高于6(lg(CFU/g))时,可在肠道内定植,并发挥预期的健康作用[2]。贮藏和食用期间,益生菌易受水分、温度、胃酸、胆盐等影响,导致其活性降低,甚至失活[3]。为稳定LGG的活性,采用微胶囊技术提升LGG稳定性是一种有效方法。如王远一飞等[4]采用壳聚糖/黄原胶制备了LGG微胶囊,结果表明微胶囊化对LGG有较强的保护作用。采用复合凝聚法、喷雾干燥制备的LGG微胶囊,可有效降低外界环境对LGG的影响[5],但喷雾干燥过程中的高温损伤、渗透压变化等,易导致益生菌存活率降低,因此如何有效提高益生菌微胶囊稳定性是研究者探索的热点之一。
益生元是一种寡糖型短链碳水化合物,不被人体消化吸收,但可被肠道中的微生物(如双歧杆菌)利用,促进肠道益生菌增殖,进一步促进调节脂质代谢和增强钙的吸收能力[6-7]。有研究者发现,益生元为益生菌提供营养,促进益生菌增殖,并抑制肠道致病菌生长和定植,对肠道中的益生菌具有一定的保护作用[8-9]。如李雅丽等[10]研究发现不同益生元对益生菌的作用效果差异显著,乳糖对乳双歧杆菌BL-99的增殖效果较好,而低聚半乳糖对婴儿双歧杆菌YLGB-1496、副干酪乳杆菌K56、副干酪乳杆菌ET-22的增殖效果较好。Anzawa等[11]将乳双歧杆菌GCL2505和菊粉制成合生元饮料,可有效提高人体内双歧杆菌的增殖。Duque等[12]研究表明,益生菌中添加益生元可提高益生菌的存活率。Nunes等[13]喷雾干燥嗜酸乳杆菌La-5发现,加入菊糖、海藻糖和高直链淀粉对嗜酸乳杆菌La-5具有较好的保护作用。由于每种益生菌的代谢途径和产生的酶不同,不同益生菌对益生元的利用也有一定区别[14]。目前,研究不同益生元对LGG微胶囊稳定性的影响还鲜有报道。
基于此,本研究添加菊糖、低聚果糖、普鲁兰多糖和水苏糖4 种益生元制备LGG微胶囊,研究LGG微胶囊模拟胃肠消化实验,分析LGG微胶囊的耐胆盐、耐热性、贮藏性、热稳定性,并采用扫描电镜和差示扫描量热仪对LGG微胶囊进行表征,旨在为后续益生元在LGG微胶囊的进一步利用提供理论基础。
1 材料与方法
1.1 材料与试剂
LGG(ATCC 53013)冻干粉 美国菌种保藏中心。益生元具体参数如表1所示。

表1 4 种益生元Table 1 Information on four prebiotics
B型明胶(gelatin,GE)、阿拉伯胶(gum arabic,GA)国药集团化学试剂有限公司;谷氨酰胺转氨酶(transglutaminase,TG酶,100 U/g) 泰兴市东胜食品科技有限公司;猪胆盐 上海源叶生物科技有限公司;胃蛋白酶(3000 U/mg) 中国Biosharp公司;胰蛋白酶(250 U/mg) 德国Biofroxx公司。
1.2 仪器与设备
B-290小型喷雾干燥仪 瑞士Büchi实验室仪器公司;PHS-25 pH计 上海仪电科学仪器股份有限公司;THZ-82气浴恒温摇床 上海力辰仪器科技有限公司;3K15离心机 德国Sigma公司;S-3000N扫描电镜日本Hitachi公司;差示扫描量热仪 德国Netzsch仪器制造有限公司。
1.3 方法
1.3.1 益生元LGG微胶囊的制备
基于本课题组方法[5],以复合凝聚法制备益生元LGG微胶囊。配制质量分数为1.5%的GE和GA混合溶液200 mL,GE和GA质量比为1∶1,加入0.5%益生元,40 ℃水浴搅拌溶解,加入9(lg(CFU/g))浓缩菌液,混匀后用0.5 mol/L的HCl溶液调pH 3.75,40 ℃恒温水浴搅拌60 min,转速200 r/min。将反应体系自然冷却至室温,用0.5 mol/L的NaOH溶液调pH 6.0,加入TG酶(添加量为25 U/g,以GE质量计)进行交联反应,冰浴中继续搅拌3 h。2000 r/min离心5 min收集微胶囊,用无菌水洗涤2 次,清除表面的菌体。将湿囊与无菌水配备成悬浮液进行喷雾干燥。喷雾干燥参数:进风温度170 ℃,进料流量9 mL/min,进料量30%,出风温度约80 ℃。
1.3.2 性质测定
1.3.2.1 模拟胃肠消化特性
模拟胃液[17]:将质量分数3%的胃蛋白酶(3000 U/mg)、2%的NaCl添加至无菌水中,用0.5 mol/L的HCl溶液调pH 2.0,过0.22 μm滤膜除菌备用。
模拟肠液[18]:将质量分数0.1%的胰蛋白酶(250 U/mg)添加至pH 6.8的无菌磷酸盐缓冲液(phosphate buffer saline,PBS)中,过0.22 μm滤膜除菌备用。
基于姚泽晨等[19]的方法进行修改,测定模拟胃肠道实验中未添加益生元LGG微胶囊(空白组)和添加益生元LGG微胶囊(益生元组)的活菌数。待测样品溶于模拟胃液中,37 ℃、100 r/min的恒温振荡培养箱中培养,分别在0、30 min和60 min取样进行活菌计数。
在模拟胃液中培养60 min后,10000 r/min离心5 min,弃上清液,将沉淀物添加至模拟肠液中(总体积10 mL),在60、120 min取样进行活菌计数。
1.3.2.2 胆盐耐受性
将空白组和益生元组LGG微胶囊分别添加至0.1%、0.3%和0.6%的胆盐溶液中,3 h后离心,取沉淀于无菌PBS中进行活菌计数。
1.3.2.3 耐热性
将0.02 g空白组和益生元组LGG微胶囊分别置于2 mL无菌离心管中,加入1 mL无菌PBS,离心管分别在55、65 ℃和75 ℃水浴,10 min和30 min时迅速取出离心管,冰水浴冷却,冷却后转移至37 ℃培养箱,待微胶囊溶解后涂布计数。
1.3.2.4 贮藏稳定性
不同水分活度的贮藏性:根据课题组研究方法[5],将空白组和益生元组微胶囊分别置于水分活度为0.11、0.33、0.75环境中保存8 周,每周测定一次活菌数。
常温条件下的贮藏性:将微胶囊置于常温条件下保存8 周,每隔1 周计算活菌数。测定活菌数时,每次取0.1 g微胶囊置于10 mL无菌PBS中,37 ℃恒温振荡至完全溶解,用稀释梯度法涂布平板计数。
1.3.2.5 差示扫描量热分析
在N2氛围下进行测试,分别取空白组和益生元组微胶囊5~10 mg,升温速率10 ℃/min,测试温度范围25~250 ℃[5]。
1.3.3 表观形态观察
分别取少量空白组和益生元组微胶囊置于导电胶表面后喷金90 s,通过扫描电镜观察样品表观形态,放大倍数3000,加速电压15 kV。
1.4 数据处理与分析
2 结果与分析
2.1 微胶囊性能分析
2.1.1 LGG微胶囊模拟胃肠道消化实验
益生菌发挥作用的最终部位为肠道,LGG经口进入人体后,需要抵御胃酸中的高浓度氢离子的影响,才可到达肠道发挥益生菌的作用[19]。由表2可见,无论是否添加益生元,微胶囊经过模拟胃肠消化后,其活菌数仍然可以保持较高,说明微胶囊化对LGG具有保护作用。添加益生元的LGG微胶囊初始活菌数均高于空白组,其中菊糖和水苏糖显著提高LGG存活率(P<0.05)。原因为多糖类物质在喷雾干燥过程中可以取代从细胞内蛋白质中损失的水分,提高细胞膜的耐受温度,改善益生菌在干燥过程中的存活率[20]。益生元属糖类物质,干燥的LGG细胞组分与益生元直接相互作用,减小高温对LGG损伤,在干燥过程中保持细胞的活性,提高微胶囊中LGG的存活率。模拟胃肠道实验前后,空白组活菌数下降了约0.3(lg(CFU/g)),添加菊糖、低聚果糖、普鲁兰多糖和水苏糖分别下降了约0.9、0.6、0.7(lg(CFU/g))和1.6(lg(CFU/g))。可见,添加益生元的微胶囊在模拟胃肠道实验时并未提供额外的保护作用。经模拟肠液处理120 min,未加益生元组活菌数为7.5(lg(CFU/g)),添加菊糖、低聚果糖、普鲁兰多糖和水苏糖的LGG微胶囊活菌数分别达到了约9.5、9.0、9.0(lg(CFU/g))和8.5(lg(CFU/g))。模拟胃肠道处理后添加益生元的4 组微胶囊的活菌数均大于空白组(P<0.05),结果表明添加益生元的微胶囊在到达肠道时LGG能发挥更好的作用。在常依柳等[21]添加益生元的长双歧杆菌微胶囊、邓紫玙等[22]添加羧甲基茯苓多糖的植物乳杆菌微胶囊研究中也发现了类似的结果。
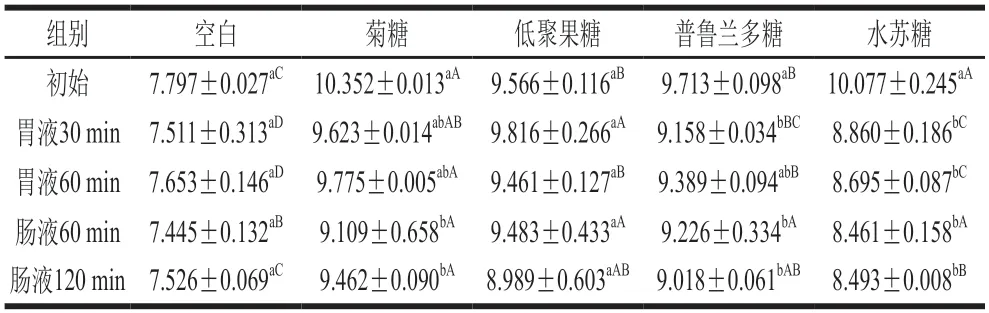
表2 LGG微胶囊在模拟胃肠道中的活菌数Table 2 Viable count of LGG microcapsules under simulated gastrointestinal conditions(lg(CFU/g))
2.1.2 LGG微胶囊耐胆盐分析
胆盐是参与脂肪消化和吸收的钠钾盐,会破坏益生菌的细胞膜结构,使其发生氧化损伤失活。由图1可知,随胆盐添加量增加,空白组和益生元组的活菌数均降低,表明胆盐溶液对LGG有一定损害作用,但益生元组的活菌数始终比空白组高,其中添加水苏糖的LGG微胶囊对胆盐更具有耐受性。3 种胆盐添加量下,添加水苏糖的LGG微胶囊都具有最高的存活数。经0.1%胆盐溶液处理后,空白组LGG活菌数下降了2.6(lg(CFU/g)),添加菊糖、低聚果糖、普鲁兰多糖和水苏糖的活菌数分别下降了1.4、1.1、1.3(lg(CFU/g))和1.6(lg(CFU/g))。当胆盐添加量为0.6%时,空白组下降4.7(lg(CFU/g)),添加菊糖、低聚果糖、普鲁兰多糖和水苏糖的LGG微胶囊活菌数分别下降3.9、4.0、4.1(lg(CFU/g))和2.6(lg(CFU/g))。由此可见,在低胆盐环境下,添加益生元显著增强了微胶囊对LGG 的保护作用(P<0.05),且添加水苏糖的保护效果最佳。原因为干燥介质中的益生元,可在细胞内积聚并减小内部和外部环境之间的渗透压,有效降低胆盐对益生菌的损伤[23]。

图1 不同胆盐添加量时LGG微胶囊活菌数Fig.1 Viable count of LGG microcapsules with different bile salt concentrations
2.1.3 LGG微胶囊耐热性分析
由表3可见,随着温度的升高和时间的延长,LGG微胶囊活菌数逐渐减少,但添加益生元的LGG微胶囊活菌数均高于空白(P<0.05)。55 ℃、10 min后,空白组的活菌数下降了约3.1(lg(CFU/g)),添加菊糖、低聚果糖、普鲁兰多糖和水苏糖的LGG微胶囊活菌数分别下降约1.9、1.8、0.9(lg(CFU/g))和0.4(lg(CFU/g));75 ℃、30 min后,空白组下降约4.2(lg(CFU/g)),4 种添加益生元的LGG微胶囊活菌数分别下降约3.4、3.7、3.5(lg(CFU/g))和2.3(lg(CFU/g))。结果表明,添加益生元提高了LGG微胶囊的耐热性,且不同益生元对LGG微胶囊的影响不同(耐热性:水苏糖>菊糖>普鲁兰多糖>低聚果糖),在75 ℃、30 min后添加水苏糖的LGG微胶囊活菌数仍达8.7(lg(CFU/g))。相关研究中,Bilenler等[24]研究发现,在70 ℃热处理后,添加淀粉的植物乳杆菌和木糖葡萄球菌微胶囊在70 ℃条件下,仍可保持较高活性,可提高益生菌微胶囊对高温的耐受能力。Li Haiping等[25]研究表明,在高温条件下,添加木瓜多糖的干酪乳杆菌ATCC 334的存活率和热稳定性比未添加木瓜多糖的益生菌高,在逆境下木瓜多糖对干酪乳杆菌ATCC 334具有保护作用。这可能是添加的益生元稳定性好、耐高温可减缓热量向微胶囊内部扩散[26],从而增强了益生菌微胶囊的耐热性。

表3 不同温度条件 LGG微胶囊活菌数Table 3 Viable count of LGG microcapsules at different temperatures(lg(CFU/g))
2.1.4 LGG微胶囊不同水分活度下的贮藏稳定性
图2a中,水分活度0.11条件下,空白组和添加菊糖、低聚果糖、普鲁兰多糖、水苏糖4 种益生元的LGG微胶囊活菌数在8 周内分别下降了3.0、3.2、3.6、5.6、6.7(lg(CFU/g)),结果表明益生元不能有效提高微胶囊的贮藏稳定性,添加水苏糖的LGG微胶囊在8 周后的活菌数还低于空白组。图2b中,水分活度0.33条件下,各组LGG微胶囊随时间延长,活菌数快速下降。空白组的微胶囊活菌数第5周开始低于2.0(lg(CFU/g));菊糖组从第7周开始低于2.0(lg(CFU/g))。其他3 组添加益生元微胶囊在第8周保持了一定水平的活菌数,其中低聚果糖组贮藏稳定性最佳。图2c中,5 组微胶囊在水分活度0.75条件下,活菌数下降迅速。原因为水分活度增加,加快了益生菌脂质发生氧化,导致菌体失活[27]。第2 周开始普鲁兰多糖组检测不到活性(活菌数<2.0(lg(CFU/g))),空白组在第3周失去活性,其他3 组微胶囊活菌数随时间陆续失去活性。其中低聚果糖在高水分活度条件下对LGG微胶囊提供了较好的保护效果,在第6周时仍保持了3.3(lg(CFU/g))的活菌数。原因为低聚果糖在一定的温度条件下可取代水分子,并与益生菌体内的蛋白质极性基团或磷脂基团形成氢键,从而保护益生菌中蛋白质和细胞膜结构和功能的完整性。此外,低聚果糖属大分子多糖类,虽不能透过益生菌的细胞壁和细胞膜,但可降低溶质浓度,保护益生菌[28],且高水分活度下,低聚果糖作为唯一碳源,其对LGG的促生长效果可能更好[29]。

图2 LGG微胶囊在不同水分活度下的活菌数Fig.2 Viable count of LGG microcapsules under different water activities
2.1.5 LGG微胶囊常温条件下的贮藏稳定性
由表4可见,4 种益生元LGG微胶囊的活菌数在常温贮藏的第1周开始显著下降(P<0.05);未加益生元的LGG微胶囊活菌数第2周开始显著下降。随着贮藏时间延长,未加益生元、添加低聚果糖和水苏糖的LGG微胶囊活菌数显著下降(P<0.05);在第8周后,空白组LGG微胶囊活菌数下降了1.9(lg(CFU/g)),添加菊糖、低聚果糖、普鲁兰多糖、水苏糖4 种益生元的LGG微胶囊活菌数分别下降了0.8、1.5、2.1(lg(CFU/g))和2.5(lg(CFU/g))。各组喷雾干燥微胶囊在第8周时均保持较高的活性(活菌数>6(lg(CFU/g))),5 组微胶囊的贮藏稳定性为:菊糖组>水苏糖组>低聚果糖组>普鲁兰多糖组>空白组(P<0.05)。总之,常温贮藏时,LGG微胶囊可以保持较好的稳定性,益生元的添加为LGG微胶囊的贮藏提供了更好的保护条件,可以延长LGG微胶囊的货架期。
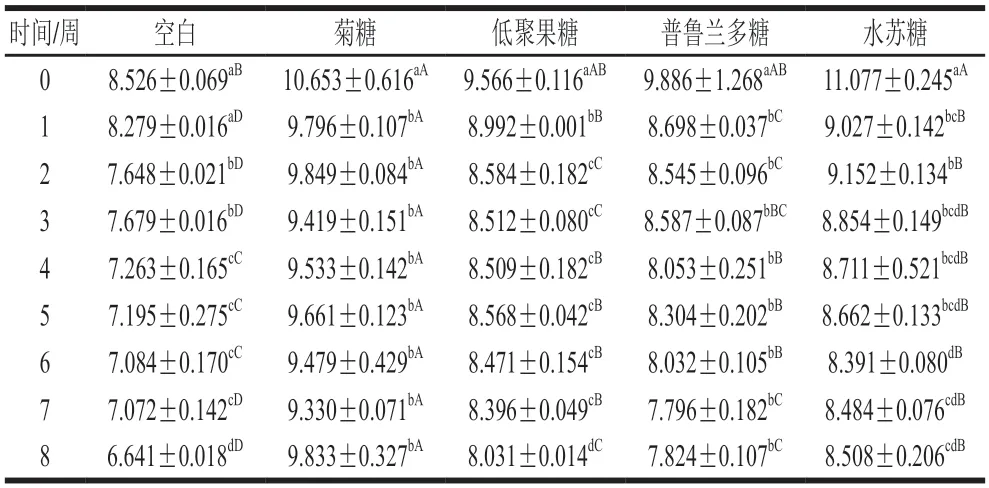
表4 LGG微胶囊常温条件下活菌数Table 4 Viable count of LGG microcapsules at ambient temperature(lg(CFU/g))
2.1.6 差示扫描量热分析
由图3可见,空白组的熔融温度约为148 ℃,添加菊糖、低聚果糖、普鲁兰多糖和水苏糖的微胶囊熔融温度分别约为162、105、169 ℃和172 ℃,菊糖、普鲁兰多糖和水苏糖的添加有效提高了微胶囊的熔融温度,低聚果糖降低了微胶囊的熔融温度,可能是由于低聚果糖是菊粉部分酶解的产物,聚合度较低(2~10),热稳定性差[30],而添加其他3 种益生元可提高LGG微胶囊的热稳定性,且添加水苏糖的微胶囊热稳定性最佳。原因为益生元能够结合益生菌细胞膜和蛋白质结构内的水分子,导致微胶囊的熔融温度增加[31]。Ashwar等[32]通过差示扫描量热分析乳酸菌微胶囊的热稳定性发现,抗性淀粉可以提高微胶囊的热稳定性。Alehosseini等[33]研究也表明,添加益生元后双歧杆菌BB-12微胶囊的热稳定性更好,且与低聚果糖相比,菊粉的熔融温度更高,对双歧杆菌BB-12的保护效果更好,这与本研究结果一致。
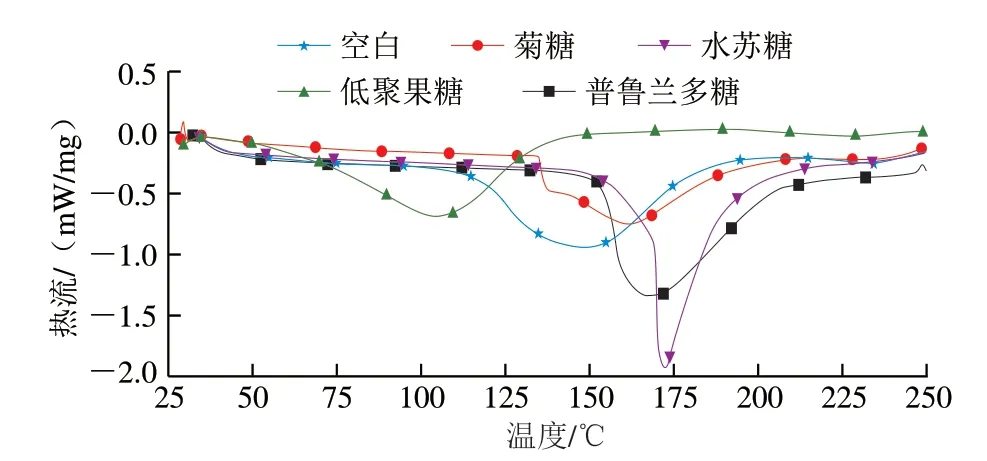
图3 不同益生元对LGG微胶囊差示扫描量热曲线的影响Fig.3 Effects of different prebiotics on the DSC curve of LGG microcapsules
2.2 扫描电镜分析
由图4可见,5 组微胶囊颗粒均完整、无破裂,各组之间粒径差距较小。这是因为5 组微胶囊的制备条件相同,所得微胶囊粒径大小一致,经喷雾干燥的微胶囊在外观结构上没有明显差异。但空白组的微胶囊凹陷较深,表面褶皱多。添加益生元后,部分微胶囊壁材表面褶皱减少,菊糖和水苏糖微胶囊较为明显,而壁材可以增大胃肠液、胆盐溶液和水等的穿越阻力,从而避免其与菌体接触,使微胶囊结构更稳定[34],提高微胶囊对LGG的保护作用。

图4 5 组LGG微胶囊扫描电镜图(×3000)Fig.4 SEM micrographs of fvie groups of LGG microcapsules (× 3000)
3 结论
以菊糖、低聚果糖、普鲁兰多糖和水苏糖为4 种益生元,分别制备含有益生元的LGG微胶囊,以未添加益生元的LGG微胶囊为对照,探究不同益生元对微胶囊性能的影响。结果表明添加益生元提高了LGG微胶囊存活率,益生元组的LGG存活率均高于空白组,其中水苏糖对LGG微胶囊的保护作用最强。但4 种益生元LGG微胶囊在各自条件下处理后,其稳定性不同。模拟胃肠液测试中,菊糖活菌数存活率最高,达9.5(lg(CFU/g));在胆盐溶液中益生元也增强了微胶囊对LGG的保护能力,其中水苏糖的效果最佳,在胆盐添加量0.6%条件下,空白组LGG活菌数下降4.7(lg(CFU/g)),而添加水苏糖仅下降2.6(lg(CFU/g));耐热性实验中,75 ℃、30 min后,添加水苏糖的微胶囊耐热性最佳,活菌数达8.7(lg(CFU/g));在高水分活度下添加低聚果糖可有效提高微胶囊的贮藏稳定性。差示扫描量热研究表明,菊糖、普鲁兰多糖和水苏糖的添加有效提高了LGG微胶囊的熔融温度,低聚果糖降低了LGG微胶囊的熔融温度,其中水苏糖增强了微胶囊的热稳定性,熔融温度达172 ℃。研究可为益生元在LGG微胶囊中的应用提供参考。

