不同面筋蛋白组分对小麦淀粉消化特性的影响机理
邝吉卫,张 冲,黄峻榕,,蒲华寅,马文慧,闵 聪,Youling L.XIONG
(1.陕西科技大学食品与生物工程学院,陕西 西安 710021;2.肯塔基大学动物与食品科学系,美国 莱克星顿 40546)
淀粉是粮食的最主要成分,也是日常饮食中最主要的能量来源。随着人们对低血糖指数食品需求的增加,低消化率的淀粉基食品引起了大家广泛的关注[1-2]。已有研究表明可以通过控制饮食中淀粉的消化率和血糖指数降低糖尿病并发症的风险[3]。一般而言,淀粉的消化性不仅取决于淀粉本身的结构性质,还受到食品中其他组分的性质及其与淀粉/淀粉酶相互作用的影响[4-6]。因此,控制并降低食品体系中淀粉的消化率对于设计和开发低血糖指数食品具有重要意义。
食品的多组分体系中,淀粉和蛋白质往往共存。加工过程中,蛋白质与淀粉之间存在一定的相互作用,并且蛋白质会黏附在淀粉颗粒基质的周围成为淀粉消化的屏障,这很大程度上降低了淀粉的消化率[7]。此外,蛋白质也会与α-淀粉酶相互作用降低酶的活性,阻碍淀粉酶与淀粉分子的结合,从而抑制淀粉的消化[8]。面筋蛋白作为小麦粉中仅次于淀粉的第二大宏量营养成分,主要由聚合体谷蛋白(含量30%~40%,分子质量105~107Da)和单体醇溶蛋白(含量40%~50%,分子质量3×104~8×104Da)组成[9]。谷蛋白肽链之间通过二硫键交联形成面筋蛋白网络的骨架结构,而醇溶蛋白则主要通过非共价作用力与谷蛋白相互作用,并填充在网络结构中。已有研究表明,随着面筋蛋白及其水解物的增加,淀粉的消化速率和程度逐渐下降。这主要是由于面筋及其水解物对α-淀粉酶活性的抑制作用,从而降低了α-淀粉酶与淀粉的结合程度[10]。此外,在面粉中添加额外的面筋蛋白也会降低α-淀粉酶对淀粉的水解,这主要是因为面筋蛋白会包裹更多的淀粉,及其对α-淀粉酶更强的抑制作用[11-12]。然而,目前尚不清楚面筋蛋白组分中的谷蛋白和醇溶蛋白如何与淀粉/α-淀粉酶相互作用从而影响淀粉的消化特性,这可以从组分学角度完善面筋蛋白影响淀粉消化特性的机理。
本研究旨在以小麦淀粉(wheat starch,WS)与不同面筋蛋白组分(面筋蛋白、谷蛋白及醇溶蛋白)混合物为研究对象,通过测定共混物流变特性、热特性及微观形态分布探讨淀粉-蛋白质之间的相互作用;通过测定α-淀粉酶活性以及酶分布的可视化分析α-淀粉酶-蛋白质之间的相互作用。研究这些相互作用可以进一步了解不同面筋蛋白组分对淀粉的消化机理,以期通过改变面粉中不同面筋蛋白组分的比例控制淀粉的消化率,并对低血糖指数食品的开发提供一定理论指导。
1 材料与方法
1.1 材料与试剂
WS(水分含量11.4%,蛋白含量<0.3%,直链淀粉含量18.7%,支链淀粉含量75.8%) 上海禾煜贸易有限公司;面筋蛋白、醇溶蛋白、猪胰α-淀粉酶(11 U/mg)、对羟基苯甲酸酰肼(p-hydroxybenzoic acid hydrazide,PAHBAH)、氯化钠、脲、溴化钾、异硫氰酸荧光素(fluorescein isothiocyanate,FITC)、罗丹明B 上海源叶生物科技有限公司;麦谷蛋白 日本Tokyo Chemical Industry公司。
1.2 仪器与设备
UV 2900型紫外-可见分光光度计 上海舜宇恒平科学仪器有限公司;Haake-Mars 60型流变仪 德国赛默飞世尔科技公司;Q50型热重分析仪 美国TA公司;Sephadex-DS10脱盐柱 湖北省武汉晶诚生物科技股份有限公司;FV10l型激光共聚焦显微镜 日本Olympus公司。
1.3 方法
1.3.1 淀粉-不同面筋蛋白组分共混物的制备
共混物由WS与不同面筋蛋白组分(面筋蛋白、谷蛋白及醇溶蛋白)以恒定的质量比(淀粉∶蛋白=86∶14)制备而成。然后将0.6 g样品分散于10 mL去离子水中,室温下均匀混合10 min。沸水浴处理15 min后,不同的处理组分别标记为不添加蛋白的WS、WS+面筋蛋白、WS+谷蛋白、WS+醇溶蛋白。所有样品在冷冻干燥后进行研磨粉碎处理,过80 目筛后备用。
1.3.2 淀粉消化率的测定
参考Xu Hanbin等[10]的方法并略作修改,将100 mg样品分散在10 mL 0.01 mol/L磷酸盐缓冲液中,添加猪胰α-淀粉酶(4.5 U/50 mg淀粉干基质量)混合均匀。分别在37 ℃水浴酶解5、10、15、20、30、40、60、80、100、120 min,提取200 μL等分试样与800 μL 0.5 mol/L碳酸钠溶液混合以停止酶解反应,10000×g离心3 min,取上清液。
使用PAHBAH法测定上清液中麦芽糖含量[13]。将一定质量的PAHBAH溶解在5 mL 0.5 mol/L盐酸和45 mL 0.5 mol/L氢氧化钠的混合溶液中制成质量分数为5% PAHBAH的显色剂。分别取100 μL不同质量浓度的麦芽糖溶液(31.25、62.5、125、250、500 μg/mL)与3 mL 5% PAHBAH显色剂混合,避光条件下沸水浴5 min,冷却至室温后在410 nm波长处测定吸光度,得到麦芽糖的标准曲线。样品上清液的显色方法与麦芽糖标准曲线的显色制作方法相同。通过式(1)计算上清液中的麦芽糖当量含量,以麦芽糖释放当量含量表示淀粉消化率。通过式(2)的一阶动力学方程对消化过程进行模拟。所有样品经过3 次平行测定。

式中:Ct为酶解t时的淀粉消化率/%;k/min-1为一阶动力学反应的速率常数。
1.3.3 淀粉与不同面筋蛋白组分之间相互作用力的测定为了确定淀粉和不同面筋蛋白组分之间的相互作用力,将3 g样品分散在50 mL 0.6 mol/L氯化钠或脲溶液中,将样品悬浮液在95 ℃、300 r/min糊化15 min,冷却至室温后进行流变学频率扫描[14]。具体程序为:25 ℃保持2 min,间隙1 mm,恒定应变0.1%,频率扫描范围0.1~10 Hz,记录弹性模量(G’)随频率的变化。通过式(3)计算弹性模量差值(ΔG’)的变化,反映共混物体系相互作用力的变化。

式中:为特定频率扫描下含0.6 mol/L氯化钠或脲的样品G’;在特定频率扫描下不含氯化钠或脲的样品G’。
1.3.4 淀粉-不同面筋蛋白组分共混体系热特性的测定
准确称量10 mg冷冻干燥后的样品,以10 ℃/min的加热速率从30 ℃加热至600 ℃,并以50 mL/min的流速将氮气用作吹扫气体[15]。热降解温度和质量损失率通过TRIOS v4.4.1软件进行分析计算。
1.3.5 淀粉-不同面筋蛋白组分共混体系激光共聚焦显微镜观察
按照1.3.1节步骤,制备糊化后的样品。使用冰冻切片机将样品切为8 μm的薄片组织,固定于载玻片上。使用20 μL 0.02% FITC(mg/mL)和0.025%罗丹明B(mg/mL)混合染料避光染色切片10 min,然后通过pH 7.20.01 mol/L磷酸缓冲液清洗以除去多余染液。盖上盖玻片后,倒置于激光共聚焦显微镜于放大600 倍下观察、拍照。FITC激发波长为488 nm,发射波长为518 nm;罗丹明B激发波长为568 nm,发射波长为625 nm[16]。
1.3.6α-淀粉酶活性的测定
取100 mL pH 60.2 mol/L醋酸钠缓冲液添加到50 mg的面筋蛋白、谷蛋白及醇溶蛋白中,沸水加热15 min。冷却至室温后,添加α-淀粉酶混合10 min,获得0.5 U/mL混合液A。将1 mL醋酸钠缓冲液和1 mL混合液A分别添加到20 mg糊化后的淀粉中,37 ℃下混合10 min。提取200 μL等分试样沸水浴5 min以停止酶促反应。10000×g离心3 min,测定上清液中的还原糖含量,以麦芽糖当量表示。1 U的α-淀粉酶被定义为37 ℃下从淀粉中释放1 mg麦芽糖所需酶的量[17]。
1.3.7 激光共聚焦显微镜观察α-淀粉酶与蛋白的结合
FITC标记α-淀粉酶(FITC-AA):将FITC溶解于大量的pH 9.50.15 mol/L磷酸盐缓冲溶液中,加入适量α-淀粉酶(FITC与α-淀粉酶物质的量比为10∶1),使用0.1 mol/L Na3PO4·10H2O溶液调节pH值为9.0,300 r/min转速下避光反应1 h[18]。标记结束后,使用脱盐柱将未与α-淀粉酶结合的FITC去除。将分离后得到的FITC-AA溶液冷冻保存备用。
分别称取100 mg面筋蛋白、谷蛋白及醇溶蛋白分散到10 mL磷酸盐缓冲液中混匀,沸水浴30 min。冷却至室温后,与适量的FITC-AA溶液混合,避光反应60 min。反应结束后,4000×g离心5 min,弃掉上清液,使用磷酸盐缓冲液洗涤沉淀以去除没有与蛋白质结合的FITC-AA[19]。参考1.3.5节的方法对所得的沉淀物进行激光共聚焦观察。
1.4 数据处理
2 结果与分析
2.1 面筋蛋白、谷蛋白及醇溶蛋白对WS消化性的影响
由图1A可知,所有样品消化曲线的变化趋势基本一致,淀粉消化率均在酶解60 min内迅速增大,随后趋于平缓。与纯WS相比,添加不同面筋蛋白组分后的WS在每个酶解时间的消化率均明显降低。此外,添加谷蛋白对淀粉消化的抑制作用最强,其次是添加面筋蛋白和醇溶蛋白。这意味着蛋白的存在可能是抑制淀粉酶解最主要的原因。已有研究表明[11],粉碎后的蛋白-淀粉混合样品的颗粒大小并不影响淀粉的消化速率与消化程度,这是由于面条样品粉碎后的颗粒呈块状,其平均粒径(340~580 μm)远大于面粉粒径(55~150 μm),并且观察到面筋蛋白网络也包裹着淀粉颗粒。因此,本实验中样品研磨粉碎处理对淀粉消化特性的影响基本被消除。
由图1B可知,通过消化动力学方程拟合得到的酶解120 min时的淀粉消化率(C120)与实际所得数据之间差异不大,而且只有一个速率常数。这不同于颗粒态未蒸煮的淀粉样品,它们在较高酶用量下的消化速率曲线呈现出两个阶段[12]。这说明整个消化过程可以完美拟合一级动力学方程,并且含淀粉的底物可能只包含一种特异的结构片段。这也意味着通过该消化动力学方程获得k和C120值可靠[11]。WS样品的k及C120值最大,均显著高于添加不同面筋蛋白组分的样品(P<0.05)。与WS相比,WS+面筋蛋白、WS+谷蛋白和WS+醇溶蛋白样品的C120值分别下降了39.93%、49.48%和26.61%。这与Xu Hanbin等[10]在面筋蛋白-淀粉复合体系中观察到的结果相似,他们发现添加了面筋蛋白的淀粉体系的C120值从62.2%下降到25.4%,这与面筋蛋白与淀粉/α-淀粉酶之间的相互作用有关。这些结果表明,不同面筋蛋白组分的添加显著降低了WS的消化率;并且在相同添加量下,谷蛋白对WS消化的抑制作用明显高于面筋蛋白和醇溶蛋白。有研究表明[10],蛋白质的存在显著抑制了淀粉消化率,主要归因于蛋白-淀粉/淀粉酶的相互作用;蛋白质的存在阻断了淀粉与消化酶的结合位点并形成抑制淀粉消化的物理性屏障。此外,蛋白质也会抑制淀粉酶的活性,阻碍了淀粉酶与淀粉分子的结合[12]。已有研究表明[20],蛋白-淀粉混合体系的升糖指数与淀粉消化速率和消化率呈正相关。相比于面筋蛋白和醇溶蛋白,谷蛋白对淀粉消化更显著的抑制作用可能与蛋白质的结构以及与淀粉/淀粉酶的结合强度有关。

图1 淀粉-不同面筋蛋白组分的消化曲线(A)及消化动力学方程拟合得到的k和C120(B)Fig.1 Digestograms of starch with various gluten proteins (A),and k and C120 obtained by fitting the digestion kinetics equation (B)
2.2 面筋蛋白、谷蛋白及醇溶蛋白与WS的相互作用分析
2.2.1 化学相互作用
氯化钠(一种静电相互作用破坏剂)和脲(一种氢键破坏剂)能够破坏有助于形成或维持淀粉凝胶网络结构的分子力[21]。如图2所示,与未添加氯化钠或脲的样品相比,添加氯化钠或脲后样品的G’均明显降低,这意味着凝胶体系中淀粉-淀粉或淀粉-蛋白之间的静电相互作用和氢键被破坏。然而,这并不能完全解释复合凝胶体系中淀粉与蛋白之间相互作用力的类型和强弱。

图2 添加0.6 mol/L氯化钠或脲的淀粉-不同面筋蛋白组分G’的变化Fig.2 Changes in G’ of starch with various gluten proteins added with 0.6 mol/L sodium chloride or urea
如图3所示,添加了氯化钠和脲的WS样品ΔG’值均小于0,即样品G’值降低,表明静电相互作用和氢键是维持纯淀粉糊化后凝胶形成的主要作用力。由图3A可知,在氯化钠作用下,面筋蛋白、谷蛋白及醇溶蛋白对淀粉ΔG’值的变化影响不大,这说明静电相互作用基本上不参与不同面筋蛋白组分与淀粉之间的相互作用[16]。研究发现,Na+和淀粉上带负电的羟基之间的静电相互作用可以有效减少淀粉-水和淀粉-淀粉之间的相互作用,导致弱凝胶的形成,从而降低淀粉的G’[22-23]。即使添加带正电荷的面筋蛋白组分也不会影响共混物体系中的静电相互作用,这可能是由于在热处理过程中蛋白质表面的电荷分布被改变,从而导致氯化钠处理下共混物体系的ΔG’值差异不明显。
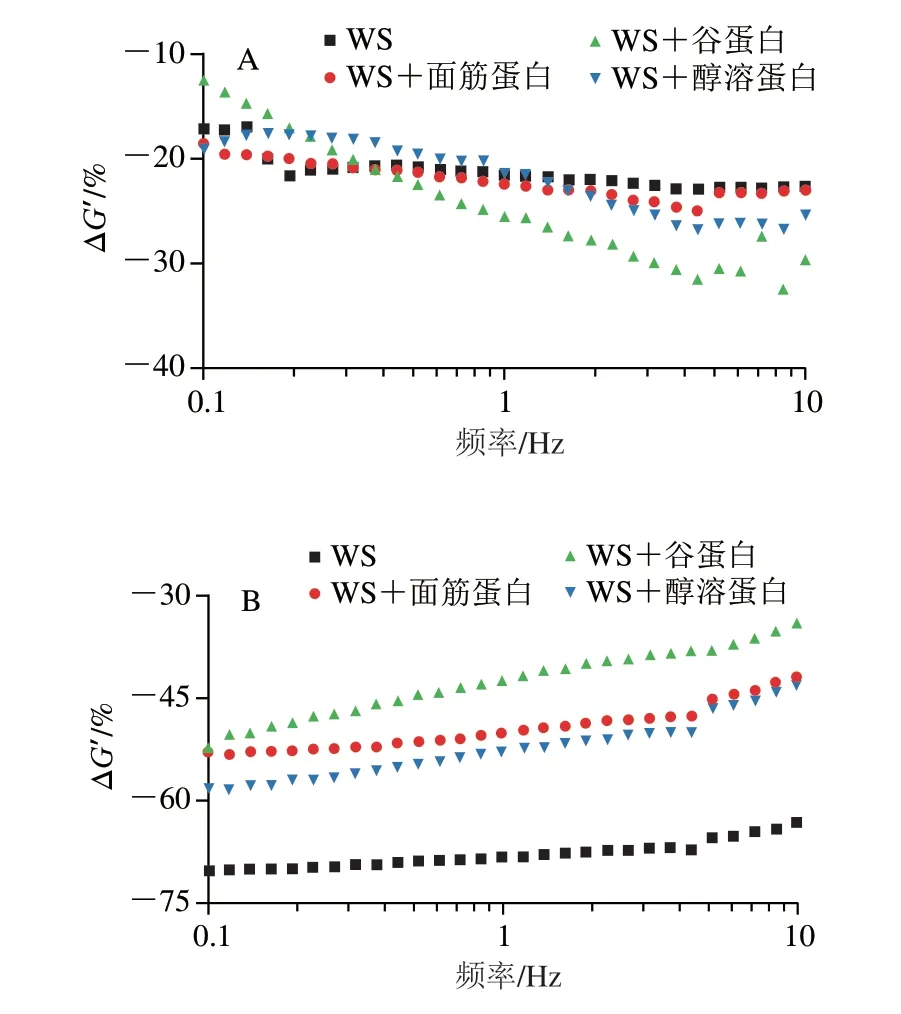
图3 添加0.6 mol/L氯化钠(A)或脲(B)的淀粉-不同面筋蛋白组分的ΔG’的变化Fig.3 Changes in ΔG’ of starch with various gluten proteins added with 0.6 mol/L sodium chloride (A) or urea (B)
由图3B可知,在脲的作用下,WS样品ΔG’值最小,其次是添加醇溶蛋白、面筋蛋白和谷蛋白的样品。这表明不同面筋蛋白组分的添加均会影响淀粉分子间氢键的强度,并且醇溶蛋白对淀粉分子链之间氢键的抑制作用最明显。蛋白质与水的相互作用及其对淀粉的包裹效应可能会限制淀粉与水的相互作用[24],这干扰了混合体系中氢键的形成,导致脲处理对共混物ΔG’值的影响比WS样品小。此外,淀粉分子上C-6位的羟基与麦谷蛋白分子侧链上酪氨酸的羰基之间可以形成氢键,谷蛋白的添加也会明显降低WS凝胶形成过程中的氢键数量[25]。相对于强疏水性且易聚集的谷蛋白,具有高黏性的醇溶蛋白也会参与到与直链淀粉的相互作用并形成更多的分子间氢键[26],从而导致在脲的作用下ΔG’值明显下降。因此,可以发现氢键在维持淀粉与不同面筋蛋白组分之间的相互作用中起主导作用,但这似乎并不能完全解释为什么添加谷蛋白会更明显抑制淀粉的消化。
2.2.2 热特性
如图4A所示,所有样品的热降解曲线的趋势类似,且均分为两个阶段。在60~150 ℃时的初始质量损失是由于自由水和结合水随温度升高而流失,在这个阶段所有样品的质量损失差异不明显。在高于150 ℃下的进一步降解主要涉及氨基酸残基中共价肽键的断裂、蛋白质分子中S—S、O—N和O—O键的断裂以及淀粉中多羟基的消除,从而导致淀粉和蛋白质的分解[27]。通过一阶导数曲线明显地观察到在300 ℃左右,样品之间的热降解质量损失差异明显,并且WS样品的热重损失最大。
根据热重分析曲线得到每个样品的降解温度,如图4B所示,WS样品的降解温度和质量损失率分别为306.52 ℃和92.46%;不同面筋蛋白组分的添加对热降解温度没有显著影响,但显著降低了质量损失率。WS+醇溶蛋白样品(88.18%)的质量损失率显著低于WS+面筋蛋白(89.79%)和WS+谷蛋白(90.64%)样品(P<0.05)。质量损失率越低,表明样品的热稳定性越好。与谷蛋白多肽链分子间的二硫键相比,热处理过程中醇溶蛋白分子内的二硫键更难断裂[28],这可能是导致淀粉-醇溶蛋白共混物的质量损失率更低的主要原因。此外,也有研究表明,淀粉糊化过程中,WS与醇溶蛋白可以通过糖苷键结合形成更稳定的复合物。糖苷键的形成有利于复合物热稳定性的提高,并且会更大程度地阻碍α-淀粉酶对淀粉的水解[29]。
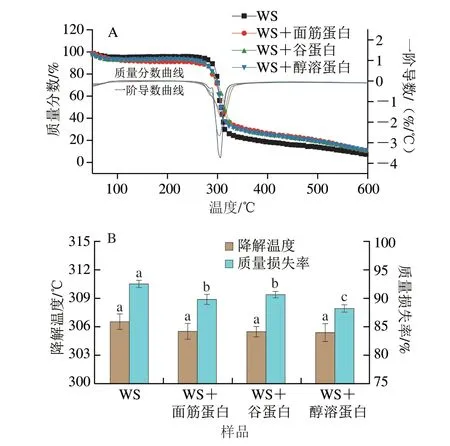
图4 淀粉-不同面筋蛋白共混物的热性质分析Fig.4 Thermal properties of starch with various gluten proteins
2.2.3 形貌特征
WS样品中(图5A)的淀粉完全糊化,并形成致密且紧密结合的结构;添加不同面筋蛋白组分后体系由不连续的淀粉基质(绿色)和密集的蛋白质(红色)组成。WS+面筋蛋白样品中(图5B),面筋蛋白主要以密集且连续的网络结构黏附在淀粉基质的周围基质,使体系结构复杂缠连;这种现象在WS+谷蛋白样品中(图5C)更为明显,这表明谷蛋白网络更大程度上促进了淀粉消化的屏障形成,这种阻碍作用被认为是导致淀粉消化降低的主要原因[30]。WS+醇溶蛋白样品中(图5D),醇溶蛋白的分布更为分散且结构更加开放,更多的淀粉并未被其完全包裹。与面筋蛋白和醇溶蛋白相比,谷蛋白致密的网络结构更不利于α-淀粉酶对淀粉的水解。
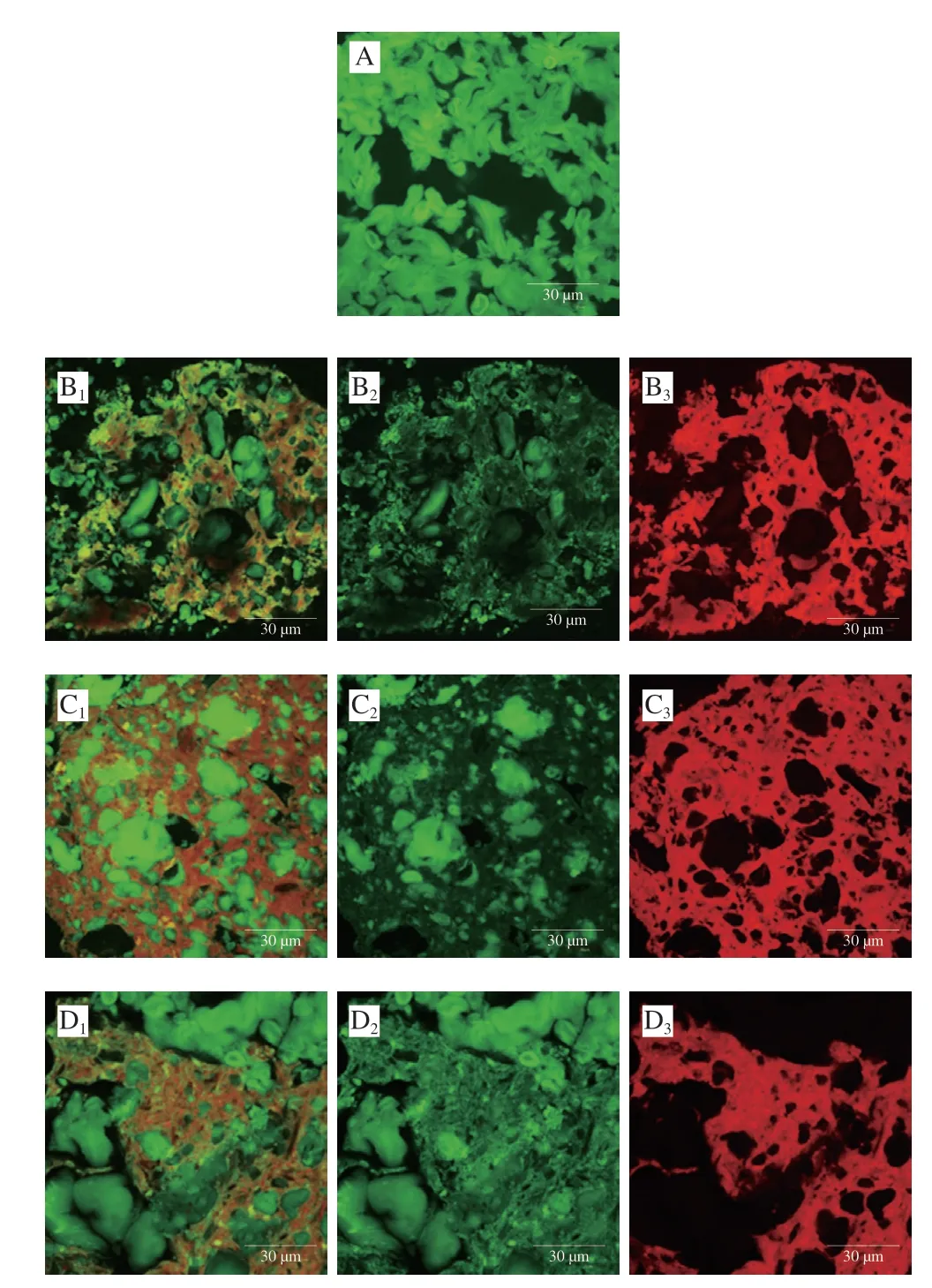
图5 淀粉-不同面筋蛋白组分共混物激光共聚焦显微镜图Fig.5 CLSM images of starch with various gluten proteins
热处理过程中,谷蛋白结构舒展,并进一步通过分子间二硫键、疏水相互作用等连接形成更加致密的网络状结构;而醇溶蛋白由于其热凝固性,变性后分散程度下降,其高黏性特征更容易导致分子间疏水相互作用而聚集[31];这是导致谷蛋白和醇溶蛋白对淀粉消化产生差异的原因。热处理后的蛋白质在体系中的结构比较致密,例如含有大量的谷蛋白,则淀粉更难被水解,这将导致淀粉的消化程度更低。之前的流变学研究发现[26],在重组面筋蛋白中增加谷蛋白的比例会使淀粉-蛋白共混体系的凝胶结构更强,而增加醇溶蛋白的比例则会产生相反的效果。面筋蛋白中,醇溶蛋白含量的增加会阻碍致密的谷蛋白网络结构的形成,从而会弱化面筋蛋白网络的强度,蛋白网络状态的改变可能会影响淀粉的消化率[32-33]。因此,相对单体醇溶蛋白,聚集的谷蛋白网络结构形成的物理性屏障可以更大程度地包裹住淀粉,降低淀粉受到酶攻击的可能性,从而延缓淀粉的酶解,这是导致淀粉-谷蛋白共混体系消化率显著降低的主要原因。
2.3 面筋蛋白、谷蛋白及醇溶蛋白与α-淀粉酶的相互作用分析
2.3.1α-淀粉酶的抑制结果
由图6可知,WS样品的α-淀粉酶的活性为0.438 U,显著高于添加不同面筋蛋白组分的样品(P<0.05)。在WS+谷蛋白样品中观察到α-淀粉酶的活性最低,为0.092 U,显著低于WS+面筋蛋白(0.101 U)和WS+醇溶蛋白(0.121 U)样品。这些结果表明,面筋蛋白、谷蛋白及醇溶蛋白均能与α-淀粉酶相互作用并降低其活性。并且,谷蛋白与α-淀粉酶的结合程度最大,强于面筋蛋白和醇溶蛋白。

图6 不同面筋组分对α-淀粉酶活性的影响Fig.6 Effect of various gluten proteins on the activity of α-amylase
不同面筋蛋白组分可能通过氢键、共轭作用和疏水作用力等与α-淀粉酶发生相互作用。有研究发现[34],蛋白分子链上的羟基可能通过氢键与α-淀粉酶的活性位点(Asp197、Glu233和Asp300)结合。同时,蛋白质分子通过电子云的离域与苯环形成更强的共轭作用,这可能会改变α-淀粉酶的构象,使淀粉不能与α-淀粉酶的活性位点结合,从而阻碍了α-淀粉酶对淀粉的水解[19]。麦谷蛋白经热处理后,蛋白内部的疏水性基团大量暴露导致分子链间的疏水相互作用增强,这很大程度上促进了α-淀粉酶与谷蛋白分子链通过疏水相互作用结合,有效抑制了α-淀粉酶活性[35]。
2.3.2 蛋白与α-淀粉酶的结合程度
如图7所示,添加面筋蛋白、谷蛋白和醇溶蛋白的样品存在明显的荧光现象,表明经过FITC标记过的α-淀粉酶与面筋蛋白、谷蛋白及醇溶蛋白之间发生了明显的相互作用,并形成了比较稳定的复合物。此外,明显地观察到谷蛋白与α-淀粉酶结合程度更大,结合的蛋白部分呈现致密的网络状态且分布更加连续;而醇溶蛋白与α-淀粉酶结合程度较低,结合区域比较分散且不均匀。这种差异可能与不同面筋蛋白结构密切相关。谷蛋白各亚基进行紧密折叠并通过芳香族侧链等疏水作用相互键合,呈现较为疏水的构象;而球状的醇溶蛋白分子间通过氢键、静电相互作用及疏水相互作用等非共价键连接,并形成稳定且紧凑的三维结构[9,34]。因此,相比醇溶蛋白,热处理后谷蛋白分子构象的改变以及在共混体系中的分散行为是与α-淀粉酶更大程度结合的主要原因,这也为解释谷蛋白对α-淀粉酶活性更强的抑制作用及其抑制机理提供了直接的证据。
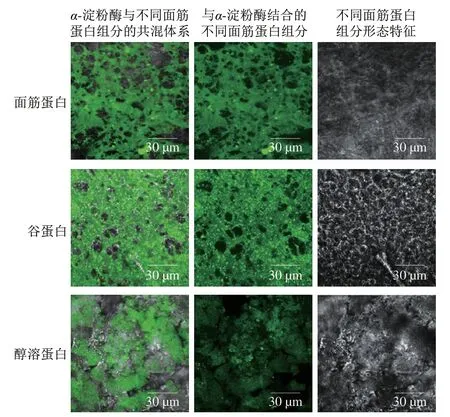
图7 FITC标记过的α-淀粉酶与蒸煮后蛋白质结合的激光共聚焦显微图Fig.7 CLSM images of FITC-labeled α-amylase bound to cooked gluten proteins
2.4 淀粉消化的抑制机理
综上所述,提出了不同面筋蛋白组分抑制淀粉消化的机理(图8)。一方面,淀粉被面筋蛋白组分包裹以形成物理性屏障(并存在一定的非共价相互作用),这抑制了α-淀粉酶与淀粉的结合,导致淀粉的消化率降低。另一方面,不同的面筋蛋白可以与α-淀粉酶结合形成复合物,抑制了α-淀粉酶的活性,从而降低淀粉的酶解效率。


图8 蛋白质影响淀粉消化特性的示意图Fig.8 Schematic diagram of the effect of gluten on starch digestion
3 结论
分析了面筋蛋白、谷蛋白及醇溶蛋白对淀粉消化的影响及抑制机理。结果发现,添加不同面筋蛋白组分后C120显著降低(P<0.05)。与添加面筋蛋白和醇溶蛋白的样品相比,添加谷蛋白样品的C120值降幅最大,为49.48%。氢键参与了淀粉-蛋白的相互作用,并提高了复合物的热稳定性。谷蛋白在淀粉周围形成的物理性屏障比面筋蛋白和醇溶蛋白更致密,这更大程度抑制了酶对淀粉的水解;此外,谷蛋白对α-淀粉酶活性的抑制率更高(约79%),与α-淀粉酶之间的结合程度更强。总之,不同面筋蛋白组分均能抑制淀粉消化,尤其是添加谷蛋白最为显著。这些结果将有助于通过改变面筋蛋白中的谷蛋白和醇溶蛋白的比例控制淀粉消化率,也为低血糖淀粉基食品的开发提供一定理论指导。

