目标导向-习惯化控制:从环路、功能到运动康复帕金森病的神经可塑性机制*
时凯旋, 王晓京, 侯莉娟
[1中国地质大学(北京)体育部,北京 100083;2北京师范大学体育与运动学院,北京 100875]
帕金森病(Parkinson disease, PD)是一种易发于老年人群的神经退行疾病,临床表现为静止性震颤、运动徐缓、肌强直和姿势步态异常等运动症状,以及情绪情感障碍和睡眠紊乱等非运动症状[1]。PD发生时,纹状体负责感觉运动控制的尾壳核(posterior putamen)内多巴胺(dopamine, DA)最先减少,导致习惯化行为(如步行)的严重缺损;PD患者逐渐依赖于背内侧纹状体(dorsomedial striatum, DMS)的目标导向控制系统驱动行为执行,运动徐缓的发生可能是习惯化控制不力和目标导向负荷过载导致[2]。
目前临床尚无有效手段治愈PD,运动康复能最大程度提高药物疗效并减少继发性损伤,从而延缓PD进程[3]。运动介导神经可塑性机制研究对运动康复在PD防治中的应用具有重要的支撑和推动作用。实验研究证实,运动干预可以调节黑质DA能和皮层谷氨酸(glutamate, Glu)能神经传导,影响突触发生,增加脑血流量,但确切机制尚未明确,这在一定程度上阻碍了运动处方的开发与发展[4]。本文聚焦于目标导向-习惯化控制双系统,扼要综述目标导向-习惯化控制控制双系统参与PD发生发展中和运动改善PD的神经可塑性机制,以期推动临床PD治疗策略的发展及对病理机制的深入理解。
1 基底神经节解剖构筑经典直接-间接通路模型
基底神经节是皮层下一系列核团的总称,主要功能与技能习得和运动控制有关。纹状体基底神经节主要的信息输入核团,内部中等多棘神经元(me-dium spiny neurons, MSNs;约占 95%)接受皮层 Glu能兴奋性输入和黑质致密部(substantia nigra pars compacta, SNpc)的DA能调控;同时发出γ-氨基丁酸(γ-aminobutyric acid, GABA)纤维投射至下游核团。MSNs依据受体表达类型可分为两类:(1)表达多巴胺1型受体的MSNs(D1-MSNs)投射纤维至黑质网状部(substantia nigra pars reticulate, SNr)和苍白球内侧部(globus pallidus internus, GPi)复合体,构成直接通路;(2)表达多巴胺2型受体的MSNs(D2-MSNs)将纤维投射至苍白球外侧部(globus pallidus externus,GPe),GPe-丘 脑 底 核(subthalamic nucleus, STN)-SNr/GPi的纤维投射构成了间接通路[5]。
经典的直接-间接通路模型于1989年由Albin等[6]首次提出,该模型认为激活直接通路会易化运动,间接通路负责运动抑制,直接和间接通路平衡维持基底神经节功能的正常执行。但新的解剖学证据显示:D1-MSNs有部分纤维投射至GPe;间接通路中,GPe的神经元不仅投射至STN,其部分侧枝纤维可投射至SNr/GPi;STN接受皮层及多个核团的投射,同时发出纤维至GPe形成突触连接,复杂的神经纤维连接打破了原有间接通路的自上而下的前馈模型[7]。此外,电生理学研究证实,DA能神经元呈现相位性(phasic)和持续紧张性(tonic)两种放电模式,相位性的放电模式与基底神经节内运动选择有关;而感觉信息诱发的紧张性放电模式为操作条件反射提供了学习信号[8]。以上证据显示,基底神经节内的神经连接和功能分区都超出了经典模型的理论范围。随后,示踪和成像技术表明,基底神经节各核团输出信号与其接受的功能信号输入高度一致,基于联合学习模式(主要为操作性条件学习)可将基底神经节划分为边缘、联想和感觉运动三大并联神经功能网络[9-10]。并联模型将直接-间接通路视为皮层-基底神经节环状网络内部的子集,该闭环网络存在高度分化的功能特征。本文主要关注基底神经节联想和感觉运动功能区,分别负责反应-结果联结和刺激-反应自动化的动态学习过程,是目标导向-习惯化双系统控制。见图1。
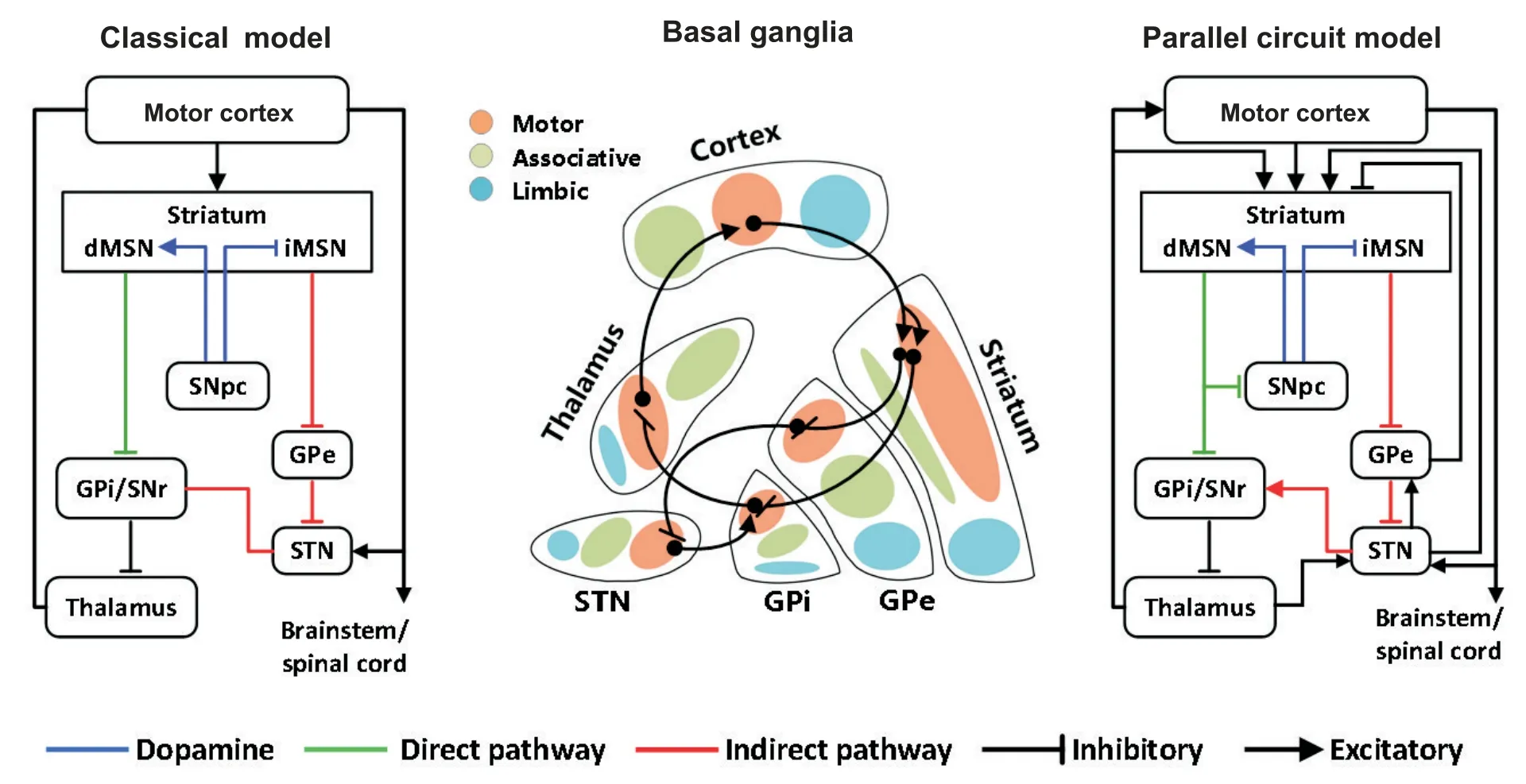
Figure 1. Classical and parallel neural pathways of basal ganglia. The classical model simplifies basal ganglia connectivity by highlighting the role of dopamine on direct and indirect pathway activity and motor output. In the healthy condition, dopamine(blue) from the substantia nigra pars compacta(SNpc) to the striatum activates direct pathway(green) and inhibits indirect pathway (red) of medium spiny neurons (MSNs). This effect decreases globus pallidus internus (GPi) output, releasing inhibition on the thalamus and cortex and promoting movement. Limbic, associative, and sensorimotor information from excitatory cortical afferents is distributed in parallel to regions of the striatum. As an example, inhibitory projections from sensorimotor striatum innervate sensorimotor regions of the GPi either directly or intermediately through the globus pallidus externus (GPe) and subthalamic nucleus (STN). Projections from sensorimotor regions of GPi then innervate the motor thalamus, which projects back to sensorimotor regions of the cortex. SNr: substantia nigra pars reticulate.图1 基底神经节经典与并联神经通路
2 基底神经节功能分区:目标导向-习惯化环路模型
目标导向行为是对行为反应与潜在结果的联结进行深入加工的动态过程,可根据结果的价值变化调整行为反应,具有高度的灵活性,但要消耗较多的认知资源,会增加工作记忆的编码负荷。习惯化行为被称为刺激-反应联结,它是对已有的刺激-反应联结进行强化,具有自动化、高效但不灵活的特征。前人的研究推动双系统控制模式理论完善,研究者提出了二者竞争和协作的多种模型[10]。
2.1 目标导向-习惯化双系统控制的协同与竞争目标导向和习惯化控制系统研究起源于心理学的刺激-反应理论与认知地图理论。刺激-反应理论认为随训练次数的增加,动物达到目标结果的时间缩短、错误率降低,增强了刺激-反应联结从而习得行为;而认知地图理论则认为个体行为习得是基于对环境认知为导向进行的反应[11-12]。两种理论的对立碰撞激发了目标导向-习惯化控制系统进行了初始研究,早期研究者基于研究范式设计了大量精巧的动物实验,能够较好的判断行为是由目标导向或习惯化控制。随着计算科学和机器学习方法的推进,研究者认为个体在对外界环境做出行为应答时,双系统能够实时密切配合、灵活切换,并基于强化理论建立了相应模型。Balleine等[13]和Ostlund等[14]的研究表明多数技能可以分解为目标导向和习惯化系统共同调控的顺序组合,Daw等[15]采用算法阐释双系统的串联工作机制,显示连接皮层和基底神经节的相关功能区域的环状结构很可能在习惯性和目标导向的行为控制模式之间的切换中发挥了关键作用。
2.2 基底神经节内的目标导向和习惯化双系统控制 Yin等[16-17]采用神经染毒或局部注射毒蝇蕈醇(GABA的激动剂)使DMS失活,结果显示动物行为反应对结果贬值不敏感,表明目标导向控制被阻断。通过过度训练建立习惯化行为后再进行结果贬值,背外侧纹状体(dorsolateral striatum, DLS)损伤组的动物对行为结果仍十分敏感,表明DLS失活后阻碍了习惯化控制的建立[16]。在示踪技术和光遗传的技术推动下,证实啮齿类动物的背内侧DMS和背外侧纹状体DLS分别接受来自前额叶皮层(prefrontal cortex, PFC)和感觉运动皮层(sensory motor cortex,SMC)的纤维束连接构筑目标导向和习惯化控制通路,是运动技能习得的神经基础[18]。
习得理论认为,成熟运动技能的形成需要经历认知、刺激-反应耦联和习惯化或自动化等三个阶段[19]。认知阶段主要激活PFC-DMS通路;刺激-反应耦联是目标导向控制向习惯化控制过渡阶段,SMCDLS通路控制占据主导地位;至习惯化阶段,动作程序启动自动化,激活SMC-DLS通路即可完成,该阶段通常占用较少认知资源[20]。运动技能习得是目标导向控制向习惯化控制过渡的过程,达到运动自动化执行的条件是过度训练,同时双系统可根据行为反应进行配合和切换。见图2。
目标导向和习惯化通路控制系统在人类、非人灵长类和啮齿类动物脑具有相同的神经基础。Balleine等[21]研究显示,人PFC和尾状核区域在执目标导向行为时血氧水平较高,如姿势转换、行为执行和认知操作;长时间的运动训练促进行为由目标导向控制转向习惯化控制,激活的脑区进而由DMS过渡至DLS。来自解剖学和影像学的研究证实,人类脑中与目标导向控制相关的脑区还包括腹内侧前额叶皮质(ventromedial prefrontal cortex, vmPFC)、眶额叶皮质(orbitofrontal cortex, OFC)、前扣带回皮质(anterior cingulate cortex, ACC)等,壳核、辅助运动区(supplementary motor area, SMA)等则直接参与习惯化行为控制[22]。
3 基底神经节目标导向-习惯化环路的紊乱与PD
PD患者出现运动障碍症状时,SNpc的多巴胺能神经元和纹状体DA含量已经发生不同程度的缺损,正电子发射断层(positron emission tomography, PET)扫描显示,DA损耗主要发生在纹状体尾部[23];人体尸检结果也证实PD患者尾壳核内DA损耗最严重,患者多表现为已习得的习惯化行为执行(或选择)障碍(如眨眼、摆臂、面部表情、步速、语速和吞咽)[24]。当习惯化控制的脑区功能障碍时,行为任务的执行将不得不依靠消耗认知资源的目标导向控制,动物实验的研究也提供了双系统失衡的直接证据。选择6-羟基多巴胺(6-hydroxydopamine, 6-OHDA)脑内注射建立单侧PD大鼠模型,过度训练后PD大鼠行为模式依然为目标导向控制,无法建立习惯化行为[25]。PD病理条件下,患者依赖慢速的目标导向控制系统处理多项任务,那么对原有的目标任务会产生干扰,这也可以解释PD患者在日常生活中的动作执行通常是缓慢的;比如,PD患者需要集中注意启动步态,一旦受到外界的刺激或新任务的影响,会出现突然停止的现象[26-27]。尽管PD患者执行习惯化运动或任务的频率、振幅和速度有所降低,但习惯化控制并未完全消失,这背后的机制可能是纹状体内剩余的DA发挥了功能[28]。
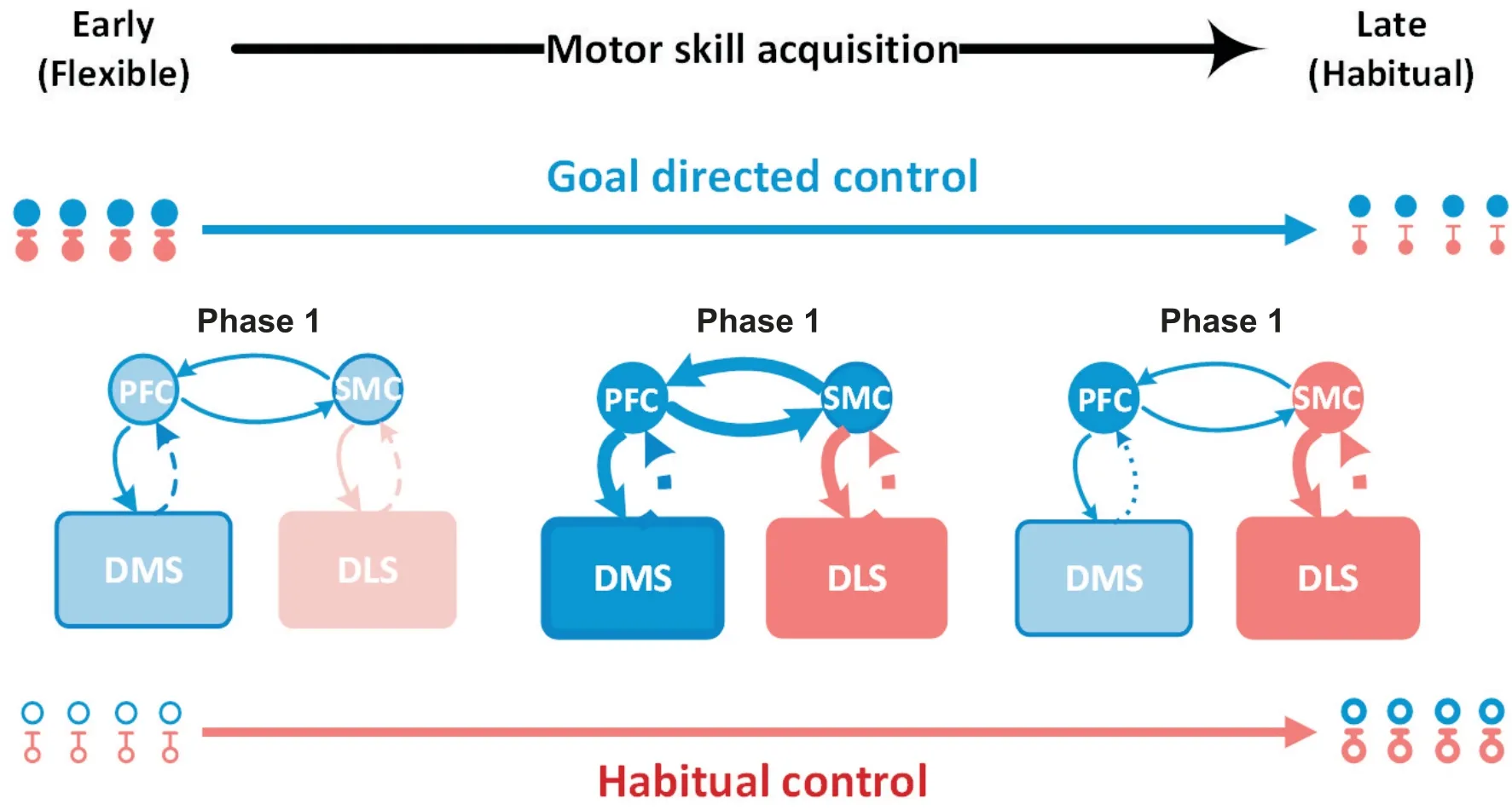
Figure 2. Intracerebral neural basis of motor skill acquisition. Early in training, most neurons in the dorsolateral striatum (DLS) region were in a resting state. At the same time, neurons in the dorsomedial striatum (DMS) region showed high excitability,suggesting that prefrontal cortex (PFC)-DMS pathway encoded the striatum as the main output signal. Automatically in training, the overall activity of PFC-DMS pathway decreased while sensory motor cortex (SMC)-DLS habitualized control took over the main motor control.图2 运动技能习得的脑内神经基础
并行的目标导向和习惯化控制环路信号会在下游的脑区交汇共同调控运动,纹状体去DA能神经支配后,目标导向系统的信号需要拮抗习惯化控制系统的强抑制作用才能有效执行动作;PD患者和动物模型基底神经节内均存在异常的信号传导,典型的是STN和GPi内神经元放电频率的增加和异常的同步振荡模式[29-31]。PD患者的影像学研究显示,SMCDMS通路的活动增强但活性下降;且技能习得过程的第二阶段,PFC-DLS通路的功能连接较正常对照组人群无减少,意味着神经控制没有从目标导向通路过渡到习惯化通路[32-33]。以上结果提示我们目标导向控制系统需克服习惯化控制系统的病理性信号才能使原有的习惯化运动得以执行,这可以解释运动徐缓的许多特征,如运动时的收缩肌的幅度和重复运动的次数均显著降低。
外科手术损毁基底神经节相应核团(如STN或GPi)可以遏制PD病情进展,其机制可能与习惯化通路的振荡的强抑制性输入减少有关,从而减轻了动作执行的负担,且不会诱发新的运动障碍[34]。深部脑刺激术(deep brain stimulation, DBS)可显著缓解PD患者运动症状,研究者认为DBS通过高频刺激压抑了习惯化通路的抑制性输入发挥治疗作用[35]。据此推测,任何能够停止或减少习惯化控制回路病理性信号的疗法,都会易化目标导向控制的执行。
4 运动与PD
运动是身体活动的一种形式,可以改变参数设置以适应身体任何一部分锻炼的需要;根据脑内神经控制通路及形式的不同,可以分为目标导向运动和习惯化运动。目标导向运动需要认知参与并且可以改变运动参数(运动间隔、重复次数、种类、难度、和练习的复杂度),习惯化运动则是不需要或很少认知参与的自动化运动,这类运动具有一定的节律性(如步行),二者均可介导脑内经验-依赖可塑性的产生[36-37]。运动康复是临床重要的非DA药理替补疗法,针对PD患者运动及认知障碍,常采用有氧运动和运动认知复合训练(即目标导向控制)两种干预手段。
4.1 运动在PD临床康复中的治疗意义 PD进程中,虽然DA损耗会导致习惯化控制部分缺损,但在疾病的早中期患者仍保留显性学习能力[27]。因此,“运动技能再习得”的康复理念即通过训练学习促进目标导向控制向习惯化控制过度,重塑运动技能。已有的证据表明,有氧运动干预有助于PD患者习惯化运动(如步态)的恢复,但相关神经控制通路功能重塑的证据不足[36-37]。
影像学结果显示,8周跑步机训练(单一有氧训练)可降低PD患者脑内SMC区的活性,同时上调纹状体背侧D2受体表达,患者的UPDRS(unified Parkinson disease rating scale)评分和生活质量均有改善,这种康复效应在停训后仍能保持一段时间[38]。采用认知参与的跑步机(目标导向运动)训练方案的研究结果表明,运动干预显著改善轻症PD患者的步态,包括速度、步长、姿势稳定、步态节奏型以及连贯性等[36,39]。但有研究结果与此相异,目标导向运动干预后,未出现显著的改善效应[40-41]。造成结果差异的原因推测可能是跑步机训练中反馈和认知参与的比重不同;另一影响因素是PD的进程,由于疾病晚期的患者存在认知障碍甚至痴呆,此时进行认知训练的效果甚微。Silveira等[42]对比了有氧运动和目标导向运动对中晚期PD患者(存在认知损伤)神经康复效应,结果显示,有氧运动对正常个体和PD患者的执行功能提升优于目标导向运动;同时,有氧运动可增强健康老年组的额叶及顶叶区的反应抑制能力。推测有氧运动干预通过调控额叶区的注意过程以避开PD习惯化运动控制缺陷,目标导向运动可能会加重运动合并认知损伤的患者脑区负担而削弱康复效应。此外,临床采用语言或本体感觉训练应用于早中期的PD患者康复以激活认知的参与,也可通过间歇训练提高注意力或加强训练动机,从而易化认知参与,以此巩固已经习得的行为[43],这意味着通过目标导向-学习系统切入重塑运动技能的康复策略在PD进程早期有望执行。总之,PD康复效应对运动处方的参数设置敏感,康复策略的制定应充分考虑PD病情、运动能力等个性化特征,阐明运动康复机制有助于为临床康复提供更精密的运动参数及多种联用的运动干预手段的开发。
4.2 运动改善PD症状的神经可塑性机制 运动疗法对PD运动和非运动功能障碍的康复效应有诸多支撑,其核心机制为运动介导的神经可塑性,即运动诱发的脑内结构和功能性的改变,包括对DA系统和非DA系统突触传导的调控及神经网络的功能重组。
运动被证实可调控PD病理进程中DA的神经传导。中等强度运动干预可显著改善黑质内线粒体电子传递效率,增加ATP合成,抑制黑质DA能神经元的凋亡[44]。多数研究者认为,运动干预对DA系统抗氧化应激的神经保护作用受运动介入时间的影响,运动介入越早且病情越轻,抗氧化应激效果越显著[45]。采用神经染毒建立啮齿类动物PD模型,证实早期中等强度的运动干预可减缓黑质DA能神经元的变性缺失及纹状体内DA的损耗,相关机制包括运动降低了DA能神经元内氧化应激反应,增加酪氨酸羟化酶(tyrosine hydroxylase, TH)和多巴胺转运体(dopamine transporter, DAT)的表达有关,最终促进DA的合成、加速DA传导产生神经保护作用[46]。运动介导的可塑性也可能是通过调控非DA能神经传导系统实现,如皮层-纹状体Glu能突触传导,Glu及其受体介导的可塑性和突触兴奋性是动作学习和执行的基础。纹状体去DA支配后,皮层-纹状体Glu能突触的过度激活影响了长时程增强(long term potentiation, LTP)和长时程抑制(long term depression,LTD)介导的学习记忆信息处理过程[1]。运动可调控PD模型皮层-纹状体突触Glu能受体及大麻素受体1(endocannabinoid receptor 1, CB1)的表达,抑制突触前Glu能过度释放及突触后兴奋毒作用,降低Glu的过度驱动以重塑皮层-纹状体通路的信息传导[47-50]。见图3。
除对突触传导的调控外,运动作用的靶蛋白还包括促进脑源性神经营养因子(brain-derived neurotrophic factor, BDNF)及胶质细胞源性神经营养因子(glial cell line-derived neurotrophic factor, GDNF)的表达,为神经元的存活、生长和突触可塑性提供营养支持。自主活动可增加大鼠小脑、纹状体、杏仁核和海马区的BDNF的蛋白表达;与此一致,身体锻炼被证实可上调健康人群及PD患者的BDNF水平[51-53]。Fontanesi等[54]研究表明,4周综合性康复(功能性、有氧和目标导向的复合训练)训练可以改善PD患者(临床分期2~3期)运动与非运动症状,同时显著上调BDNF-酪氨酸激酶B(tyrosine kinase B, TrkB)信号转导;进一步分析表明,PD患者的UPDRS得分与TrkB蛋白的上调呈现显著正相关关系,可能由此减缓疾病的进程。
运动依赖可塑性还可促进脑功能区的重组,处于病情早期的PD患者在接受了为期12周的有氧训练后学习能力显著提升,与学习相关的海马体、纹状体和小脑等脑区的激活模式呈现功能性重组,额叶皮质间的连接增强[55-56]。侵入式电生理技术采集与分析结果表明,运动可调控PD动物的锋电位(spike)和局部场电位(local field potientials, LFPs)的时-频共振的同步性,遏制SMC-DLS的异常振荡信号,从而重塑皮层-纹状体功能环路功能传导[57-58]。
综上所述,运动处方与策略对神经可塑性的产生至关重要,已有的研究在突触传导、神经调质和营养因子等水平上取得了运动介导的神经可塑性证据,但阐明运动调控目标导向-习惯化控制神经通路康复PD行为的证据不足,限制了运动处方制定时相关参数的设置,而这可能是精准个性化运动处方开发的重要突破口。
5 结语
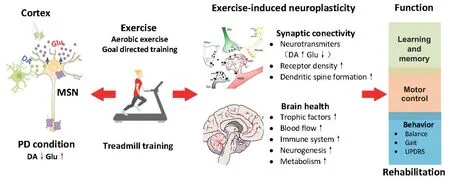
Figure 3. Motor-mediated neuroplasticity. Both aerobic exercise and goal-directed exercise reduce oxidative stress effect, promote excitation-inhibition balance of dopamine (DA)-glutamate (Glu) neurotransmitter, and enhance synaptic structural and functional plasticity by regulating neurotransmitter conduction in DA and non-DA systems. In addition, exercise improves brain health by promoting the expression of neurotrophic and anti-inflammatory factors. Motor-mediated neuroplasticity is the neural basis of Parkinson disease (PD) motor control, learning and memory, and improved behavioral performance.图3 运动介导的神经可塑性
综上所述,目标导向、有氧运动是实现PD患者临床康复的有效方法;康复效应机制涉及到运动介导神经可塑性及对执行功能、认知和学习能力的提升;神经结构与功能的重塑推动PD患者重建习惯化运动控制,其机制是技能再习得亦或目标导向的代偿控制尚未明确。动物和人体研究提供了在微观和宏观水平上评测运动康复的手段;将动物和人体测量方法和平行实验设计联系起来是阐明运动依赖神经可塑性机制的重要突破点,将有助于评估身体活动对运动和认知影响,通过结果反馈实现PD临床康复的全面化、精准化的管理。

