白术内酯III通过调节JAK2/STAT3信号通路减轻溃疡性结肠炎模型小鼠肠道损伤*
鲁慧东, 李艳梅
(1赤峰市医院消化内科,内蒙古 赤峰 024000;2内蒙古医科大学附属医院消化内科,内蒙古 呼和浩特 010110)
溃疡性结肠炎(ulcerative colitis, UC)作为一种发生于结肠的慢性非特异性炎症性疾病,发病率逐年升高,以腹泻、血便及体重减轻等为主要临床症状,肠道损伤是其病理基础,其易反复发作且难以治愈,严重困扰着患者的正常生活和工作[1-2]。目前,UC病因尚不明确,既往研究认为其可能受遗传、环境、免疫及肠道菌群等多因素影响,且若UC治疗不及时,可能增加肿瘤形成的风险[3-4]。因此,积极探究UC发病机制并开发有效治疗药物具有实际意义。
白术内酯 III(atractylenolide III, AT III)是白术根提取物中的主要生物活性化合物之一,具有抗炎和抗氧化应激等多种药理作用[5-6]。已有研究显示白术内酯III可通过激活腺苷酸激活蛋白激酶/沉默信息调节因子1/过氧化物酶体增殖物激活受体γ共激活因子-1α信号通路缓解UC中线粒体功能障碍[7]。此外,多项研究[8-9]表明,Janus激酶2(Janus kinase 2,JAK2)/信号转导及转录激活因子3(signal transducer and activator of transcription 3, STAT3)信号通路参与UC发生及病变缓解。另有研究证实白术内酯III可改善小胶质细胞JAK2/STAT3/发动蛋白相关蛋白1(dynamin-related protein 1, Drp1)依赖性线粒体分裂相关的脑缺血性损伤和神经炎症[10]。然而,白术内酯III是否可通过调节JAK2/STAT3信号通路缓解UC模型小鼠肠道损伤尚无相关报道。基于此,本研究采用葡聚糖硫酸钠(dextran sulfact sodium,DSS)诱导UC小鼠模型,探究白术内酯III对UC小鼠肠道损伤的影响及JAK2/STAT3信号通路在此过程中的作用。
材料和方法
1 动物
48只6周龄无特定病原体级健康雄性C57BL/6小鼠,体重18~22 g,购自北京北方艾特生物科技有限公司,生产许可证号:SCXK(京)2020-0005。在标准实验室条件下饲养,温度(22±1)℃,湿度45%~55%,光/暗循环12 h∶12 h,自由获取鼠粮和无菌水。所有动物都按照《实验室动物护理和使用指南》进行护理,同时本研究获得本院动物实验伦理委员会批准。
2 主要试剂
DSS(纯度99%, MP Biomedicals);白术内酯III(纯度99.91%, MCE);香豆霉素A1(一种JAK2激活剂,纯度≥95%,上海翌圣生物科技股份有限公司);苏木精-伊红(hematoxylin-eosin,HE)染色试剂盒、过碘酸雪夫(Periodic Acid-Schiff,PAS)染色试剂盒、DAB试剂盒(北京百奥莱博科技有限公司);小鼠白细胞介素(interleukin,IL)-1β、IL-4、IL-6、IL-10酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)试剂盒(南京建成生物工程研究所);兔源I抗闭锁小带蛋白-1(zonula occludens-1,ZO-1)、闭合蛋白(occludin)、JAK2、p-JAK2、STAT3、p-STAT3、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体及II抗辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗兔 IgG(Abcam)。
3 主要方法
3.1 分组、造模与给药 48只C57BL/6小鼠适应性饲养一周后,按照随机数字表法随机分为正常(normal)组、模型(model)组、白术内酯III(低、中、高)剂量(AT III-L、AT III-M、AT III-H)组和白术内酯III+JAK2激活剂(AT III+CA1)组,每组各8只。除正常组小鼠自由饮用蒸馏水外,其余各组小鼠自由饮用2.5%(2.5 g/100 mL)DSS水溶液连续7 d构建UC模型[11],随后将DSS水溶液换成蒸馏水。同时于造模第1天开始,参照文献[7,12-13]及预实验结果(白术内酯III使用剂量为5 mg/kg、10 mg/kg、15 mg/kg时,小鼠均无不良反应),白术内酯III(低、中、高)剂量组分别尾静脉注射 5 mg/kg、10 mg/kg、15 mg/kg白术内酯III,每天1次,连续7 d;白术内酯III+JAK2激活剂组同一时间尾静脉注射15 mg/kg 白术内酯III和1 mg/kg香豆霉素A1;正常组和模型组同一时间给予等量蒸馏水。
3.2 一般情况观察 实验期间,每天观察并详细记录小鼠的活动、毛发色泽、精神状态、粪便性状和隐血/便血情况以及体重变化等。并根据体重变化、粪便性状和隐血/便血情况,计算疾病活动指数(disease activity index,DAI)评分,评分标准见表1。
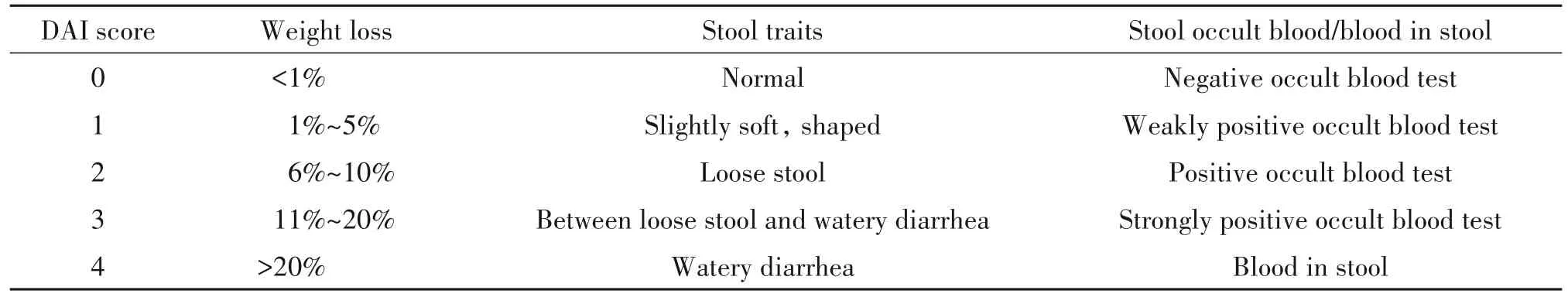
表1 DAI评分标准Table 1. DAI scoring scale
3.3 样品采集 末次给药后,禁食24 h,麻醉后脱颈处死小鼠,分离回盲部到肛门的结肠组织,测量结肠长度,并将结肠组织分成两份,一份置于4%多聚甲醛中固定;另一份置于液氮中速冻过夜,随后转移到-80 ℃超低温冰箱保存备用。
3.4 HE染色检测结肠组织病理学变化 于4%多聚甲醛中固定24 h后,将结肠组织石蜡包埋,制备成常规石蜡切片(4 μm厚),HE染色后于光学显微镜下观察结肠组织病理学变化。每张切片随机选取5个视野(高倍镜,×400),通过双盲法进行组织病理学评分(评分标准参考文献[11]所述方法),取平均值作为最终结果。
3.5 PAS染色检测结肠组织中杯状细胞 4 μm厚的结肠组织石蜡切片进行常规脱蜡和水化,加入高碘酸溶液室温孵育1 h,蒸馏水洗涤后加入Schiff溶液37 ℃孵育20 min,流水冲洗后苏木精复染2 min,盐酸乙醇分化5 s,返蓝后脱水、透明,中性树胶封片,光学显微镜下观察染色结果并拍照。
3.6 免疫组化法检测结肠组织中紧密连接蛋白ZO-1和occludin表达 4 μm厚的结肠组织石蜡切片经脱蜡和水化后,于柠檬酸缓冲液中加热10 min以进行抗原热修复,室温下用山羊血清封闭15 min后用I抗(ZO-1、occludin抗体)在4 ℃下孵育过夜,使用HRP标记的Ⅱ抗室温孵育1.5 h,DAB显色,苏木精复染,返蓝后脱水、透明、封片。每张切片随机选取5个视野(高倍镜,×400)拍照,采用Image J软件半定量分析蛋白表达,蛋白表达量以阳性蛋白所占面积表示。
3.7 ELISA法检测结肠组织中炎症因子水平 取结肠组织,制备匀浆液,BCA法对蛋白浓度进行定量,按照ELISA试剂盒说明书分别测定结肠组织匀浆液中IL-1β、IL-4、IL-6和IL-10水平。
3.8 Western blot法检测结肠组织中JAK2、p-JAK2、STAT3、p-STAT3蛋白表达 添加裂解液于冰上充分裂解结肠组织,离心后吸取上清液,BCA法对蛋白浓度进行定量。各样品取20 μg蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,随后将分离的蛋白转至聚偏二氟乙烯膜,5%牛血清白蛋白室温封闭1 h后加入Ⅰ抗(JAK2、p-JAK2、STAT3、p-STAT3、GAPDH抗体)4 ℃孵育过夜,PBS洗涤后加入Ⅱ抗(HRP标记的山羊抗兔IgG)室温孵育1.5 h,PBS洗涤后化学发光法显色。ImageJ软件分析各蛋白条带灰度值,计算目的蛋白相对表达量(GAPDH为内参蛋白)。
4 统计学处理
应用Graphpad Prism 8软件分析实验数据。数据以均数±标准差(Mean±SD)表示,多组间比较采用单因素方差分析,进一步两两组间比较采用SNK-q检验。P<0.05为差异有统计学意义。
结 果
1 白术内酯III对UC小鼠一般情况的影响
正常组小鼠活动正常,毛发有光泽,精神状态良好,粪便成形,无隐血/便血,体重呈上升趋势;模型组小鼠活动逐渐减少,毛发失去光泽,精神萎靡,部分粪便呈稀水样,粪便隐血阳性或肉眼可见便血,体重明显下降;白术内酯III(低、中、高)剂量组小鼠上述表现均存在不同程度的改善,且白术内酯III高剂量组改善最为明显;白术内酯III+JAK2激活剂组小鼠上述表现介于白术内酯III高剂量组和模型组之间。
2 白术内酯III对UC小鼠体重变化和DAI的影响
实验结束时,与正常组相比,模型组小鼠体重显著降低,DAI评分显著升高(P<0.05);与模型组相比,白术内酯III(低、中、高)剂量组小鼠体重显著升高,DAI评分显著降低(P<0.05),且呈现剂量依赖性;与白术内酯III高剂量组相比,白术内酯III+JAK2激活剂组小鼠体重显著降低,DAI评分显著升高(P<0.05)。见图1。
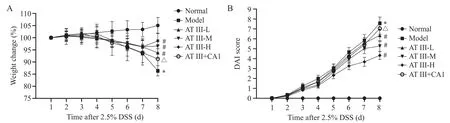
Figure 1. Effects of atractylenolide III on body weight change (A) and DAI(B) in UC mice. Mean±SD. n=8. *P<0.05 vs normal group;#P<0.05 vs model group;△P<0.05 vs AT III-H group.图1 白术内酯III对UC小鼠体重变化和DAI的影响
3 白术内酯III对UC小鼠结肠长度和组织病理学变化的影响
HE染色结果显示,正常组小鼠结肠组织结构完整且未见炎症细胞浸润;模型组小鼠肠壁结构严重破坏,腺体变形甚至消失,杯状细胞丢失,可见大量炎症细胞浸润;白术内酯III(低、中、高)剂量组小鼠上述病理损伤逐渐改善,其中白术内酯III高剂量组改善最为明显;白术内酯III+JAK2激活剂组小鼠上述病理损伤较白术内酯III高剂量组加重,见图2。与正常组相比,模型组小鼠结肠长度显著缩短,组织病理学评分显著升高(P<0.05);与模型组相比,白术内酯III(低、中、高)剂量组小鼠结肠长度显著增加,组织病理学评分显著降低(P<0.05),且呈现剂量依赖性;与白术内酯III高剂量组相比,白术内酯III+JAK2激活剂组小鼠结肠长度显著缩短,组织病理学评分显著升高(P<0.05);见表2。
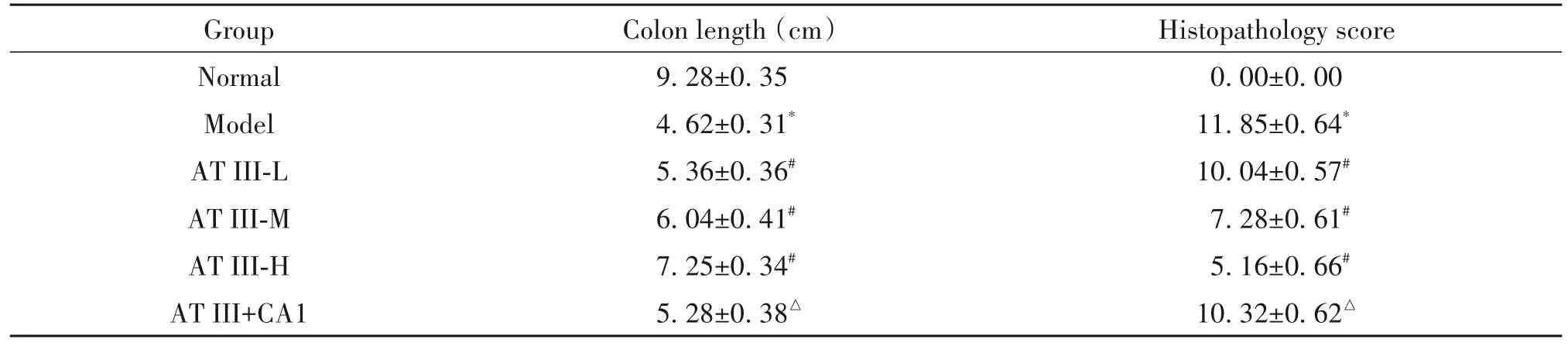
表2 白术内酯III对UC小鼠结肠长度和组织病理学变化的影响Table 2. Effects of atractylenolide III on colon length and histopathological changes in UC mice (Mean±SD. n=8)
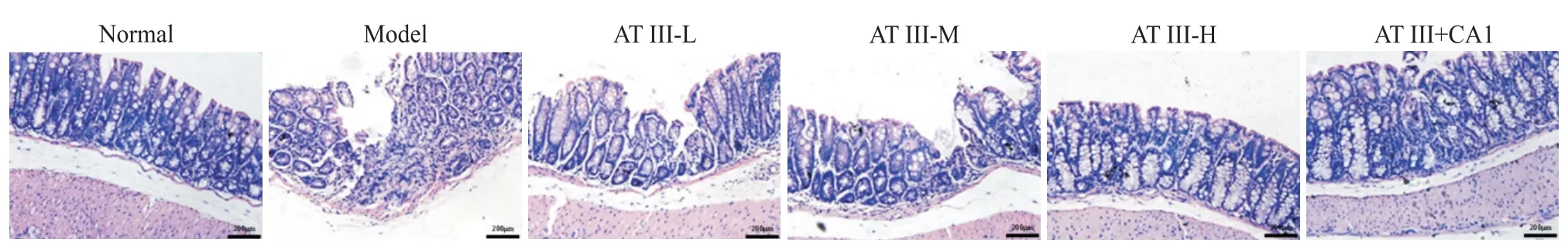
Figure 2. Effects of atractylenolide III on histopathological changes of colon in UC mice. The scale bar=200 μm.图2 白术内酯III对UC小鼠结肠组织病理学变化的影响
4 白术内酯III对UC小鼠结肠组织中杯状细胞的影响
杯状细胞位于小鼠结肠黏膜上皮和肠腺上皮之间,呈酒杯状,主要作用是分泌黏液,PAS染色可将杯状细胞中的黏液素染成紫红色。与正常组相比,模型组小鼠结肠组织中杯状细胞数量减少,颜色变浅;而与模型组相比,白术内酯III(低、中、高)剂量组小鼠结肠组织中杯状细胞数量增多,颜色加深,且白术内酯III高剂量组变化最为明显;与白术内酯III高剂量组相比,白术内酯III+JAK2激活剂组结肠组织中杯状细胞数量减少,颜色变浅。见图3。
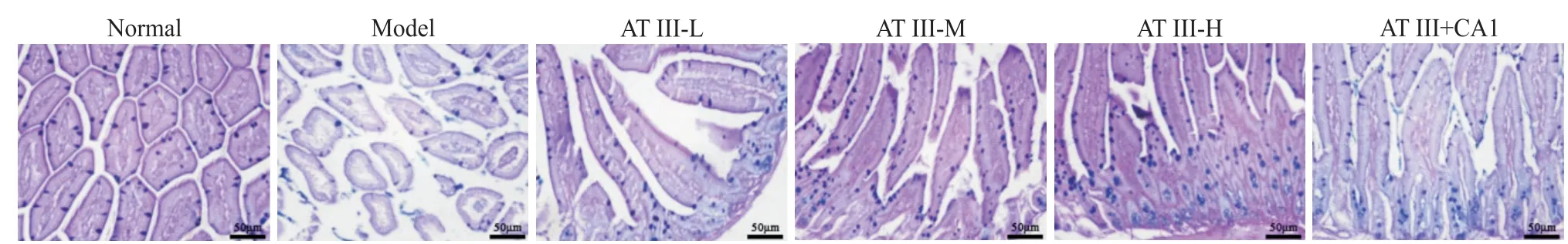
Figure 3. Effects of atractylenolide III on goblet cells in colon tissue of UC mice. The scale bar=50 μm.图3 白术内酯III对UC小鼠结肠组织中杯状细胞的影响
5 白术内酯III对UC小鼠结肠组织中紧密连接蛋白ZO-1和occludin表达的影响
免疫组化染色结果显示,ZO-1和occludin蛋白阳性在结肠组织中呈棕黄色染色,主要表达于肠上皮细胞,位于细胞质。统计学分析显示,与正常组相比,模型组小鼠结肠组织中ZO-1和occludin蛋白表达显著降低(P<0.05);与模型组相比,白术内酯III(低、中、高)剂量组小鼠结肠组织中ZO-1和occludin蛋白表达显著升高(P<0.05),且呈现剂量依赖性;与白术内酯III高剂量组相比,白术内酯III+JAK2激活剂组小鼠结肠组织中ZO-1和occludin蛋白表达显著降低(P<0.05)。见图4。
6 白术内酯III对UC小鼠结肠组织中炎症因子水平的影响
ELISA检测结果显示,与正常组相比,模型组小鼠结肠组织中IL-1β和IL-6水平显著升高,IL-4和IL-10水平显著降低(P<0.05);与模型组相比,白术内酯III(低、中、高)剂量组小鼠结肠组织中IL-1β和IL-6水平显著降低,IL-4和IL-10水平显著升高(P<0.05),且呈现剂量依赖性;与白术内酯III高剂量组相比,白术内酯III+JAK2激活剂组小鼠结肠组织中IL-1β、IL-6水平显著升高,IL-4和IL-10水平显著降低(P<0.05)。见表3。

表3 白术内酯III对UC小鼠结肠组织中炎症因子水平的影响Table 3. Effects of atractylenolide III on the levels of inflammatory factors in colon tissue of UC mice (ng/g. Mean±SD. n=8)
7 白术内酯III对UC小鼠结肠组织中JAK2、p-JAK2、STAT3及p-STAT3蛋白表达的影响
Western blot检测结果显示,与正常组相比,模型组小鼠结肠组织中JAK2、p-JAK2、STAT3及p-STAT3蛋白表达显著升高(P<0.05);与模型组相比,白术内酯III(低、中、高)剂量组小鼠结肠组织中JAK2、p-JAK2、STAT3及p-STAT3蛋白表达显著降低(P<0.05),且呈现剂量依赖性;与白术内酯III高剂量组相比,白术内酯III+JAK2激活剂组小鼠结肠组织中JAK2、p-JAK2、STAT3及p-STAT3蛋白表达显著升高(P<0.05)。见图5。
讨 论
虽然目前用于UC临床治疗的药物种类繁多,但现有的治疗手段仍无法完全治愈,多数患者须终身服药,同时也伴有一定副作用,给患者带来沉重的经济和心理负担,UC已被世界卫生组织列为现代难治病之一[14]。因此,本研究通过构建UC动物模型,旨在筛选一种治疗UC的潜在药物。
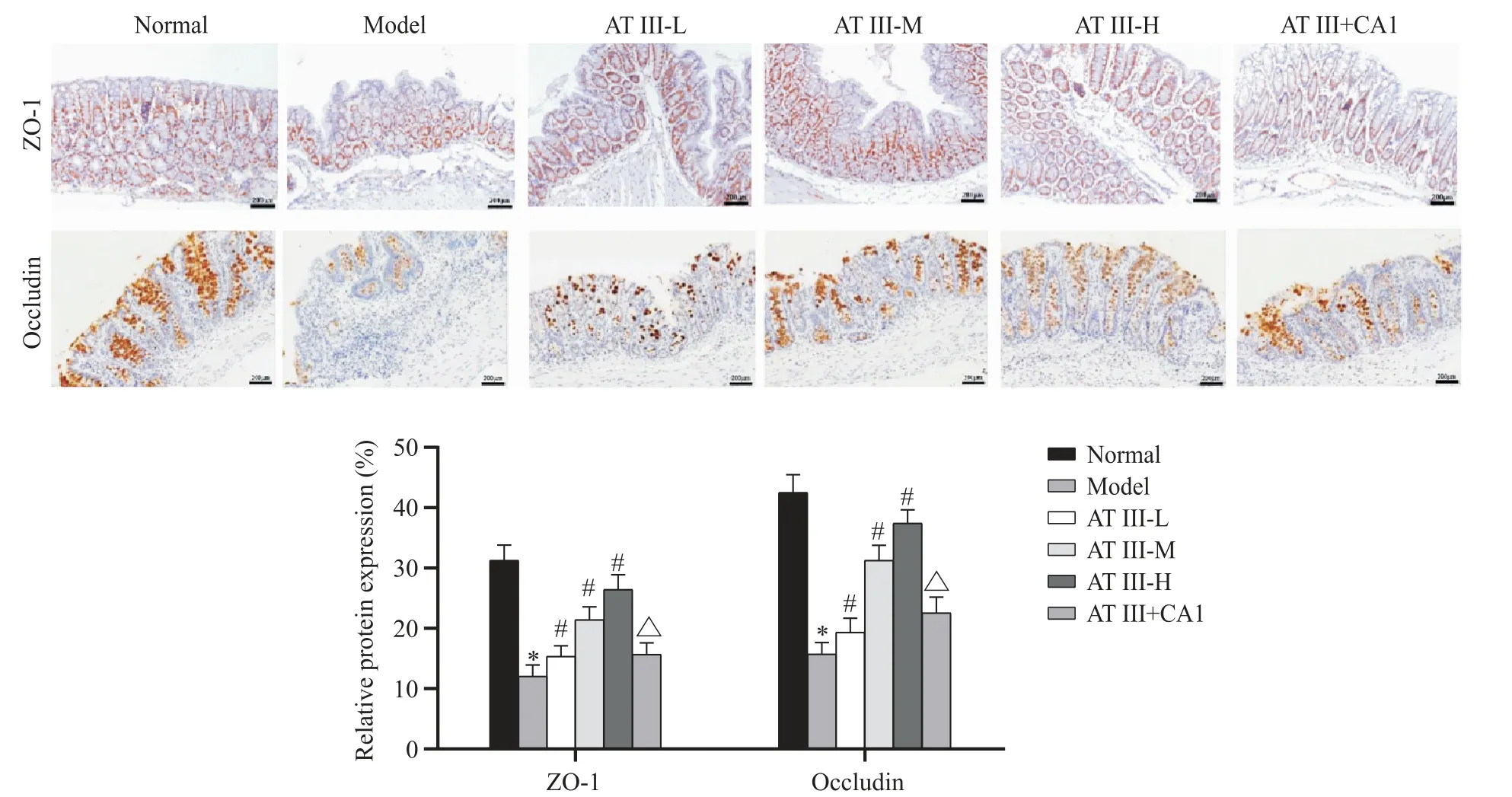
Figure 4. Effects of atractylenolide III on the expression of tight junction proteins ZO-1 and occludin in colon tissue of UC mice. The scale bar=200 μm. Mean±SD. n=8. *P<0.05 vs normal group;#P<0.05 vs model group;△P<0.05 vs AT III-H group.图4 白术内酯III对UC小鼠结肠组织中紧密连接蛋白ZO-1和occludin表达的影响
目前,国内外对UC动物模型的选择尚不统一,其中大鼠和小鼠是最常用的动物,且造模的方法也各有差异。为保证实验的稳定性和可靠性,本研究采用自由饮用2.5% DSS水溶液连续7 d构建C57BL/6小鼠UC模型,此方法简便廉价、维持性好、易于复制、成功率高、便于直观观察造模成功与否,且DSS诱导的UC类似于人类UC发病机制和临床表现[15]。本研究成功构建了UC小鼠模型,具体表现为精神萎靡,粪便呈稀水样,粪便出现隐血或便血,体重下降等现象,且DAI评分升高,结肠长度缩短,结肠组织出现明显病理损伤,与文献报道[15]一致。而本研究采用白术内酯III治疗UC小鼠后,UC小鼠的上述病变表现均存在不同程度改善,表明白术内酯III可能对UC小鼠具有较好治疗效果。
据大量文献报道,肠屏障损伤与UC的发生和进展关系密切,而紧密连接结构作为肠屏障的最重要组成部分,对于维持肠屏障的正常功能至关重要。肠屏障紧密连接结构破坏后,肠黏膜通透性增加,促使各种病原微生物和大分子物质进入机体,引起一系列炎症反应,而当炎症反应发生后,杯状细胞受损,从而减少肠道上皮细胞表面的黏液分泌,进一步增加了上皮细胞与各种病原微生物的接触[16]。ZO-1、occludin是肠屏障紧密连接结构中的重要蛋白,其表达和分布可用来判断结肠的肠屏障功能[17]。抗炎因子IL-4、IL-10和促炎因子IL-1β、IL-6在UC炎症反应中扮演着重要角色[9,18]。本研究结果显示,白术内酯III可改善UC引起的小鼠结肠组织中ZO-1、occludin、IL-4、IL-10水平下降,IL-1β、IL-6水平上升以及杯状细胞数量减少。表明白术内酯III可调节肠屏障紧密连接结构,减轻炎症反应,缓解UC小鼠肠道损伤。Han等[7]研究也证实了白术内酯III可减轻UC症状,抑制炎症和氧化应激,并恢复UC小鼠结肠上皮屏障的破坏,本研究结果与其一致。
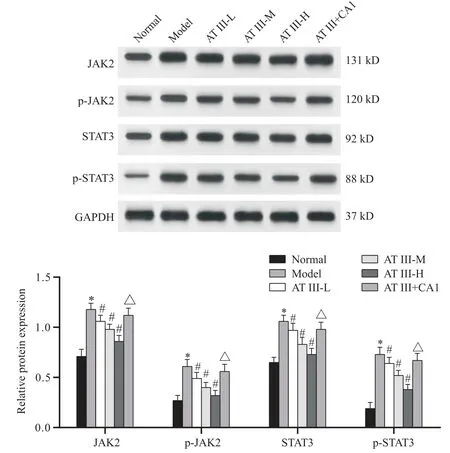
Figure 5. Effects of atractylenolide III on the expression of JAK2, p-JAK2, STAT3 and p-STAT3 proteins in colon tissues of UC mice. Mean±SD. n=8. *P<0.05 vs normal group; #P<0.05 vs model group; △P<0.05 vs AT III-H group.图5 白术内酯III对UC小鼠结肠组织中JAK2、p-JAK2、STAT3及p-STAT3蛋白表达的影响
白术内酯III的抗炎作用虽已在多项研究中得到证实,但是,其减轻炎症反应并缓解肠道损伤的机制仍很大程度上未知。因此,本研究探索了与机体炎症反应密切相关的通路—JAK2/STAT3信号通路在白术内酯III缓解UC小鼠肠道损伤中的作用。JAK2是非受体型酪氨酸蛋白酶家族成员之一,其在细胞因子和生长因子刺激作用下激活,活化后的JAK2进一步激活下游STAT3(一种脱核苷酸结合蛋白),各种靶蛋白的酪氨酸残基促使膜外刺激信号传导到细胞内后引起JAK2、STAT3磷酸化,p-STAT3转移到细胞核后调控基因转录、翻译[19]。本研究Western blot结果显示,UC小鼠结肠组织中JAK2、p-JAK2、STAT3、p-STAT3蛋白表达显著升高,提示UC诱导JAK2/STAT3信号通路激活;而白术内酯III治疗后,UC小鼠结肠组织中JAK2/STAT3信号通路激活受到抑制,表明白术内酯Ⅱ缓解UC小鼠肠道损伤,可能与抑制JAK2/STAT3信号通路激活有关。香豆霉素A1是一种JAK2信号激活剂,可激活JAK2/STAT3信号通路[20]。本研究在白术内酯Ⅱ治疗基础上给予香豆霉素A1,结果显示香豆霉素A1可激活结肠组织中JAK2/STAT3信号通路,同时减弱白术内酯III对UC小鼠肠道损伤的缓解作用,这进一步证实了白术内酯III可能通过抑制JAK2/STAT3信号通路激活缓解UC小鼠肠道损伤。既往文献也报道,抑制IL-6/JAK2/STAT3信号传导可恢复结肠组织中Treg和Th17细胞的稳态,从而减轻DSS诱导的UC[21]。
综上所述,白术内酯III能够抑制JAK2/STAT3信号通路激活,减轻局部炎症反应,缓解UC小鼠肠道损伤。本研究为UC的防治提供了新的实验依据。

