肠道菌群失调及其介导的炎症反应在失血性休克发展进程中的作用*
陈斯洁 , 赵振奥 ,2, 赵自刚 ,2△, 牛春雨 ,2△
(1河北北方学院微循环研究所/基础医学院,2河北省急危重症发病机制及干预重点实验室,河北 张家口 075000)
严重创伤患者早期的死亡率高达30%~40%,失血性休克是严重创伤患者死亡的主要原因之一。失血性休克早期,由于有效循环血量减少、交感神经兴奋,引起的血液重新分布,导致腹腔脏器的血管收缩,肾脏、肝脏、肠道低灌注,持续缺血缺氧引起主要器官发生缺血性损伤[1]。其中,肠道在失血性休克引起多器官功能障碍、结构损伤发展进程中的关键作用受到越来越多的关注[2]。肠道微生物群平衡对维持肠道内环境平衡和人类健康至关重要。在多种疾病状态下,肠道微生物群的组成发生变化,也就是肠道菌群失调,伴随着微生物转录组、蛋白质组或代谢组的变化[3]。严重创伤、休克等因素常引起肠收缩性降低、肠道微环境变化、肠粘膜功能障碍,引起肠道细菌过度繁殖、发生菌群失调,正常菌群结构破坏,细菌及其代谢物随着损伤的肠黏膜机械屏障发生移位,导致肠源性感染。同时,紊乱的肠道菌群在感染或损伤发生后失去了保护宿主的功能,甚至通过细菌代谢物或分泌蛋白,加重了器官损伤和衰竭。因此,肠道菌群失调成为创伤、失血性休克发展为脓毒症的关键因素[4]。此外,失血性休克导致的肠缺血性损伤与后续的肠道屏障受损,增加了损伤相关分子模式和炎症因子的生成与释放,肠源性炎性介质和有毒代谢产物通过肠系膜淋巴液回流到体循环,引起全身炎症反应失控和远端器官损伤[5],最终发展为脓毒症[6]。本文综述了肠道菌群失调及其介导的炎症反应在失血性休克发展进程中的可能作用,结合肠道菌群代谢物通过肠淋巴液转运至全身的事实,期望加深对失血性休克后肠道菌群失调通过肠淋巴途径参与炎症反应失控的认识,为精准靶向肠道菌群与肠淋巴液,防治重症失血性休克提供新思路。
1 失血性休克引起了肠道菌群失调
1.1 失血性休克肠道菌群的变化 肠道微生物群由来自多个界的微生物组成,包括细菌、真菌、古生菌和病毒。就细菌而言,优势菌门为拟杆菌门、厚壁菌门、放线菌门、变形菌门和疣微菌门,而梭杆菌属、糖化菌属、螺旋体属、协生菌属和嗜麦角菌属含量较低[7]。
Tian等[8]研究表明,肠道菌群失调与肠屏障功能障碍和细菌移位有关,同时发现失血性休克复苏模型模拟全身低血容量诱导的肠道缺血再灌注(ischemia reperfusion, I/R)损伤后,拟杆菌门相对丰度降低,变形菌门的相对丰度升高,厚壁菌门相对丰度出现无统计学差异的轻度下降;n-3多不饱和脂肪酸在减轻肠道I/R损伤的同时,降低了变形菌门尤其是γ变形菌的相对丰度。Zhang等[9]也发现小鼠创伤失血性休克(traumatic hemorrhagic shock, THS)12 h后变形菌门水平增加,拟杆菌门和厚壁菌门有不同程度的减少;48 h后,厚壁菌门显著增加,而拟杆菌门仍保持低水平;Tlr5-/-小鼠创伤失血性休克后未见明显变化。创伤失血性休克后,在属水平上,革兰氏阳性厌氧菌急剧下降,主要是产气荚膜杆菌属、梭菌属和别杆菌属等;革兰氏阴性大肠杆菌在THS后12 h显著增加、48 h显著降低,乳酸杆菌在THS后48 h显著增加。Duan等[10]发现失血性休克后,拟杆菌门比例明显降低,厚壁菌门相对丰度有所增加,拟杆菌门/厚壁菌门的比值明显下降。拟杆菌门中,在科水平上拟杆菌科、臭杆菌科和卟啉单胞菌科的相对丰度显著降低;在属水平上类杆菌属、酪酸单胞菌属和臭杆菌属的相对丰度显著降低;线粒体发动蛋白相关蛋白 1(dynamin-related protein 1,Drp1)基因敲除后,拟杆菌门/厚壁菌门比值增加,主要体现在拟杆菌门增加。也有研究显示,失血性休克破坏了肠道的正常菌群,盲肠内总需氧菌数量增多,表现为变形菌门的肠杆菌属过度增加,肠系膜淋巴管内皮细胞损伤;双歧杆菌预处理降低了失血性休克大鼠盲肠内总需氧菌数量,降低了肠绒毛损伤,保护肠屏障,减少了总需氧菌移位的幅度;微囊化双歧杆菌的作用较双歧杆菌更为明显[11]。持续应激是创伤后肠道微生物多样性不稳定的潜在来源,这种不稳定性可能与危重创伤患者的长期预后较差有关;THS后啮齿动物肠道菌群发生显着变化,THS后给予束缚的慢性应激,随时间推移菌群多样性逐渐增加,应激停止后菌群变化消失,表现为束缚7 d时放线菌门减少,拟杆菌属丰度增加,束缚14 d后拟杆菌属丰度仍然增加[12]。
肠I/R后,厚壁菌门和拟杆菌门相对丰度显着增加,盲肠内拟杆菌门相对丰度和相对总细菌量显着增加,疣微菌门相对丰度显着降低;拟杆菌属和狄氏副拟杆菌相对丰度增加;I/R组细菌多样性显著高于假手术组,且两组肠道微生物具有完全独立的集群[13]。临床研究显示,不同原因入院的危重病患者入住重症监护病房时,粪便中厚壁菌门和拟杆菌门的相对丰度下降,变形菌门的相对丰度上升;在属水平上,具有抗炎作用的普氏菌属大量减少,常见促炎作用的致病菌大肠杆菌和葡萄球菌增加[14]。在一项对脓毒症患者的研究中发现,微生物群落多样性减少,35% 的患者粪便中只有 1~4个细菌类群[15];其中,肠球菌丰度有不同程度的增加,并且是导致患者死亡的主要原因。数据显示,某一型肠球菌的丰度每增加一个对数单位,脓毒症死亡的概率就会增加3.14倍[16]。同样,另一项研究也显示,脓毒症患者肠道微生物群落多样性减少,以厚壁菌门为优势菌门,表现为肠球菌比例显着增加,拟杆菌门、普氏菌属和毛螺菌属比例显着降低;抗生素治疗一周内粪球菌消失,但其杀菌作用并不局限于有害菌,普氏杆菌和双歧杆菌等有益菌丰度也有所下降[17]。
综上所述,失血性休克或其他危重症,均引起了肠道菌群失调,失血性休克后肠道菌群失调的表现以变形菌门增加、拟杆菌门减少为主要特征,但在不同的失血性休克模型中厚壁菌门的变化不同,单纯肠I/R模型拟杆菌门的变化与失血休克模型相反,但相应治疗措施只要将肠道菌群恢复正常,即可发挥良好的效果,见表1。
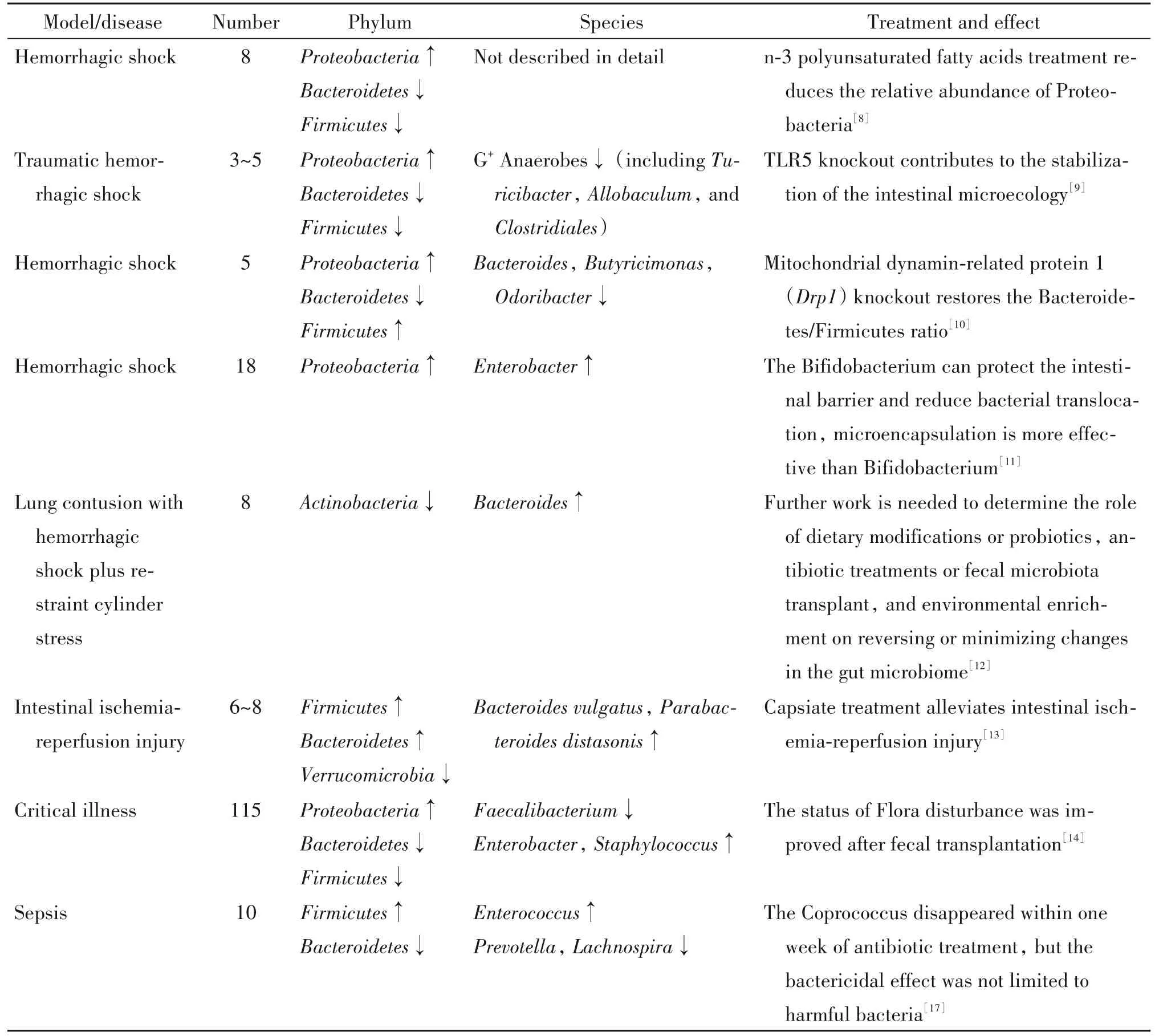
表1 失血性休克与危重病后肠道菌群失调的表现Table 1. The manifestation of gut microbiota dysregulation following hemorrhagic shock and critical illness
1.2 失血性休克肠道菌群代谢物的变化 肠道微生物群可产生多种重要的生物活性化合物,称为肠道微生物群-宿主共代谢物,与宿主形成共代谢关系,参与各种生理活动的调控,如代谢、营养和免疫等,包括氨基酸、葡萄糖和胆汁酸代谢[18-19]。常见肠道菌群代谢物有:短链脂肪酸(short-chain fatty acid,SCFA)、酰胺c18、苯甲酰氯、胞嘧啶和N,N-二甲基精氨酸、3-2-羟基丙基棕榈酸酯[20]、硫胺素、次黄嘌呤、L-苯丙氨酸、酪胺、吡哆醇[21]等。其中,酰胺c18、苯甲酰氯、胞嘧啶和N,N-二甲基精氨酸与梭状芽胞杆菌和布鲁氏菌的相对丰度呈正相关;3-2-羟基丙基棕榈酸酯与梭状芽胞杆菌呈正相关;硫胺素与别样棒菌属的相对丰度呈正相关;L-苯丙氨酸与红蝽菌科、螺杆菌、消化链球菌科、毛螺菌科的相对丰度呈正相关;酪胺与多尔氏菌属、苏黎世杆菌属的相对丰度呈正相关;吡哆醇与瘤胃球菌属、红蝽菌科的相对丰度呈负相关。这些代谢物不仅存在于肠组织,还可分布于细胞外液中。因此,通过检测这些代谢物的水平,在一定程度上能够反映肠道菌群的分布或变化情况。
肠道微生物群调节宿主健康的作用主要由SCFA介导,其主要成分是乙酸、丙酸和丁酸,它们是结肠组织中含量最丰富的SCFA,对肠上皮紧密连接和肠屏障功能具有保护作用[22],并参与肠道、神经、内分泌等多个组织或系统的功能调节。失血性休克后,小鼠SCFA产生减少,与结肠组织中SCFA产生菌如类杆菌属、酪酸单胞菌属和臭杆菌属的数量明显减少有关,也与L-谷氨酰胺、维生素E等菌群相关代谢物的量和活性减少有关,进而影响了酪氨酸、泛醌和谷氨酸的代谢途径,引起了肠屏障功能障碍[10]。Slaughter等[23]评估了单独组织损伤、复合组织损伤、失血性休克大鼠血浆中的400多种代谢物,与单独组织损伤相比,复合组织损伤与失血性休克大鼠血浆中乳酸、烟酰胺、次黄嘌呤、酮体羟丁酸、SCFA、长链脂肪酸、花生四烯酸、谷氨酸等代谢物增加,精氨酸、尸胺、中链脂肪酸减少。其中乳酸[24]、烟酰胺[25]、次黄嘌呤、SCFA、长链脂肪酸[26]、花生四烯酸[27]、谷氨酸[28]、精氨酸[29]、尸胺[30]都与肠道菌群相关。此外,值得注意的是,单独组织损伤就已经引起了脂肪酸代谢紊乱,尤其是单不饱和脂肪酸和多不饱和脂肪酸,单不饱和脂肪酸以肉豆蔻酸和棕榈酸增加、硬脂酸减少为主,多不饱和脂肪酸以亚油酸酯和亚麻酸增加为主。肠I/R后,肠道菌群代谢物辣椒素酯(capsiate, CAT)生成减少,补充CAT治疗显著减轻了肠道I/R导致的铁死亡,进而减轻了肠缺血再灌注损伤[13]。这些研究表明,失血性休克等严重疾病导致肠道菌群代谢物出现不同程度的变化,进而参与了肠损伤与屏障功能障碍的发生过程(表2)。
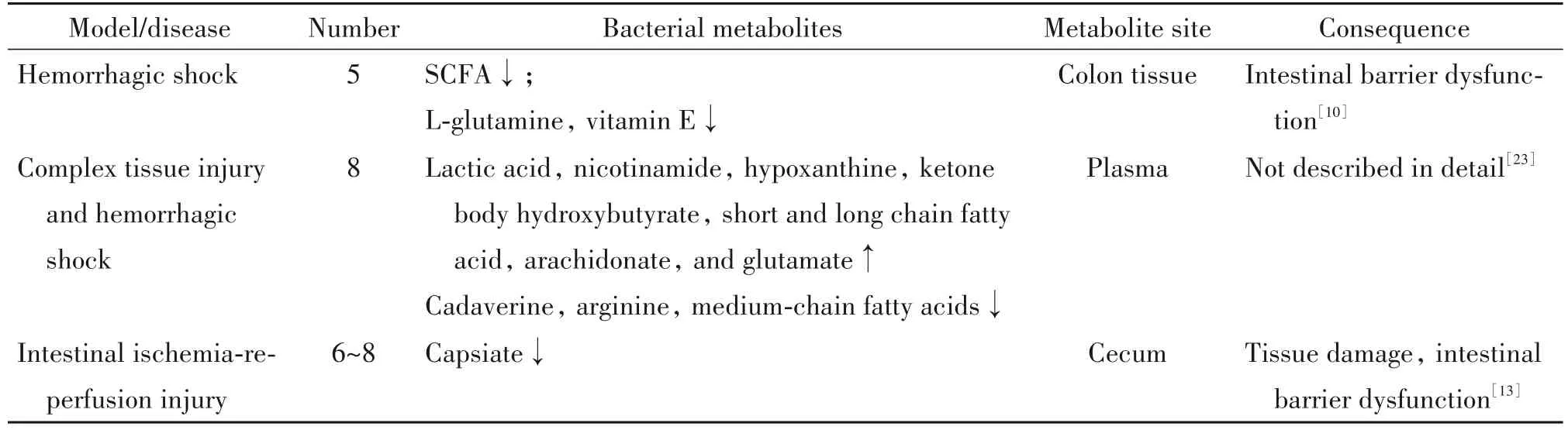
表2 失血性休克与危重病后肠道菌群代谢物的变化Table 2. The changes of gut microbiota metabolites following hemorrhagic shock and critical illness
1.3 肠道菌群失调参与炎症反应的发生发展 一般来说,宿主通过模式识别受体(pattern-recognition receptors, PRRs)实现对病原体的监测功能。PRR家族识别病原体衍生基序或宿主衍生的细胞应激和损伤标记,分别称为病原体相关分子模式(pathogen-associated molecular patterns, PAMPs)和损伤相关分子模式(damage-associated molecular patterns, DAMPs),进而引起固有效应分子的产生[31]。微生物群定植抗性的急性丧失导致变形菌门的大肠杆菌和肺炎克雷伯菌、革兰氏阳性菌如肠球菌和金黄色葡萄球菌、真菌结合PRR并激活炎症小体,引起炎症反应[32]。
肠道微生物或其代谢产物与PRRs的相互作用在炎症反应的发生发展中具有重要作用。肠上皮细胞表达最具特征的PRRs主要有两种受体:Toll样受体(Toll-like receptors, TLRs)和核苷酸结合寡聚化结构域样受体(nucleotide-binding oligomerization domain-like receptors, NLRs),它们可以触发多种趋化因子、细胞因子和先天免疫效应因子的表达[33]。
TLRs识别微生物相关分子,如鞭毛蛋白、细菌脂多糖和单链双链RNA,从而启动对病原体的免疫反应,尽管大多数TLRs存在于细胞表面,但识别细菌和病毒核酸的TLRs在细胞内。所有的TLRs都通过髓样分化初级反应蛋白88(myeloid differentiation primary-response protein 88, MyD88)依赖途径触发下游信号,进而激活丝裂原活化蛋白激酶(mitogen-activated protein kinases, MAPKs)和核因子 κB(nuclear factor-κB, NF-κB)转录因子[34],从而激活IL-1β、IL-6和 TNF-α 的表达,引起炎症反应[35,36]。肠道菌群拟杆菌门和厚壁菌门的代谢产物SCFA主要通过TLR4途径抑制促炎因子IL-1β、IL-6、TNF-α的反应[24]。
NLR可识别多种细菌配体和毒素,以及PAMP和DAMP[37]。NOD1是NLR家族(位于胞质)中的一个成员,在结构上包含一个caspase募集结构域(caspase recruitment domain, CARD),一个位于中心的核苷酸结合寡聚结构域,以及多个C端富含亮氨酸的重复序列。NOD1通过识别革兰阳性和革兰阴性菌中的二氨基吩甲酸和胞壁二肽,NOD1与受体相互作用蛋白2(receptor-interacting protein 2, RIP2)相互作用,从而激活IκBα激酶(IκB kinase, IKK)复合体,活化并释放NF-κB,启动炎症反应[38]。
总之,多种致病因素引起的肠道菌群失调,通过PRR识别失调的菌群及其代谢物,经过上述途径激活MAPK、NF-κB释放IL-1β、IL-6和TNF-α等炎性细胞因子,引起炎症反应,参与了这些致病因素引起炎症反应失控的过程。尽管肠道菌群失调介导的炎症反应在失血性休克发展进程中的作用还没有明确的实验证据,但失血性休克可以引起肠道菌群失调,且肠道菌群失调参与炎症反应发生过程是明确的,因此,我们有理由相信,肠道菌群失调可能是失血性休克全身炎症反应失控的重要发生机制之一。这也需要我们在今后的研究中持续关注。
2 肠淋巴液与肠道菌群
2.1 淋巴液与肠淋巴液 淋巴液由细胞外液与组织细胞代谢产物、凋亡细胞、细胞碎片和循环免疫细胞结合而成[39]。淋巴液直接来源于实质器官组织间液,由于组织间液直接接触实质器官的细胞层,因此淋巴液可以反映器官特定的代谢特征,是分析实质细胞代谢或分解代谢产物的最佳介质[40]。研究认为,失血性休克后肠系膜淋巴液(post-hemorrhagic shock mesenteric lymph, PHSML)回流与器官功能障碍与结构损伤有关,肠淋巴管结扎或淋巴液引流可减轻肺损伤、肾损伤或心肌功能障碍[5,41-42],因此解析病理状态下肠淋巴液的成分对于揭示肠淋巴液回流引起器官损伤的发生机制,显得尤为重要。
2.2 菌群失调对肠淋巴液成分的影响 随着科学技术的进步,学者们应用蛋白质组学、基因组学和代谢组学等多种组学技术进行PHSML的成分分析,希望从中找到差异组分,并以此深入研究PHSML回流引起器官损伤的作用机制。研究显示,PHSML中的可溶性因子造成内皮细胞损伤的作用与肠道菌群有关[43],肠道菌群失调可以改变肠淋巴液的生物活性物质的组成。D'alessandro等[44]搜集了枪伤、头部创伤、摩托车事故和上吊死亡等事故导致的创伤失血性休克、脑死亡和淋巴损伤患者的肠系膜淋巴液,发现存在潜在细菌来源的代谢物,如柠檬酸盐。此外,在所有患者体内都检测到了甘露醇,由于人类不合成甘露醇,且体外研究发现只有大肠杆菌菌株能参与甘露醇的代谢[45]。因此,我们猜测肠淋巴液成分中存在细菌代谢物,肠淋巴液转运参与了细菌代谢物的转移。Mittal等[46]首次报道了PHSML中245种蛋白质的研究结果,其中60种蛋白质的相对丰度显著增加,并且发现这些显著增加的蛋白质与糖酵解或糖异生的代谢过程有关。尽管他们没有提及这些差异代谢物与肠道菌群的关系,但由于肠道菌群与糖酵解的紧密关系,所以我们相信肠道菌群失调极可能会引起PHSML的成分变化,这些成分应该参与了PHSML损伤作用的诸多发生机制。最近研究显示,失血性休克大鼠在发生肠道菌群失调(厚壁菌门中的布劳特氏菌属和梭杆菌门中的梭杆菌纲降低)的同时,PHSML中反映肠道菌群失调的代谢产物随之发生了变化,表现在与布劳特氏菌属减少呈负相关的代谢物对氨基苯甲酸含量增加,与梭杆菌纲呈负相关的代谢物D-葡萄糖醛酸含量增加(未发表数据),结果表明菌群失调引起了肠淋巴液成分变化。尽管如此,目前对于肠道菌群失调影响肠淋巴液生物活性成分变化的研究相对较少。今后,我们应加强PHSML与肠道菌群失调代谢物的相关研究,这对于揭示PHSML的病理生理意义具有积极作用。
2.3 菌群失调引起肠淋巴液成分变化的病理生理意义 肠道菌群失调是发生肠源性细菌、内毒素移位引起肠源性感染、进而导致失控炎症反应和器官功能障碍的基础。在这一过程中,肠淋巴途径与肠淋巴液成分变化,发挥着重要作用[5]。创伤失血性休克继发的糖、蛋白质和核苷酸高分解代谢标志物在淋巴液中积累,如琥珀酸、5-羟脯氨酸和乳酸等,这些代谢物可导致凝血障碍、中性粒细胞活化,从而引发急性肺损伤[44]。琥珀酸作为细胞外介质,通过G蛋白偶联受体GPR91发出信号,诱导树突状细胞(dendritic cell, DC)迁移,并与TLR协同产生以IL-1β为代表的促炎细胞因子[47-48]。此外,最近有研究发现NLR家族CARD结构域蛋白4(NLR family CARD domain containing protein 4, NLRC4)在感染性休克小鼠中高水平表达,NLRC4沉默抑制了NLR途径激活,表现为 NOD1、NOD2、RIP2和 NF-κB 低表达,通过降低IL-1β、IL-6和TNF-α水平减轻炎症反应;抑制NLRC4表达,可抑制DC膜上CD80、CD86和MHCⅡ表达,进而抑制DC成熟,并减轻了感染性休克导致的肺损伤和炎症反应[49]。在机体遭受热应激或急性胰腺炎引起肠道菌群失调及后续肺损伤与炎症反应的过程中,阻断肠系膜淋巴管减少肠淋巴液回流可降低炎症反应,改善肺功能,注射有益菌代谢产物丁酸也发挥了类似的作用,说明肠淋巴途径是肺损伤“肠-肺”轴的一个关键环节[50]。总体来看,目前还没有失血性休克后菌群失调及其代谢产物变化通过PHSML转运引起炎症反应失控的直接证据,但考虑到菌群失调及其代谢产物参与炎症反应的事实,加之肠道菌群失调引起了肠淋巴液成分的变化,我们推测PHSML中发生变化的成分可能通过前面提及的多种途径,激活MAPK和NF-κB等炎症信号通路,释放炎性细胞因子,引起炎症反应,进而参与器官功能障碍与结构损伤的发生过程。这将是今后急危重症与肠道微生态相关研究的重点内容之一。
3 总结与展望
综上所述,失血性休克引起了肠道环境与菌群结构变化,进而出现菌群代谢物的变化;肠道菌群失调与代谢物变化参与了肠损伤与肠屏障功能障碍的发生过程;这些在数量上发生变化的代谢物通过损伤的肠屏障进入肠系膜淋巴管,引起肠系膜淋巴液的成分发生改变,进一步通过肠淋巴循环转运进入体循环,通过炎症反应等一系列作用引起肺以及其它器官功能障碍与结构损伤。但是,目前还没有明确研究显示,具体是哪些或者哪类肠道菌群代谢物经肠淋巴液回流引起肺损伤。因此,应加强失血性休克肠道菌群变化及其代谢物在肠淋巴液中的研究,这对于揭示失血性休克肺损伤的肠淋巴机制、明确“肠-淋巴-肺”轴在失血性休克发展进程中的病理生理意义、并以此探析防治重症失血性休克的新策略,具有重要意义。

