ClC-3氯离子通道对高分化鼻咽癌细胞突起形成的影响*
张海峰, 李春英, 陈丽新 , 王立伟△
(1西安交通大学基础医学院病理学系,陕西 西安 710061;2丽水学院,浙江 丽水 323000;3暨南大学基础医学与公共卫生学院生理学系,广东 广州 510632)
细胞体积过度变化会破坏其结构完整和内环境稳态从而影响其生存;细胞容积调节广泛参与各种细胞功能,是细胞基本的生命活动之一[1-2]。突起形成是细胞局部体积可控性增大的过程,在多种膜成分(包括离子通道)参与下,以微丝或微管骨架蛋白为结构基础的细胞变形过程,在细胞迁移、细胞黏附、细胞通讯以及吞噬作用等中起着关键作用[3-4]。
容积调控性阴离子通道(volume-regulated anion channel, VRAC)是一类具有种属、组织细胞差异性的复杂功能蛋白。电压门控氯通道3(voltage-gated chloride channel 3, ClC-3)被认为是VRAC候选蛋白之一,在多种肿瘤组织中异常表达和(或)功能上调,与其他相关蛋白共同调控肿瘤细胞增殖、凋亡和迁移等[5-8]。
细胞膜边缘形成突起是驱动细胞移动的关键步骤,课题组前期研究成果显示:ClC-3不依赖其VRAC通道特性能促进迁移细胞的片状伪足前缘褶皱形成,可诱导角蛋白18磷酸化从而介导β1-整合素向片状伪足前缘褶皱处转运,有助于肝癌细胞迁移;阻断ClC-3通道功能,不能抑制片状伪足前缘褶皱形成,但可抑制肝癌细胞迁移[8-9]。这些结果提示,分布于迁移细胞片状伪足亚区域的ClC-3借助其VRAC和非VRAC特性发挥着不同作用。
细胞贴壁生长时伸出突起,对于黏附培养基质维持其生长至关重要。ClC-3能影响细胞迁移时片状伪足的形成,而在细胞贴壁生长时伸出突起中的作用尚不清楚。因此,本研究拟以高分化鼻咽癌细胞系CNE-1为研究对象,探讨ClC-3对细胞贴壁生长时伸出突起的影响,有助于深入理解局部细胞容积调节机制。
材料和方法
1 主要试剂
ClC-3抗体购自Abcam;β-actin抗体购自武汉博士德生物工程有限公司;Alexa Fluor 488标记的山羊抗兔IgG、辣根过氧化物酶标记的山羊抗兔IgG、辣根过氧化物酶标记的山羊抗鼠IgG、细胞核染料DAPI、氯离子荧光探针MQAE、细胞膜染料DiI、RIPA裂解液和BCA蛋白定量试剂盒购自上海碧云天生物技术有限公司;LipofectamineTM2000转染试剂和化学发光试剂盒购自Thermo Fisher。
小干扰 RNA(small interfering RNA, siRNA)由上海吉玛制药技术有限公司合成。经高效液相色谱法分离后再行电泳检测,siRNA的5'端携带FAM荧光标记物。阴性对照(negative control, NC)siRNA的序列为 5'-UUCUCCGAACGUGUCACGUTT-3',ClC-3特异性siRNA的序列为5'-CAAUGGAUUUCCUGUCAUATT-3'。
2 主要方法
2.1 细胞培养及转染 CNE-1细胞购自湖南湘雅典型培养物保藏中心[10],用含新生牛血清、青霉素和链霉素的RPMI-1640细胞培养液,常规培养在5%CO2、100%湿度、37 ℃的培养箱内。细胞悬液种于6孔细胞培养板内,待细胞融合率达到30%~50%,按照以下简要步骤转染细胞:不含血清和抗生素的培养 液 分别 稀 释 LipofectamineTM2000(1∶40)和 20 μmol/L siRNA(1∶20);室温孵育5 min后,将上述悬液混合,再孵育20 min;将siRNA和LipofectamineTM2000混合溶液逐滴缓慢滴加到各组实验孔内,各组siRNA终浓度为100 nmol/L;细胞继续培养4~6 h后换正常培养液,待转染48 h行后续实验。
2.2 免疫荧光 CNE-1细胞悬液种于内贴无菌圆形盖玻片(直径6 mm;面积28.26 mm2)的24孔细胞培养板中,待细胞过夜培养或贴壁后,4%低聚甲醛溶液固定细胞15 min;PBS洗涤细胞6次后,0.5%Triton X-100孵育细胞5 min;PBS洗涤细胞6次后,采用10%血清室温下封闭细胞45 min;用1%血清洗涤细胞一次,4 ℃过夜孵育ClC-3稀释抗体;1%血清洗涤细胞6次后,室温下孵育稀释Ⅱ抗1 h;PBS洗涤细胞6次后,DAPI染细胞核5 min;最后PBS洗涤细胞3次后,50%甘油碳酸盐缓冲液封片,指甲油封边。在Nikon C1-Si激光共聚焦显微镜下,观察荧光标记并拍照。
2.3 Western blot siRNA转染CNE-1细胞48 h后,RIPA裂解液(含终浓度为1 mmol/L的蛋白酶抑制剂PMSF)冰上裂解细胞30 min,4 ℃离心(9 720×g)裂解液后收集上清液;BCA法测定各组蛋白质浓度并标准化为相同浓度,加入适量5×蛋白上样缓冲液,煮沸5 min使蛋白质变性。12% SDS-PAGE分离蛋白,每个泳道上样量不少于40 μg;半干法将凝胶中蛋白转移到硝酸纤维素膜上;室温下,5%脱脂奶粉溶液封闭膜2 h后,4 ℃过夜孵育Ⅰ抗,TBS洗脱未结合或非特异结合的Ⅰ抗;室温孵育辣根过氧化物酶标记的Ⅱ抗2 h后,TBS洗脱未结合或非特异结合的Ⅱ抗;采用化学发光法显示硝酸纤维素膜上目的蛋白,Alliance 4.7凝胶成像系统采集图像并进行灰度分析。
2.4 氯离子荧光探针检测 MQAE荧光染料最大激发波长约为355 nm,最大发射波长约为460 nm,其荧光强度随着氯离子浓度的增加而成比例减小[11]。因未配备波长355 nm左右激光模块,拟采用408 nm激光激发MQAE,分析其发射光谱特性后用于测定细胞内氯离子。
常规胰酶消化CNE-1细胞后种于共聚焦显微镜专用培养皿内,待细胞贴壁后更换含5 mmol/L MQAE的细胞培养液,继续在37 ℃培养箱内孵育1 h ;采用408 nm激光激发MQAE,采集415~570 nm区间发射光光谱数据,观察不同波长的荧光强度特征,并进行拟合计算其最大发射光波长。408 nm激光激发含不同浓度 Cl-溶液(0、1.25、2.5、5、10、20、40、60、80、120和140 mmol/L),采集各组最大发射光荧光强度,绘制浓度-荧光强度曲线,与前期研究结果比较。
CNE-1细胞贴壁生长12 h待其伸出突起,更换含5 mmol/L MQAE的细胞培养液后继续孵育1 h;接着,膜荧光DiI染料室温染色10 min,洗脱干净后放入培养箱平衡30 min;而后在激光共聚焦显微镜下,用408 nm激光和515/30滤片组观察MQAE荧光在细胞内的分布情况。
2.5 单通道膜片钳 CNE-1细胞悬液滴在无菌圆形盖玻片(直径22 mm;面积379.94 mm2)上过夜培养,待细胞长出突起后,将盖玻片放置灌流槽内,持续灌流等渗液(70 mmol/L NaCl、0.5 mmol/L MgCl2、2 mmol/L CaCl2、10 mmol/L HEPES 和 140 mmol/L D-甘露醇)。采用EPC-7型膜片钳放大器(Heka)和CED1401型数模/模数转换器(Cambridge Electronic Design)钳制膜电位并记录电流,其步骤如下:含有等渗灌流液的玻璃微电极入水并调节液接电位;三维操纵仪操控微电极使其尖端轻压细胞,在吸管内施加负压,使吸管尖端与记录膜片表面形成GΩ级封接(giga-seal)并补偿电容;等渗液持续灌流,按预先设置的指令电压±20、±40、±60、±80、±120和0 mV循环钳制膜电位,记录电流;分析电流特性并计算电流密度,计算公式为:电流密度(pA/pF)=细胞电流值(pA)/细胞电容(pF)。
3 统计学处理
采用SigmaPlot 12.5统计软件进行数据分析。数据均采用均数±标准误(mean±SEM)形式表示。组间均数比较采用t检验或单因素方差分析。以P<0.05为差异有统计学意义。
结 果
1 ClC-3在CNE-1细胞突起局部分布明显
体外培养的永生化鼻咽上皮细胞和低分化鼻咽癌细胞分别呈长梭形或多角形,而CNE-1细胞贴壁生长时会向多个方向伸出明显的突起。为探讨ClC-3在细胞膜伸出突起中的作用,我们首先分析了ClC-3蛋白在CNE-1细胞中的分布情况。如图1所示,贴壁生长的CNE-1细胞朝不同方向伸出片状伪足,其上有数量不等的丝状伪足;Alexa Fluor 488荧光标记抗体识别ClC-3蛋白呈绿色,ClC-3主要定位于细胞膜和细胞质,少量分布在细胞核,且在细胞膜分布有明显聚集特性,即细胞膜突起形成部位较多。
2 氯离子荧光探针检测CNE-1细胞氯通道活动
为观察CNE-1细胞膜突起处ClC-3通道活动,利用MQAE荧光染料检测该部位氯离子浓度,以探讨氯通道活动。如图2A、B所示,CNE-1细胞孵育MQAE染料后,利用408 nm激光激发后收集MQAE发射光光谱数据,各细胞最大荧光强度的发射光波长均在520 nm左右;对19个发射光谱数据进行拟合计算,得到最大发射光波长的理论值为521 nm(图2C)。接着,利用408 nm波长激光和515/30 nm滤片组测定不同浓度氯离子(1.25~140 mmol/L)的MQAE荧光强度,浓度-荧光强度曲线显示:荧光强度随着氯离子浓度的增加而减小(图2D)。
CNE-1细胞贴壁生长伸出突起后,MQAE和DiI荧光染料分别孵育细胞后,在激光共聚焦显微镜下观察细胞突起处MQAE荧光。如图2E~G所示,408 nm激光激发MQAE后呈绿色荧光,胞体荧光强度不均一;DiI标记胞膜脂质呈红色荧光,可见片状伪足及丝状伪足的MQAE荧光弱,而胞膜伸出片状伪足起始处的MQAE荧光强(片状伪足根部)。
3 吸附式单通道膜片钳记录CNE-1细胞突起部位氯通道活动
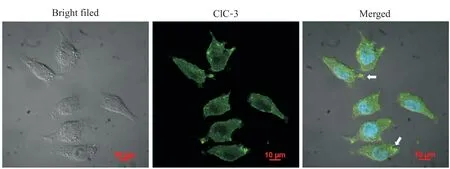
Figure 1. Identification of ClC-3 in well-differentiated nasopharyngeal carcinoma CNE-1 cells (scale bar=10 μm). The CIC-3 protein in CNE-1 cells was labeled with Alexa Fluor 488 (green), and cellular nuclei were stained with DAPI. The white arrows showed ClC-3 clustering in the protrusion of the cell membrane.图1 免疫荧光标记高分化鼻咽癌细胞ClC-3氯通道
如图3所示,在倒置显微镜下,记录微电极吸附突起根部胞膜并形成GΩ级封接;去极化电位能诱使单通道开放频率增加,在-120 mV钳制电压下,该通道电导约为78.4 pS;依据电流-电压关系,计算出该电流的翻转电位为4.06 mV,其值远离钠离子和钾离子平衡电位,接近氯离子平衡电位。
4 下调ClC-3表达抑制CNE-1细胞突起形成
为探讨细胞突起形成中ClC-3蛋白的作用,观察下调ClC-3蛋白表达对CNE-1细胞突起形成之影响。FAM标记的NC siRNA和ClC-3siRNA转染CNE-1细胞24 h后,在激光共聚焦显微镜下观察到几乎所有细胞都带有绿色荧光(图4A)。流式细胞术结果显示,NC siRNA和ClC-3siRNA组转染率均大于90%(图4B)。ClC-3siRNA转染CNE-1细胞48 h后,Western blot结果显示ClC-3蛋白表达量显著降低(图4C)。
CNE-1细胞悬液种植于细胞培养板,待其贴壁后行siRNA转染;转染6 h时,对照组、NC siRNA组以及ClC-3siRNA组细胞向多方向伸出明显突起,包括片状伪足和丝状伪足;转染30 h时,胰酶消化细胞至突起消失时即刻终止消化,细胞变圆无伪足;继续培养细胞至48 h,对照组和NC siRNA组细胞伸出明显的片状伪足,ClC-3siRNA组细胞无片状伪足伸出,而3组细胞均有数量不等的丝状伪足形成(图5)。
讨 论
细胞膜突起形成是典型的局部细胞容积调节。机体发育、免疫应答、伤口愈合、肿瘤侵袭转移等过程中,细胞膜边缘突起并形成片状伪足是驱使细胞移动的关键步骤;在神经突起生长过程中,神经元胞体在特定部位伸出轴突和树突的第一步亦是胞膜形成突起;细胞在体内、外生长时,伸出突起是细胞粘附基质或探测外界信号,从而维持其生长的策略[12-14]。
VRAC分布广泛,参与多种生理和(或)病理生理过程,然而其分子本质却一直存在争议。由先天性丙种球蛋白缺乏症患者分离出的含富亮氨酸重复蛋白8A (leucine-rich repeat-containing 8A, LRRC8A)[15],被认为是VRAC的主要组分[16-17]。但并非所有组织细胞的容积调节皆由LRRC8A介导,例如:bestrophin 1蛋白在小鼠视网膜色素上皮细胞缺乏表达,而人视网膜色素上皮细胞却依赖其进行容积调节[18];囊性纤维化跨膜电导调节因子CFTR参与小肠上皮、呼吸道上皮的细胞容积调节,以及anoctamin 1通道蛋白是外分泌腺、脉络丛等处细胞容积调节的主要参与者[19];人表皮样癌KCP-4细胞缺乏VRAC氯电流并不取决于LRRC8A的低表达;TTYH1和(或)TTYH2介导胃癌SNU-601细胞、肝癌HepG2细胞、结肠癌LoVo细胞VRAC氯电流,不依赖LRRC8A表达[20]。可见,VRAC分子本质具有多样性。
本课题组前期已证实ClC-3是介导鼻咽上皮细胞及鼻咽癌细胞VRAC电流的主要成分,参与细胞增殖、凋亡等[5-6,21]。ClC-3促进鼻咽癌细胞G1-S期过渡,与其影响cyclin D1、CDK4/6及CDK抑制因子p21/p27表达有关[22],且 cyclin D1/CDK4或6可通过磷酸化调控ClC-3通道功能[5]。鼻咽癌细胞凋亡早期,ClC-3蛋白表达短暂上调[6,23];紫杉醇诱导的聚合微管蛋白可持续激活ClC-3通道开放,促进肿瘤细胞发生凋亡性容积减小[6]。
迁移细胞前缘伸出片状伪足,是局部体积可控性增大的过程。阻断ClC-3蛋白表达或功能,可明显抑制肿瘤细胞、子宫内膜细胞、表皮干细胞等多种类型细胞的迁移[24-28]。ClC-3参与迁移细胞片状伪足前缘褶皱的形成,从而促进肝癌细胞迁移[8-9]。这些提示ClC-3在细胞膜伸出突起形成片状伪足过程中具有一定作用。本研究下调CNE-1细胞ClC-3蛋白后,观察到细胞无片状伪足伸出,而有数量不等的丝状伪足形成,说明ClC-3参与贴壁细胞生长时片状伪足的形成,而对丝状伪足的形成影响可能较小。
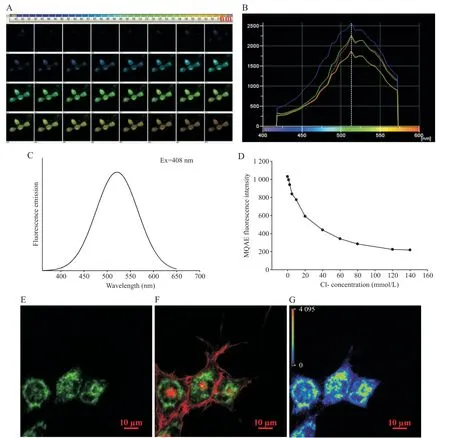
Figure 2. Activities of chloride channels detected by chloride sensitive fluorescent probe MQAE in CNE-1 cells. A: images of fluorescent emission spectrum of MQAE excited by the 408 nm laser; B: curves of intensity and wavelength for the MQAE fluorescent emission spectrum of the 4 representative CNE-1 cells; C: the calculated curve of intensity and wavelength for the MQAE fluorescent emission excited by the 408 nm laser (19 cells); D: the curve of Cl- concentration (1.25~140 mmol/L)and fluorescence intensity of 515/30 nm emission excited by the 408 nm laser (n=4 to 6); E: fluorescent image (scale bar=10 μm) of Cl- detected by MQAE (green) in CNE-1 cells; F: merged image (scale bar=10 μm) of Cl- fluorescence and cell membrane fluorescence stained by DiI(red); G: pseudo-color image (scale bar=10 μm) of MQAE fluorescent emission corrected using the Nikon NIS-Elements AR software.图2 氯离子荧光探针检测CNE-1细胞氯通道活动
细胞贴壁生长时伸出突起与迁移细胞突起形成的生物学意义不尽相同,但二者形态变化相似,均是局部体积可控性增大的过程。ClC-3和水通道3(aquaporin-3, AQP-3)可形成蛋白复合体,协同调控鼻咽癌细胞调节性容积减小过程;此外,在CNE-1细胞突触处,我们观察到大量ClC-3位于AQP-3后方[29-30]。鉴于二者在细胞容积调节中相互作用,其在突触处的典型分布对突起形成有何意义,尚待进一步阐述。
本研究结果显示细胞突起延伸部位MQAE荧光弱,Cl-浓度高,而突起根部MQAE荧光强,Cl-浓度低;活跃的ClC-3通道蛋白在突起根部大量聚集,可能是导致该部位Cl-浓度低的主要原因之一;从细胞突起一侧至突起根部,存在着Cl-浓度梯度差。ClC-3在突起膜分布较少,Cl-可从高浓度的突起侧扩散至低浓度突起根部,ClC-3通道开放致Cl-外流,并带动由突起前缘进入的水分子外流,从而调控细胞膜局部延伸形成突起或伪足。
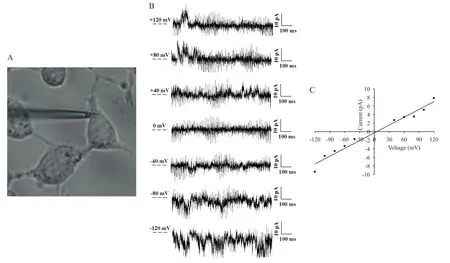
Figure 3. Activities of chloride channels recorded by single-channel patch-clamp of the cell-attached model in the protrusions of CNE-1 cells. A: the protrusion root of the CNE-1 cell was attached and sealed by the recording pipette filled with the isotonic solution (×200); B: the typical traces of Cl- currents of a single channel at the clamped voltage of 120, 80, 40, 0, -40, -80 and -120 mV; C: the current-voltage relationship of a single chloride channel (n=7).图3 吸附式单通道膜片钳记录CNE-1细胞突起部位氯通道活动
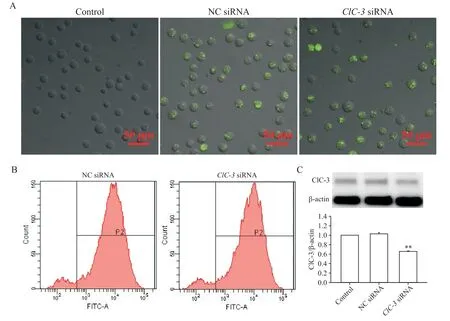
Figure 4. Down-regulation of ClC-3 protein expression by small interfering RNA(siRNA) in CNE-1 cells. A: CNE-1 cells were observed under laser confocal microscope (scale bar=50 μm); B: the transfection efficiency of NC siRNA and ClC-3 siRNA in CNE-1 cells detected by flow cytometry; C: the protein expression of ClC-3 in CNE-1 cells down-regulated by siRNA was assayed by Western blot. Mean±SEM. n=4. **P<0.01 vs NC siRNA group.图4 小干扰RNA下调CNE-1细胞ClC-3蛋白表达
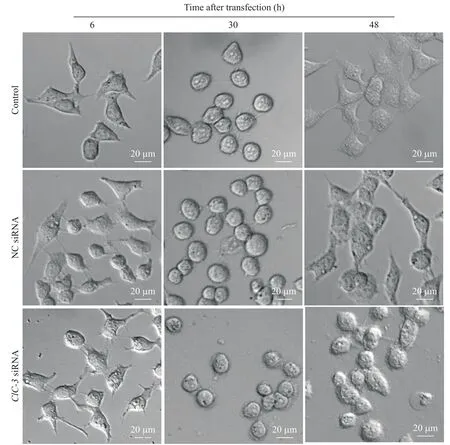
Figure 5. Down-regulation of ClC-3 inhibited the formation of CNE-1 cell protrusions (scale bar=20 μm). The columns from the left to the right showed the images of CNE-1 cells transfected with siRNA for 6, 30 and 48 h, respectively. The cells were digested by trypsin in the 30 h column.图5 下调ClC-3蛋白抑制CNE-1细胞突起形成
综上所述,ClC-3通过参与细胞突起部位Cl-浓度梯度差的维持,从而调控细胞片状伪足的形成,是其调控细胞生长的可能途径之一。然而,在细胞膜突起延伸形成片状伪足的过程中,ClC-3和AQP-3协同机制亟待进一步探讨。

