HOXB7对结直肠癌细胞侵袭、迁移和EMT作用及机制的研究*
唐潇潇, 汪 源, 李婷婷
(南方医科大学南方医院病理科,广东 广州 510510)
结直肠癌(colorectal cancer)是当今世界威胁人类健康的一大癌症,转移是导致结直肠癌患者死亡的主要原因[1-2]。上皮-间充质转化(epithelial-mesenchymal transition, EMT)在结直肠癌远处转移的过程中扮演了重要的角色。EMT是细胞失去上皮特性而获得间充质细胞特性的过程,这一过程在正常机体中通常发生于发育和伤口愈合中,但在肿瘤中则与肿瘤的发生、进展、迁移、血管内渗入和远处转移等各重要过程密切相关,它减弱细胞间黏附作用,增强肿瘤细胞的侵袭力[3-4]。同源盒蛋白B7(homeobox protein 7, HOXB7)属于同源异型盒家族。同源盒基因首先在果蝇体内被发现,是在包括人在内的动物的胚胎发育和细胞分化中发挥重要作用的一类基因。许多证据显示,HOX基因表达紊乱可能在肿瘤等疾病中发挥重要作用;目前已知其在黑色素瘤、卵巢癌、乳腺癌、口腔癌、前列腺癌等肿瘤中有异常表达[5],且与肿瘤的分级和分化有关。近年来,多个研究对HOXB7在肿瘤中的作用进行了分析,发现HOXB7在肿瘤细胞的增殖、运动和侵袭中起到重要作用。本研究探讨HOXB7对结直肠癌转移的影响。
材料和方法
1 细胞
SW480和SW620结肠腺癌细胞株为南方医科大学病理教研室自存。
2 主要试剂
胰蛋白酶购自Gibco;琼脂糖购自Biowest;胎牛血清和RPMI-1640培养基购自HyClone;EDTA抗原修复液(pH 6.0)、PBS和通用型SP试剂盒(SP-9000)购自北京中杉金桥生物技术有限公司;pSUPER.puro质粒购自Oligoengine;Dual-Luciferase Reporter Assay System (Promega)。
3 主要方法
3.1 细胞培养 细胞用含10%胎牛血清和1%双抗(含1×105U/L青霉素和100 mg/L链霉素)的RPMI-1640培养基,在37 ℃、5% CO2相对湿度饱和的培养箱内常规培养。
3.2 过表达HOXB7的SW480细胞株的构建 根据GenBank中已登录的目的基因HOXB7序列,使用Primer Premier 5软件辅助自行设计引物,上游引物5'-CCCAAGCTTATCAAGGAATCTCGTAAAACCGA-3',下 游 引 物 5'-ATTGCGGCCGCCCATCCTTTAGATACACACAGA-3'。使用该引物在提取的RNA中反转录得到cDNA,与pSin质粒连接。最终将HOXB7/pSin质粒转入SW480细胞。
3.3HOXB7特异性shRNA的合成 利用Invitrogen网站(http://rnaidesigner.invitrogen.com/rnaiexpress/)提供的免费软件设计合成HOXB7基因的特异性干扰片段,shRNA正义链5'-CGGAGCCTTCCCAGAACAAACTTCT-3',反 义 链 5'-GGAGCCTTCCCAGAACAAACTTCTT-3'。用Hind III和BglII对 shHOXB7重组质粒进行双酶切鉴定。选择对数生长期细胞制备SW480细胞和SW620细胞悬液及shRNA-Lipofectamine™ 2000 Reagent复合物的实验组(HBOX7干扰组)和阴性对照组,将shRNA连接到pSUPER.puro质粒然后转染SW480细胞和SW620细胞。
3.4 Transwell小室实验检测HOXB7对SW480和SW620细胞迁移和侵袭的影响 用PBS洗去细胞完全培养基残液后,换成RPMI-1640培养基进行饥饿培养过夜,将胰酶消化的SW480和SW620细胞经无血清的RPMI-1640培养基重悬,调整细胞密度为1×106mL-1,并将其 200 μL 混悬液接种至 Transwell上室。迁移实验和侵袭实验中,下室都加入800 μL含有10%胎牛血清培养基,在侵袭实验中Transwell上室还预铺有基质胶。在37 ℃、5% CO2培养箱中培养24 h,去除小室中培养液,用棉球轻擦去小室上室的细胞。使用4%多聚甲醛固定小室和下室15 min,PBS润洗3次,每次5 min;Giemsa染色30 min,PBS润洗3次,每次3 min,在倒置显微镜下计数,并采集倒置的小室下室的细胞图像。
3.5 细胞划痕实验检测HOXB7对SW480和SW620细胞迁移的影响 取对数生长期细胞接种到6孔板中,在恒温孵箱中培养,等细胞长满视野时进行后续实验。使用黑色马克笔于6孔板背后划线。使用高温灭菌的20 μL枪头在孔板上垂直于线划痕,保证枪头划痕时垂直。划好后充分冲洗,将残余悬浮细胞冲洗掉。然后向孔内加入不含胎牛血清的细胞培养基,置于恒温孵箱孵育。分别于24和48 h后在显微镜下取点,观察,拍照。与0 h的初始距离(D0h)作对比,分别测量细胞迁移的距离,计算细胞的迁移率。迁移率(%)=(D48h-D0h)/D0h×100%。
3.6 Western blot检测蛋白表达 用放射免疫沉淀测定裂解液提取各组细胞的总蛋白,测定蛋白浓度后,取等量蛋白样品进行SDS-PAGE、转膜,5%脱脂奶粉室温下封闭膜2 h后,分别加入兔抗人HOXB7、E-cadherin、α-catenin、vimentin、N-cadherin、Snail和α-tubulin抗体4 ℃孵育过夜。加入HRP标记的抗兔、抗鼠Ⅱ抗室温孵育1 h后加入化学发光试剂孵育1 min,迅速用保鲜膜包好后置于暗盒内曝光1 min左右。X胶片经显影、定影后扫描记录。
3.7 免疫荧光染色 将经泡酸,洗涤,高压后的盖玻片放入24孔板内消化细胞,调整细胞浓度调整1×105mL-1,按每孔1 mL细胞悬液加入预先铺好盖玻片的24孔板中,入37 ℃、5% CO2湿化培养箱内孵育,待细胞生长至约90%,取出,洗涤,4%多聚甲醛固定过夜。每孔按实验计划加入E-cadherin、α-catenin、vimentin、N-cadherin、Snail和α-tubulin抗体,摇床上室温过夜。加入相应的荧光Ⅱ抗,室温,摇床上1 h。洗涤,吸掉液体,吹风机吹干,滴加2 μL 50%甘油与载玻片上,将盖玻片的细胞面朝下,倒扣在载玻片的甘油上,标记,置于共聚焦显微镜下观察拍照。
3.8 裸鼠体内实验 将SW480/vector细胞、SW480/HOXB7细胞、SW620/scrambled细胞和SW620/shHOXB7#1细胞的皮下瘤组织进行结直肠癌原位手术移植,每组6只裸鼠,每只裸鼠接种100 μL细胞悬液,其中含有1×107个细胞。于6周后处死裸鼠,对原发灶及各脏器进行取材,测量原发肿瘤大小,计数各脏器转移瘤个数,连续切片,HE染色观察转移情况。
4 统计学处理
各独立实验均重复3次。采用GraphPad Prism 8.0软件统计分析处理数据。数据用均数±标准差(mean±SD)表示。两实验组间均数比较采用t检验,均为双侧检验;多实验组间均数比较采用单因素方差分析,选用Dunnett检验进行两两比较。以P<0.05为差异有统计学意义。
结 果
1 生存分析显示HOXB7高表达的结直肠癌患者预后不良
使用 UALCAN 网站(http://ualcan.path.uab.edu/)对 TCGA(The Cancer Genome Atlas; https://portal.gdc.cancer.gov/)数据进行生存分析[6-7],如图1所示,在279名结直肠癌患者中,高表达HOXB7组的患者长期生存率更低(P=0.034)。
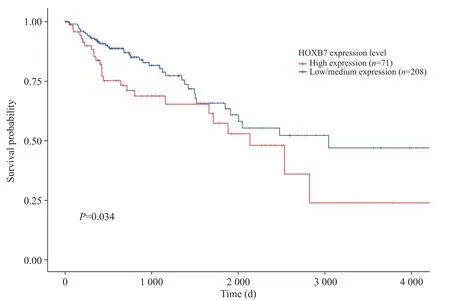
Figure 1. Kaplan-Meier curve showed that colorectal cancer patients with high HOXB7 expression had poor prognosis.图1 HOXB7高表达的结直肠癌患者预后不良
2 HOXB7靶向Wnt/β-catenin通路
在过表达HOXB7的SW480细胞系和对照组之间进行差异基因表达(differential gene expression,DGE)分析和过代表分析(over-representation analy-sis, ORA)。结果显示,Wnt/β-catenin 通路基因在HOXB7过表达样本中显著过表达(P<0.01),见图1A。此外,基因集富集分析(gene set enrichment analysis, GSEA)同样显示Wnt/β-catenin通路相关基因集表达水平与HOXB7表达水平正相关(P<0.01),见图2B。这些结果显示,HOXB7靶向Wnt/β-catenin通路。
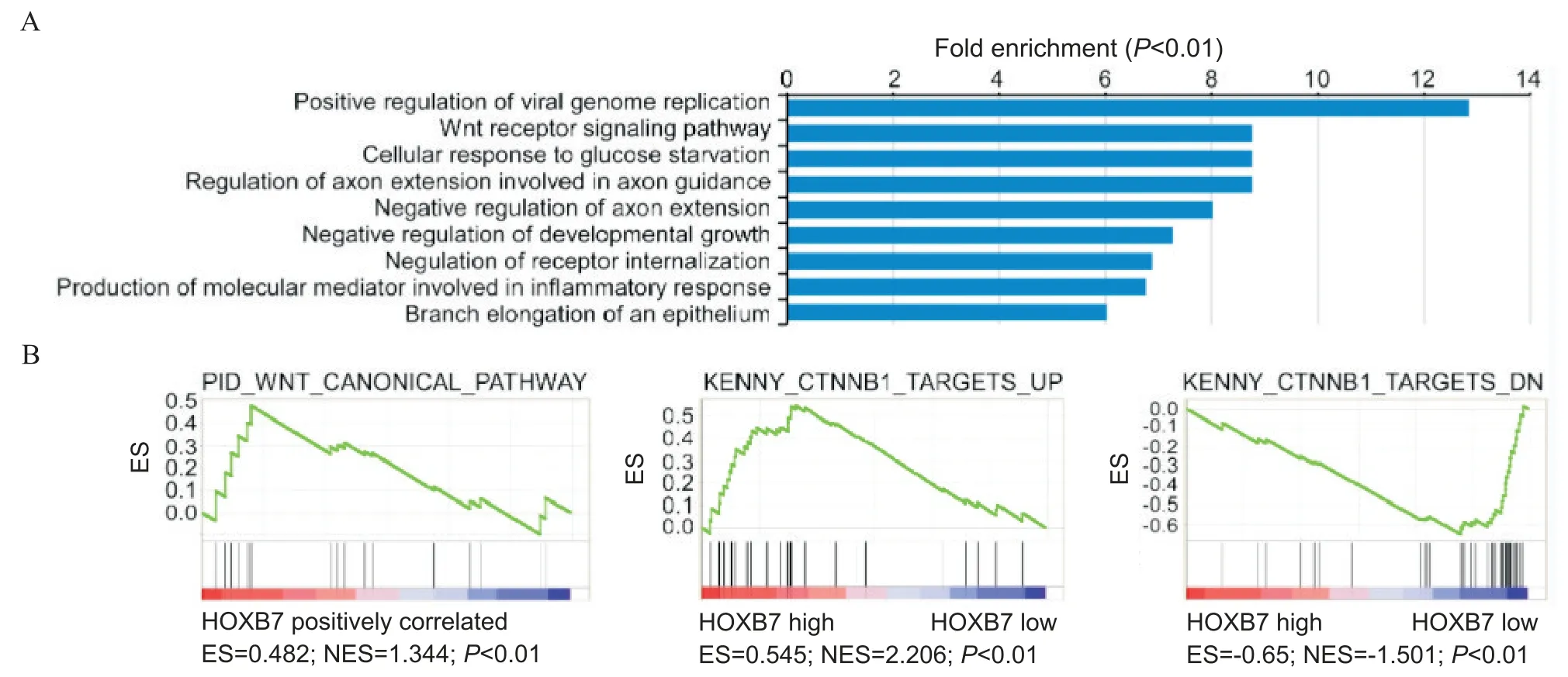
Figure 2. HOXB7 targets Wnt/β -catenin pathway. A: Wnt/β -catenin pathway-related genes were significantly overexpressed in HOXB7 overexpression samples; B: gene set enrichment analysis showed that the expression level of Wnt/β-catenin pathway-related gene set was positively correlated with that of HOXB7. ES: enrichment score.图2 HOXB7靶向Wnt/β-catenin通路
3 Western blot验证SW480和SW620细胞中HOXB7过表达或敲减
如图3所示,HOXB7在SW480细胞中过表达,在SW620中被敲减。
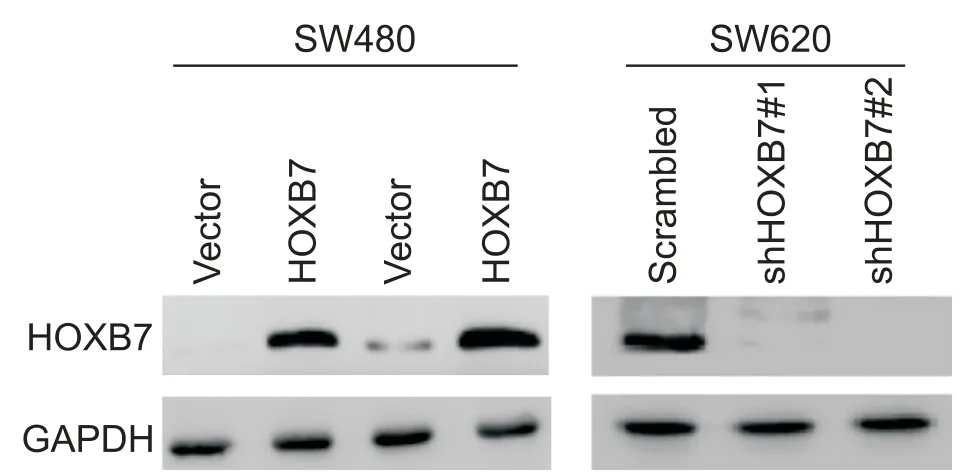
Figure 3. HOXB7 was overexpressed in SW480 cells and knocked down in SW620 cells.图3 HOXB7在SW480细胞中过表达,在SW620细胞中被敲减
4 HOXB7过表达增强SW480细胞的迁移和侵袭能力
Transwell实验结果显示,在迁移实验中,过表达HOXB7组进入下室的细胞数量明显多于阴性对照组,侵袭实验中过表达HOXB7组穿透基质胶进入下室的细胞数量同样明显多于阴性对照组,差异均有统计学意义(P<0.01),见图4。这一结果表明,HOXB7过表达可以增强SW480细胞的侵袭能力。
5 敲减HOXB7减弱SW620细胞的迁徙和侵袭能力
Transwell实验结果显示,在迁移实验中,敲减HOXB7组进入下室的细胞数量明显少于对照组,侵袭实验中敲减HOXB7组穿透基质胶进入下室的细胞数量同样明显少于对照组,差异均有统计学意义(P<0.01),见图5。这一结果表明,敲减HOXB7可以减弱SW620细胞的侵袭能力。
6 相差显微镜观察HOXB7过表达或敲减后细胞形态的变化
相差显微镜观察(图6)可见,HOXB7过表达的SW480细胞伸出伪足,而HOXB7被敲减的SW620细胞伪足消失,提示HOXB7上调可增强结直肠癌细胞的侵袭能力。
7 细胞划痕实验验证HOXB7过表达或敲减对结直肠癌细胞迁移的影响
48 h细胞划痕实验(图7)中,过表达HOXB7组愈合率显著高于空载体组,敲减HOXB7组愈合率显著低于对照组,差异均有统计学意义(P<0.01)。
8 Western blot测定HOXB7过表达或敲减对结直肠癌细胞中EMT相关蛋白表达的影响
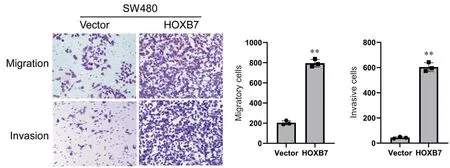
Figure.4. The effect of HOXB7 overexpression on the migration and invasion ability of SW480 cells detected by Transwell assays(scale bar=20 μm). Mean±SD. n=3. **P<0.01 vs vector.图4 Transwell小室实验检测HOXB7过表达对SW480细胞迁移和侵袭能力的影响
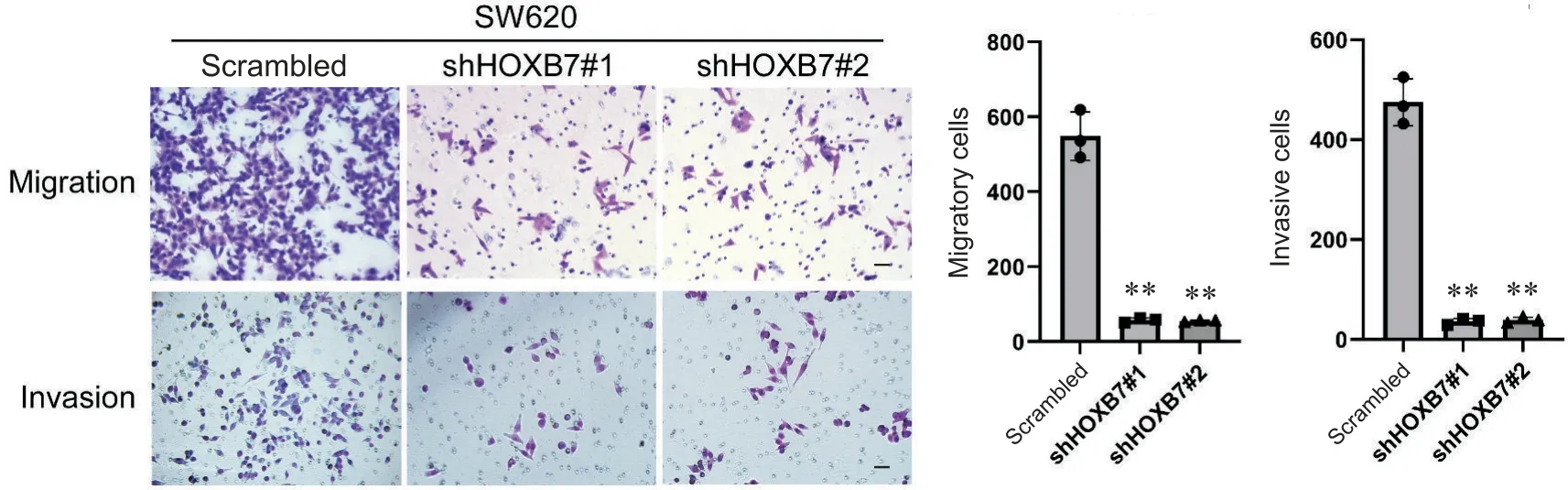
Figure.5. The effect of HOXB7 knockdown on the migration and invasion ability of SW620 cells detected by Transwell assays(scale bar=20 μm). Mean±SD. n=3. **P<0.01 vs scrambled.图5 Transwell小室实验检测HOXB7敲减对SW620细胞迁移和侵袭能力的影响
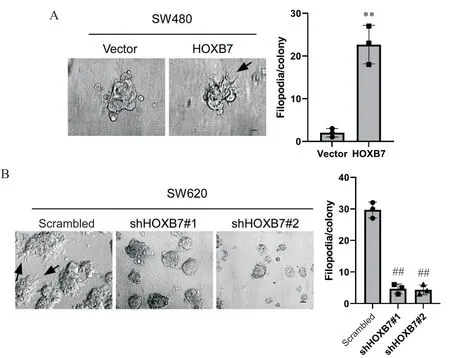
Figure.6. Morphological changes of colorectal cancer cells after overexpression or knockdown of HOXB7 were observed under phasecontrast microscope (scale bar=8 μm). Mean±SD. n=3. **P<0.01 vs vector; ##P<0.01 vs scrambled.图6 相差显微镜观察HOXB7过表达或敲减后结直肠癌细胞形态的变化
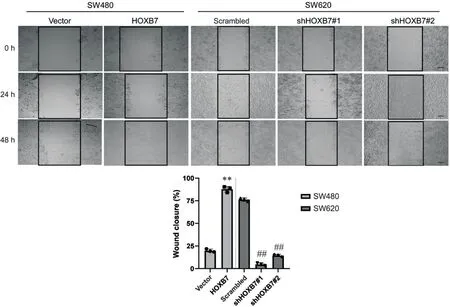
Figure.7. The effects of overexpression or knockdown of HOXB7 on the migration of SW480 and SW620 cells were detected by scratch test (scale bar=200 μm). Mean±SD. n=3. **P<0.01 vs vector; ##P<0.01 vs scrambled.图7 划痕实验检测HOXB7过表达或敲减对SW480和SW620细胞迁移的影响
E-cadherin可通过调节各种信号通路以维持细胞的上皮特征[8-9];α-catenin在细胞-细胞黏附中发挥关键作用[10]。如图8所示,两者在HOXB7过表达时下调,在HOXB7敲减时上调,差异均具有统计学意义(P<0.05)。与之相反,与细胞的间充质特性高度相关的 vimentin[11]和 N-cadherin[9]以及可抑制 E-cadherin基因表达的Snail蛋白[12-13]的表达在HOXB7过表达时显著上升,在HOXB7被敲减时下调,差异均具有统计学意义(P<0.05)。以上结果表明,HOXB7过表达可促进结直肠癌细胞的EMT,敲减HOXB7则正好相反。
9 免疫荧光染色检测HOXB7过表达或敲减对结直肠癌细胞中EMT相关蛋白表达的影响
如图9所示,与细胞上皮特性相关的E-cadherin和α-catenin的表达在HOXB7过表达时下调,在HOXB7敲减时上调。而与细胞间充质特性相关的vimentin、N-cadherin及Snail蛋白的表达在HOXB7过表达时显著上升,在HOXB7被敲减时下调。这一结果同样表明,HOXB7过表达可促进结直肠癌细胞的EMT,而敲减HOXB7则抑制结直肠癌细胞的EMT。
10 裸鼠体内实验证明HOXB7过表达或敲减对结直肠癌转移的影响
如图10所示,使用皮下瘤组织进行结直肠癌原位手术移植,在6周后处死裸鼠,对各脏器进行取材,连续切片观察,可见移植了HOXB7过表达的SW480细胞的裸鼠肠的原位瘤数量和肝肺转移瘤数量均较对照组显著增加(P<0.01)。
讨 论
结直肠癌是世界范围内最常见的恶性肿瘤之一,并且仍然是全球癌症相关发病率和死亡率的第三大原因。远处侵袭和转移是导致高达90%的结直肠癌相关死亡率的重要原因之一。尽管临床诊断和综合治疗的巨大进步在一定程度上延长了生存期,但转移性结直肠癌患者的预后仍然很差[14-16]。因此,研究如何抑制结直肠癌的远处转移、如何改善其预后,迫在眉睫。
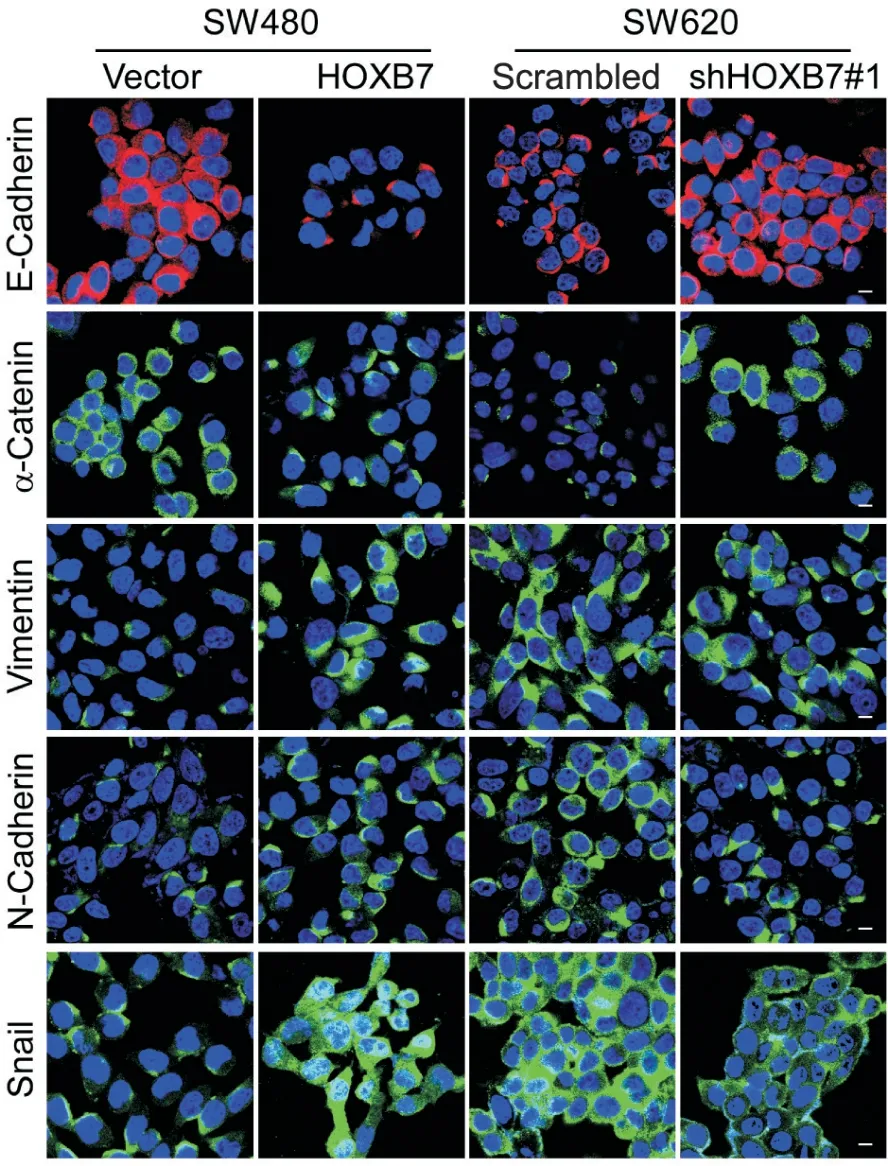
Figure 9. Expression of EMT-related proteins in SW480 cells with HOXB7 overexpression and in SW620 cells with HOXB7 knockdown was determined by immunofluorescence staining (scale bar=20 μm).图9 免疫荧光染色检测HOXB7过表达或敲减对EMT相关蛋白表达的影响
EMT是指上皮细胞获得间充质表型的细胞重编程过程。EMT在发育、伤口愈合和恶性肿瘤进展中发挥着非常重要的作用,癌细胞通过这些进展获得与更具侵袭性表型相关的特性[17]。在EMT被激活后,肿瘤细胞会发生一系列物理变化,包括紧密连接溶解、顶端-基底畸形的破坏和细胞骨架结构的重组,所有这些都促进细胞从其原发部位扩散、侵入周围组织,在循环中存活,最后导致远处器官转移。此外,有研究将对化疗和免疫治疗的耐药性增加归因于EMT,因为它促进与肿瘤相关基质细胞的相互作用,以其促肿瘤特性而闻名[18-20]。现已有使用二甲双胍(metformin)、齐多夫定(zidovudine)等药物通过Akt-GSK3β通路和Wnt通路靶向该过程对抗肿瘤化疗耐药的基础研究[21-23]。
HOXB7属于同源盒基因,它在癌症的发生与进展过程中被认为是一种主调控基因,可以协调多种靶分子以激活各种致癌途径,并与人们熟知的与癌症进展关系密切的TGFβ、EGFR、MAPK、p53等通路都相关[23-24]。现有研究表明,HOXB7在结直肠癌中,可通过磷脂酰肌醇3-激酶/Akt通路和MAPK通路介导其发生、增殖和抗凋亡作用[25]。此前,有学者报道过HOXB7可以靶向Wnt/β-catenin通路促进胶质瘤、食管癌的增殖和转移[26-27],敲减HOXB7则可导致皮肤鳞状细胞癌的侵袭力下降[6]。Wnt/β-catenin通路是结直肠癌发生发展的关键通路,但是在结直肠癌中,HOXB7与Wnt/β-catenin通路的作用机制尚不很明确[28-30]。本文首先通过DGE、ORA、GSEA等方法证明HOXB7可以靶向Wnt/β-catenin通路,然后使用结直肠癌的代表性细胞株SW480和SW620,在体内外研究了HOXB7在结直肠癌中的作用。实验结果证明,过表达HOXB7导致结直肠癌细胞的侵袭、迁移和EMT均较对照组显著增强,而敲减HOXB7则导致结直肠癌的侵袭、迁移和EMT较对照组显著下降。
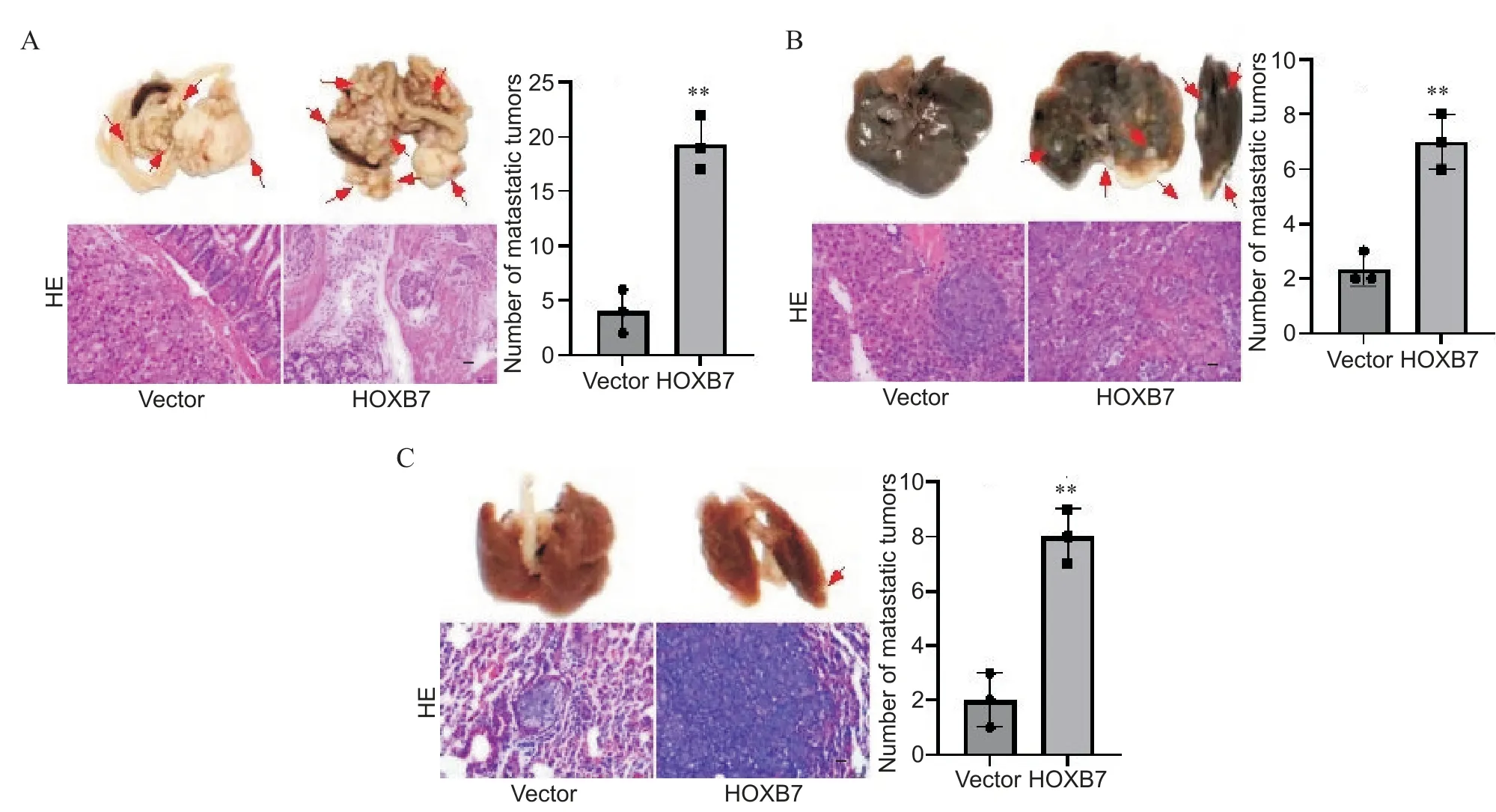
Figure.10. The effect of overexpression of HOXB7 on colorectal cancer metastasis was demonstrated in nude mice. The gross specimens, representative microscopic images (HE staining) and the number of metastatic tumors in the intestine (A), liver(B) and lung (C) of nude mice after 6 weeks of orthotopic transplantation of colorectal cancer. In the photos of the intestine, liver and lung gross specimens, the red arrows indicate the metastasis of the tumors. Scale bar=50 μm in A; scale bar=20 μm in B and C. Mean±SD. n=3. **P<0.01 vs vector.图10 裸鼠体内实验证明HOXB7过表达对结直肠癌转移的影响
综上所述,本研究揭示了HOXB7对结直肠癌细胞的侵袭、迁移的影响,其机制可能是靶向Wnt/β-catenin通路调控肿瘤细胞EMT从而介导结直肠癌的进展,揭示出HOXB7作为结直肠癌治疗靶点的潜力。靶向HOXB7以抑制结直肠癌的发生、增殖、侵袭和EMT过程、对抗结直肠癌的化疗耐药或可成为治疗结直肠癌的新思路。基于此,后续我们可以开展有关HOXB7通过干扰EMT从而控制结直肠癌的迁移、侵袭以及其联合用药的研究,寻找对抗结直肠癌耐药机制的新途径。

