有氧运动通过调节海马小胶质细胞表型极化缓解青春期间歇性酒精暴露所致的成年期大鼠认知障碍*
郭燕霞, 颜 敏, 李 丽, 赵 丽,2, 李 岩,2△
(1北京体育大学运动生理学教研室,北京 100084;2北京体育大学运动与体质健康教育部重点实验室,北京 100084)
青春期是发生酒精依赖的高峰阶段。据世界卫生组织报道,在全世界范围内有超过四分之一的15~19岁青少年是饮酒者,总量约有1.55亿[1]。青春期是神经系统发育的关键期。处于青春期的脑表现出对奖励刺激过度敏感和低抑制能力的特点,促使青少年积极参与一些高风险行为,如酒精滥用等。然而,青春期发育阶段的脑对酒精的伤害更加敏感,青春期酒精滥用会造成脑在结构和功能上的持久性损伤,导致成年后的认知障碍[2]。因此,青少年酒精滥用造成了极大的社会压力和经济负担,是全世界公共卫生领域的重要问题之一。海马是与认知功能关系密切的脑区,海马的神经炎症是导致认知障碍的重要原因[3]。诸多研究表明,青春期酒精暴露导致神经免疫功能失衡,继而诱发海马神经炎症,导致持久性损伤。小胶质细胞是存在于中枢神经系统的免疫细胞,可持续监测中枢神经系统的微环境,维持神经系统稳态。普通小胶质细胞处于免疫抑制状态,但当中枢神经系统受到内源性或外源性病理损伤时,小胶质细胞表面受体可以识别病原体、细胞碎片或异常蛋白等,诱导小胶质细胞激活。激活的小胶质细胞具有神经炎性损伤和神经保护的双重作用。但在这一过程中,小胶质细胞常被过度激活,导致炎症介质的过度产生和吞噬活性的加剧,使中枢神经系统无法维持正常的认知功能[4]。研究发现,发育期脑中的小胶质细胞对酒精极为敏感,新生时[5]和青春期[6]酒精暴露均会导致海马小胶质细胞激活。激活的小胶质细胞包括致炎型(M1型)和抗炎型(M2型),M1/M2表型极化在炎症反应和神经修复过程中发挥重要作用,但青春期酒精滥用对海马小胶质细胞M1/M2表型极化的影响还未见文献报道。
青春期酒精暴露诱导的认知损伤虽持久,但可逆。已有研究表明,青春期酒精暴露诱导的分子、突触、生理和行为改变可以通过阻断促炎基因表达来预防和逆转[7]。研究表明,规律的运动锻炼可以调节神经可塑性,防治成瘾、痴呆、抑郁症和焦虑症等诸多神经精神疾病。本课题组前期研究发现,运动可以调节脑内奖赏中枢中脑腹侧被盖区(ventral tegmental area, VTA)突触可塑性,减轻成瘾行为[8]。本课题组使用不同月龄的阿尔茨海默病(Alzheimer disease, AD)小鼠为研究对象,发现运动可以调节AD小鼠海马和皮层小胶质细胞和星形胶质细胞的活性,减轻神经炎症,从而改善小鼠的学习记忆能力[3]。前人研究发现,运动可以缓解新生后和青春期酒精暴露诱导的神经损伤和认知障碍[9-12],但其中枢机制远未明了,运动是否通过调节海马小胶质细胞活性和表型极化实现减轻酒精滥用诱导的神经炎症的效果更是未见报道。因此,本研究拟以大鼠为研究对象,建立青春期间歇性酒精暴露(adolescent intermittent ethanol exposure, AIE)模型,使用行为学、免疫荧光染色和ELISA技术,观察有氧运动对AIE大鼠成年期海马小胶质细胞活性和M1/M2表型极化的影响,以期为运动缓解青春期酒精滥用导致的认知损伤提供一定的实验依据。
材料和方法
1 实验动物
出生后 21 d(postnatal day 21, P21)SPF级雄性Wistar大鼠购自北京维通利华实验动物技术有限公司[许可证号:SCXK(京)2021-0006],分笼饲养于北京体育大学动物房,国家标准啮齿动物饲料喂养,昼夜节律人工控制光照(光照时间6:00~18:00),环境温度为22~24 ℃,相对湿度为50%~65%。动物自由进食及饮水,5 d换1次垫料,以保持环境清洁干燥。动物实验的处理方法符合北京体育大学运动科学实验伦理委员会的相关规定(批准号2020118A)。
2 主要试剂与仪器
白细胞介素1β(interleukin-1β, IL-1β)ELISA试剂盒(ab100768)、IL-6 ELISA试剂盒(ab100772)、肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)ELISA试剂盒(ab46070)、IL-10 ELISA试剂盒(ab100765)和兔单克隆离子钙结合接头分子1(ionized calciumbinding adapter molecule-1, Iba-1;小胶质细胞标志物)抗体(ab178847)均购自 Abcam;RIPA裂解液(89900)和蛋白酶抑制剂(78443)均购自Thermo Fisher Scientific;BCA蛋白定量试剂盒(23227)购自Pierce; 小鼠单克隆CD16抗体(sc-52376)和CD206抗体(sc-58986)均购自Santa Cruz。大鼠八臂迷宫视频分析系统(JLBehv-8ARM,上海吉量软件科技有限公司);激光共聚焦显微镜(SP8, Leica);微孔板吸光度分光光度计(xMark, Bio-Rad)。
3 主要方法
3.1 AIE模型建立及运动方案 动物建模、运动干预和指标测试流程如图1所示。适应性饲养1周后,将P28的大鼠随机分为生理盐水安静(saline sedentary, SS)组、生理盐水运动(saline exercise, SE)组、酒精安静(alcohol sedentary, AS)组和酒精运动(alcohol exercise, AE)组。参考 Vetreno等[12]的方案,从P28到P55,AS和AE组大鼠进行酒精灌胃(200 g/L乙醇,5.0 g/kg,2 d灌胃,2 d休息,共4周),SS和SE组大鼠在同一时点接受等体积的生理盐水灌胃。前人和本课题组研究表明,这种灌胃方法可使大鼠血液酒精浓度达到约160 mg/dL的水平[12]。从P28到P83,SE和AE组大鼠进行8周跑台运动干预。正式训练前,进行3 d的适应性训练:第1天,10 m/min,坡度为0,30 min;第2天,15 m/min,坡度为0,30 min;第3天,15 m/min,坡度为0,60 min。适应性训练后,进行正式训练(参考Gomes da Silva等[13]的研究制定方案):前10 min跑台速度为15 m/min,后50 min跑台速度为18 m/min,坡度为0,每天60 min,每周5 d,共8周。该运动方案已经被前人研究证实是有氧运动方案且可有效调节青春期大鼠海马突触可塑性[13-14]。SS和AS组大鼠每天放入跑台,但不开启电源,不进行运动干预。最后一次运动24 h后进行指标测试和取材,避免最后一次运动的应激作用。

Figure 1. Timeline of the experiment.图1 实验时程图
3.2 八臂迷宫行为学测试 实验过程分为适应期和测试过程,实验前各大鼠禁食24~34 h限制其体重下降至正常进食鼠的80%~85%。实验测试期间每天限制饮食,以维持体重范围至实验结束。适应期:大鼠进行为期3 d的实验环境适应过程,在迷宫每个臂尽头端均放置食饵,将每只大鼠依次置于迷宫中央,让其自由探索10 min。适应过程结束后,将1、2、5、7臂设置为目标臂,且整个实验过程中保持不变。测试过程:在目标臂末端的食槽中放置食饵,将大鼠放于关闭各臂门的迷宫中央区,10 s后同时将各臂门打开并进行视频采集。大鼠在迷宫中自由搜寻并摄取食饵,当大鼠到达四个放有食饵的目标臂时停止实验,若10 min后仍未寻找完所有目标臂,也停止实验。实验环境要求安静,保持较暗光线,周围环境标志物保持固定不变,每次实验后用酒精擦拭去除气味干扰。每只大鼠每天测试一次,共测试10天。测试指标如下:工作记忆错误,即在同一次训练中大鼠再次进入已经吃过食饵的臂;参考记忆错误,即动物进入不曾放过食饵的臂;完成时间,即动物完成测试所用的时间。
3.3 免疫荧光染色 大鼠用异氟烷麻醉,经4%多聚甲醛灌注固定后断头取脑,进行后固定。蔗糖溶液梯度脱水,OCT包埋后,使用冰冻切片机进行全脑冠状切片,制备30 μm的海马脑片。脑片水化后用蛋白酶K进行抗原修复和10%的山羊血清封闭,加入Ⅰ抗(Iba-1抗体,1∶200;CD16或CD206抗体,1∶100),4 ℃孵育2 d后复温1 h,滴加Ⅱ抗(Alexa Fluor 488标记的山羊抗兔IgG或Alexa Fluor 594标记的山羊抗小鼠IgG,1∶600)孵育1 h后封片,使用激光共聚焦显微镜拍照。每组随机选取6个视野,进行数据分析。使用ImageJ软件对Iba-1阳性细胞数和DAPI数目进行自动计数,计算两者比值(Iba-1/DAPI)。分别使用小胶质细胞M1表型细胞表面标志物CD16和M2表型细胞表面标志物CD206与小胶质细胞特异性标志Iba-1进行免疫荧光共染检测小胶质细胞极化的情况。使用Image-Pro Plus软件进行单通道细胞分割,创建选取区添加到ROI Manager中,随后用自动计数的方法计算CD16或CD206分别与Iba-1共染的细胞数目。
3.4 ELISA检测炎症因子表达 大鼠用异氟烷麻醉,断头取脑,分离海马组织。每100 mg海马组织中加入1 mL含有蛋白酶抑制剂的裂解液进行充分匀浆。匀浆液于4 ℃、13 000×g离心30 min,提取上清液。随后用BCA法测定总蛋白浓度。按照试剂盒说明书检测各组小鼠海马脑区组织液中IL-1β、IL-6、IL-10和TNF-α的水平,用酶标仪读取吸光度,在标准品浓度和吸光度之间建立回归/拟合模型,并根据待测样品反应的吸光度计算待测样品浓度。
4 统计学处理
采用SPSS 20.0软件进行统计学分析。实验结果均以均数±标准误(mean±SEM)表示。在满足方差齐性的条件下,八臂迷宫实验数据采用重复测量方差分析,其它数据采用双因素方差分析。以P<0.05为差异有统计学显著性。
结 果
1 有氧运动对AIE大鼠成年期学习记忆能力的影响
八臂迷宫实验结果如图2所示。对工作记忆错误次数进行重复测量方差分析(图2A),结果显示时间主效应显著(P<0.01),组别主效应显著(P<0.05),时间与组别的交互效应不显著(P>0.05),各组工作记忆错误次数均随时间显著下降。多重比较结果显示,在第1天和第4天,AS组工作记忆错误次数显著多于SS组(第1天,P<0.05;第4天,P<0.01);在第2天,AE组工作记忆错误次数显著少于AS组(P<0.01)。对参考记忆错误次数进行重复测量方差分析(图2B),结果显示时间主效应显著(P<0.01),组别主效应显著(P<0.05),时间与组别的交互效应不显著(P>0.05),各组参考记忆错误次数均随时间显著下降。多重比较结果显示,在第4天,AS组工作记忆错误次数显著多于SS组(P<0.05)。对完成时间进行重复测量方差分析(图2C),结果显示时间主效应、组别主效应及时间与组别的交互效应均显著(P<0.01),各组完成时间均随时间显著下降。简单效应分析结果显示,在第1、3和4天,AS组完成时间显著多于SS组(均P<0.01);在第1~4天,AE组完成时间显著少于AS组(第1、2和3天,均P<0.01;第4天,P<0.05)。以上结果提示,AIE大鼠成年期出现认知功能障碍;8周有氧运动缓解AIE大鼠成年期认知障碍。
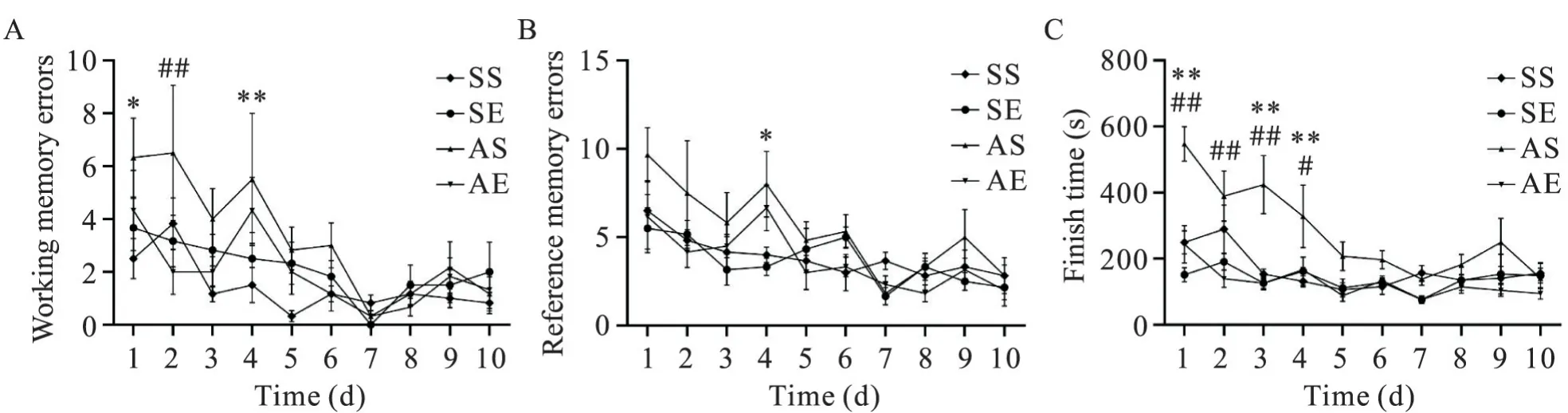
Figure 2. The cognitive performance of rats in eight-arm radial maze test. A: the working memory errors; B: the reference memory errors; C: the finish time. Mean±SEM. n=6. *P<0.05, **P<0.01 vs SS group; #P<0.05, ##P<0.01 vs AS group.图2 各组大鼠八臂迷宫行为学测试结果
2 有氧运动对AIE大鼠成年期海马小胶质细胞激活水平的影响
海马Iba-1免疫荧光染色结果如图3所示。对海马小胶质细胞数量进行双因素方差分析(图3B),结果显示酒精暴露主效应、运动主效应及酒精暴露和运动的交互效应均显著(P<0.01)。简单效应分析结果显示,AS组海马小胶质细胞数量显著多于SS组(P<0.01),AE组海马小胶质细胞数量显著少于AS组(P<0.01)。对海马小胶质细胞形态指数(胞体面积/分枝面积)进行双因素方差分析(图3C),结果显示酒精暴露主效应、运动主效应及酒精暴露和运动的交互效应均显著(P<0.01)。简单效应分析结果显示,AS组海马小胶质细胞形态指数显著大于SS组(P<0.01),AE组海马小胶质细胞形态指数显著小于AS组(P<0.01)。以上结果提示,AIE大鼠成年期海马小胶质细胞激活水平增加;8周有氧运动降低AIE大鼠成年期海马小胶质细胞激活水平。
3 有氧运动对AIE大鼠成年期海马小胶质细胞极化表型的影响
图4和图5A中的CD16和Iba-1共定位免疫荧光染色为M1型小胶质细胞,各组海马M1型小胶质细胞数量如图5B所示。对CD16+/Iba-1+的小胶质细胞数量进行双因素方差分析(图5B),结果显示酒精暴露主效应、运动主效应及酒精暴露和运动的交互效应均显著(P<0.01)。简单效应分析结果显示,SE组海马CD16+/Iba-1+小胶质细胞数量显著少于SS组(P<0.01),AS组海马CD16+/Iba-1+小胶质细胞数量显著多于SS组(P<0.01),AE组海马CD16+/Iba-1+小胶质细胞数量显著少于AS组(P<0.01)。以上结果提示,AIE大鼠成年期海马小胶质细胞M1型极化增加;8周有氧运动减少AIE大鼠成年期海马小胶质细胞 M1型极化。
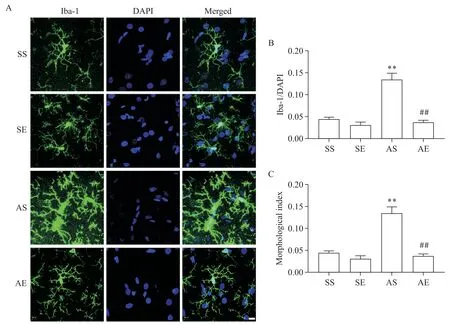
Figure 3. The activition of microglia in the hippocampus of rats. A: immunofluorescence staining of Iba-1 in the hippocampus (scale bar=10 μm); B: the number of microglia in the hippocampus; C: the morphological index (soma area/arborization area) of microglia in the hippocampus. Mean±SEM. n=6. **P<0.01 vs SS group; ##P<0.01 vs AS group.图3 各组大鼠海马小胶质细胞激活水平
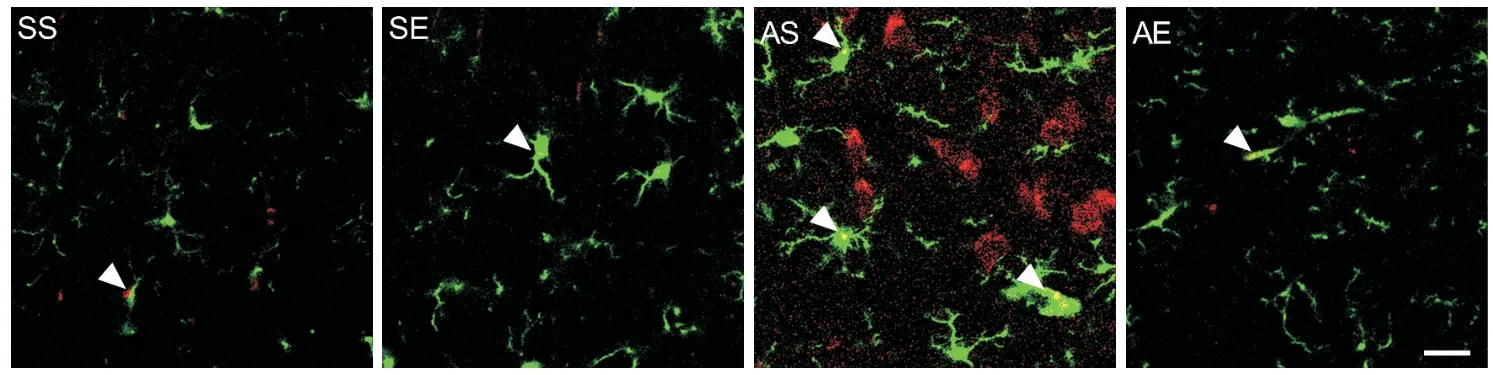
Figure 4. Immunofluorescence staining of M1 microglia in the hippocampus of rats (scale bar=25 μm).图4 各组大鼠海马M1型小胶质细胞
图6和图7A中的CD206和Iba-1共定位免疫荧光染色为M2型小胶质细胞,各组海马M2型小胶质细胞数量如图7B所示。对CD206+/Iba-1+的小胶质细胞数量进行双因素方差分析(图7B),结果显示酒精暴露主效应、运动主效应及酒精暴露和运动的交互效应均显著(P<0.01)。简单效应分析结果显示,AS组海马CD206+/Iba-1+小胶质细胞数量显著多于SS组(P<0.01),AE组海马CD206+/Iba-1+小胶质细胞数量显著多于AS组(P<0.01)。以上结果提示,AIE大鼠成年期海马小胶质细胞M2型极化增加;8周有氧运动增加AIE大鼠成年期海马小胶质细胞M2型极化。
4 有氧运动对AIE大鼠成年期海马神经炎症的影响
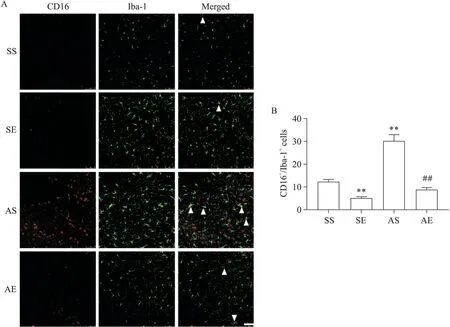
Figure 5. The number of M1 microglia in the hippocampus of rats. A: co-immunofluorescence staining of CD16/Iba-1 in the hippocampus (scale bar=75 μm; representative CD16/Iba-1 positive cells were indicated by the arrows); B: the number of CD16/Iba-1 positive cells. Mean±SEM. n=6. **P<0.01 vs SS group; ##P<0.01 vs AS group.图5 各组大鼠海马M1型小胶质细胞数量
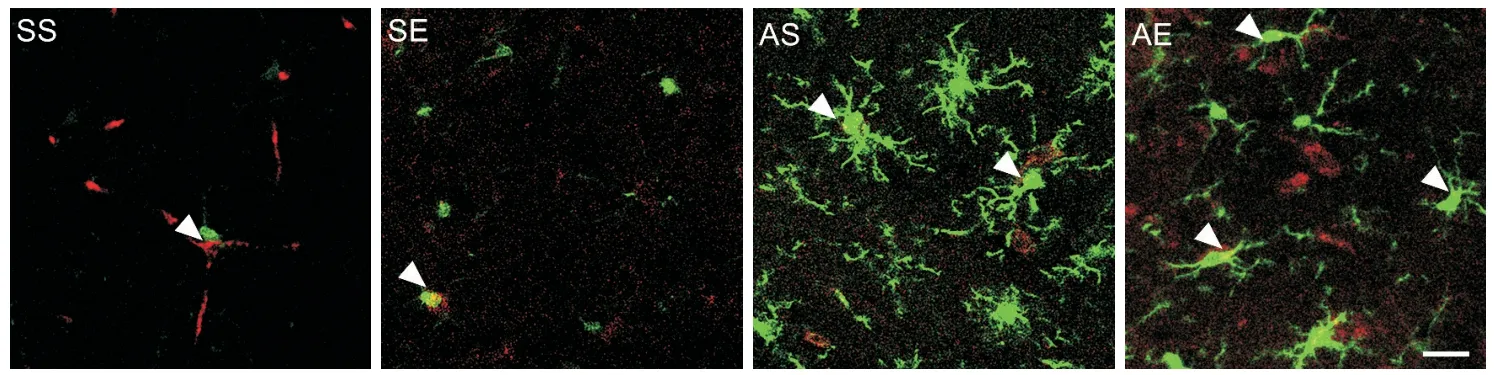
Figure 6. Immunofluorescence staining of M2 microglia in the hippocampus of rats (scale bar=25 μm).图6 各组大鼠海马M2型小胶质细胞
各组海马炎症因子的表达如表1所示。对海马IL-1β的表达进行双因素方差分析,结果显示酒精暴露主效应及酒精暴露和运动的交互效应均显著(P<0.01),运动主效应不显著(P>0.05)。简单效应分析结果显示,AS组IL-1β表达显著高于SS组(P<0.01),AE组IL-1β表达显著低于AS组(P<0.05)。对海马IL-6的表达进行双因素方差分析,结果显示酒精暴露主效应及酒精暴露和运动的交互效应均显著(P<0.01),运动主效应不显著(P>0.05)。简单效应分析结果显示,AS组IL-6表达显著高于SS组(P<0.01),AE组IL-6表达显著低于AS组(P<0.05)。对海马TNF-α的表达进行双因素方差分析,结果显示酒精暴露主效应、运动主效应及酒精暴露和运动的交互效应均显著(P<0.05或P<0.01)。简单效应分析结果显示,AS组TNF-α表达显著高于SS组(P<0.01),AE组TNF-α表达显著低于AS组(P<0.01)。对海马IL-10的表达进行双因素方差分析,结果显示酒精暴露主效应及酒精暴露和运动的交互效应均显著(P<0.05或P<0.01),运动主效应不显著(P>0.05)。简单效应分析结果显示,AS组IL-10表达显著低于SS组(P<0.01),AE组IL-10表达显著高于AS组(P<0.05)。以上结果提示,AIE大鼠成年期海马促炎因子表达增加,抗炎因子表达减少,出现神经炎症;8周有氧运动使AIE大鼠成年期海马促炎因子表达降低,抗炎因子表达增加,神经炎症减轻。

表1 各组大鼠海马炎症因子水平Table 1. The levels of inflammatory cytokines in the hippocampus of rats in each group [ng/(g protein). Mean±SEM]
讨 论
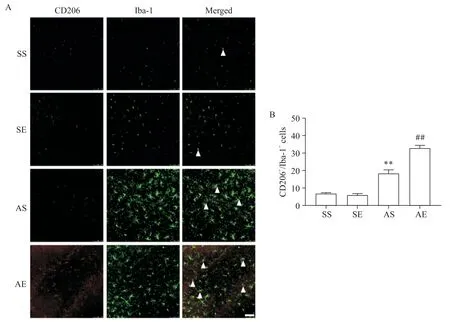
Figure 7. The number of M2 microglia in the hippocampus of rats. A: co-immunofluorescence staining of CD206/Iba-1 in the hippocampus (scale bar=75 μm; representative CD206/Iba-1 positive cells were indicated by the arrows); B: the number of CD206/Iba-1 positive cells. Mean±SEM. n=6. **P<0.01 vs SS group; ##P<0.01 vs AS group.图7 各组大鼠海马M2型小胶质细胞数量
运动对成瘾物质导致的脑损伤具有修复作用[8]。诸多研究表明,运动可以改善青春期酒精滥用导致的认知损伤,但其神经生物学机制远未明了。本研究发现,8周有氧运动调控AIE大鼠成年期海马小胶质细胞极化表型,使抗炎的M2型极化增加,降低小胶质细胞过度激活,改善海马神经炎症,提高AIE大鼠成年期认知功能。
长期酒精滥用会造成动物模型出现学习记忆能力下降、抑郁、焦虑等行为学改变,这也是评价建模成功与否的标准之一[15-16]。本研究发现,AS组大鼠成年期工作记忆错误、参考记忆错误和完成时间显著高于SS组(图2),这再次证实青春期酒精滥用会导致持续至成年的认知障碍,也说明本研究AIE大鼠建模成功。前人关于AIE对学习记忆能力影响的报道存在差异,多个研究均发现青春期酒精滥用模型出现工作记忆能力下降[17-19],但参考记忆能力无变化[17]。Mews等[20]认为酒精暴露造成的认知损伤在于酒精暂时性阻断长期记忆的形成,即酒精滥用主要影响短期记忆到长期记忆转换和存储,而对短期记忆的形成和原本储存在脑内长期记忆的回忆没有影响或者影响有限。也有部分研究结果发现青春期酒精滥用对认知功能没有影响,如Matthews等[21]未发现AIE大鼠的Morris水迷宫测试结果有显著性差异;Silvers等[22]在AIE模型的青春期末期也未观察到工作记忆和参考记忆出现差异。本研究发现AIE大鼠的工作记忆和参考记忆都出现损伤,但工作记忆的损伤程度更严重,而相比于工作记忆和参考记忆,完成测试的总时间体现出的损伤程度最为严重,这一定程度上与前人得出的青春期酒精滥用对学习记忆能力的影响具有选择性的观点相一致[23]。此外,本研究发现AIE大鼠工作记忆错误和参考记忆错误的增加主要出现在测试初期,这和AD模型的表现不同[24],说明酒精滥用导致的认知损伤与AD具有显著差异。以上结果说明酒精滥用造成的认知损伤十分复杂,实验动物月龄、性别、酒精滥用造模范式和认知功能评价方法的选择均可能对实验结果产生影响,因此,青春期酒精滥用对脑损伤的影响需进行进一步深入研究。本研究发现8周有氧运动可以减少AIE大鼠八臂迷宫测试的工作记忆错误(图2A)和完成时间(图2C),说明运动对AIE大鼠的认知损伤具有改善作用。本研究发现运动对AIE大鼠的参考记忆错误无影响(图2B),这可能与参考记忆或长期记忆 损 伤 对 酒 精 滥 用 不 敏 感 有 关[17,19-20]。 Hamilton等[11]使用追踪性眨眼条件反射和条件性恐惧等行为学测试发现运动改善青春期酒精滥用导致的海马相关的学习记忆能力损伤,结果与本研究一致。但也有结果发现运动对酒精滥用大鼠的学习记忆能力无影响[18,25],这可能与动物月龄、性别、酒精滥用造模范式和认知功能评价方法的不同有关,也可能与运动干预方式(自主跑轮、游泳或跑台)、运动干预时间和运动强度的不同有关。
海马出现过度的炎症反应是导致突触损伤和认知障碍的重要原因。越来越多的证据表明酒精滥用导致的海马小胶质细胞过度激活和过度神经炎症是导致突触损伤和认知功能障碍的重要原因[26-28]。小胶质细胞是中枢神经系统内主要的吞噬细胞,在正常生理状态下,小胶质细胞呈现为静息态小胶质细胞,胞体细长或椭圆,表面具有分枝状的突起,这些突起可不断伸缩以监控脑内微环境的变化。当小胶质细胞受到酒精等刺激时被激活,胞体体积增大,分枝缩短,转化为阿米巴样小胶质细胞。适度激活的小胶质细胞吞噬作用增强,有助于维持脑组织内环境的稳定,但过度激活的小胶质细胞会引起级联炎症反应,进而导致神经毒性作用和突触损伤。本研究发现AIE大鼠海马的小胶质细胞在成年期(酒精戒断30天后)依然保持大量活化的状态,小胶质细胞数量增加,胞体体积增大,分枝面积减小,转化为阿米巴样形态(图3)。8周有氧运动减少AIE大鼠海马小胶质细胞数量,减小胞体体积,增大分枝面积,降低小胶质细胞过度激活(图3),这可能是运动改善AIE大鼠认知障碍的机制之一。
小胶质细胞活化后,根据其极化方向不同而表现为神经毒性或神经保护性作用,其中M1型小胶质细胞活化后释放多种促炎因子,诱导神经损伤,M2型小胶质细胞可以通过产生抗炎因子和组织修复活性因子抑制过度的神经炎症,恢复脑内平衡以抑制神经损伤,因此小胶质细胞活化在神经免疫过程中发挥双刃剑的作用[29]。本研究分别选用CD16和CD206作为M1型小胶质细胞和M2型小胶质细胞的标志物,观察运动对AIE大鼠海马成年期小胶质细胞极化表型的影响。研究结果表明AIE大鼠成年期海马脑区M1型和M2型小胶质细胞的数量均出现增加,且M1型极化的数量多于M2型极化的数量(图5、7)。Peng等发现酒精暴露诱导成年大鼠内嗅皮层和海马的M1型和M2型小胶质细胞均增加[30],他们在使用青春期大鼠建立的酒精依赖模型上也观察到M1型小胶质细胞和M2型小胶质细胞数量的增加,且增加的持续时间比成年大鼠长[27]。Jiang等也观察到酒精暴露会使小鼠M1和M2型小胶质细胞的炎性标志物均出现增加[28]。本研究选用出生后28天的大鼠进行AIE模型的建立,同样观察到M1型和M2型小胶质细胞均出现增加(图5、7),本研究一方面丰富了酒精滥用导致脑损伤的理论基础;另一方面,本研究从小胶质细胞极化表型的角度再一次证实处于青春期的脑对酒精暴露极为敏感。小胶质细胞M1型极化后分泌大量促炎因子,介导神经损伤。本研究发现AIE大鼠海马内的IL-1β、IL-6和TNF-α等促炎因子释放增加(表1),这可能归因于M1型小胶质细胞数量的增加。小胶质细胞M2型极化后抑制促炎因子的释放并促进IL-10等抗炎因子的释放,发挥认知保护作用,有趣的是,在本研究中AIE大鼠小胶质细胞M2型极化增加,但IL-10释放却减少(表1)。我们推测这可能与两方面的因素有关:(1)脑内IL-10分泌的调控机制十分复杂,至今尚未完全阐明。从来源看,小胶质细胞和星形胶质细胞均可分泌IL-10,M1型小胶质细胞诱导星形胶质细胞分泌IL-1β、IL-6和TNF-α,M2型小胶质细胞诱导星形胶质细胞分泌IL-4和IL-10[31]。本研究中AIE大鼠M2型小胶质细胞数量少于M1型,因此推测星形胶质细胞可能主要以分泌促炎因子为主,分泌IL-10较少。(2)M2型小胶质细胞分泌的神经保护因子除IL-10外,还有IL4、脑源性神经营养因子(brain-derived neurotrophic factor, BDNF)、转化生长因子β(transforming growth factor-β, TGF-β)等,且不同亚型(M2a、M2b和M2c)的M2小胶质细胞功能存在差异[32],因此推测本研究中AIE大鼠M2型极化增加和IL-10释放减少可能与M2型小胶质细胞的不同亚型有关,但本研究并没有进一步检测不同亚型的数量,这是本研究的不足之处。本研究通过进行8周有氧运动干预,观察到运动使AIE大鼠海马M1型小胶质细胞数量减少,M2型小胶质细胞数量增加,即运动有效诱导小胶质细胞从M1促炎表型向M2抗炎表型极化(图5、7)。此外,我们观察到运动使AIE大鼠海马IL-1β、IL-6和TNF-α的释放减少,IL-10的释放增加,改善了AIE大鼠海马的神经炎症(表1)。Vetreno等[26]的研究表明运动可减轻AIE模型海马的神经炎症。本研究在前人研究基础上证实,运动改善AIE模型海马神经炎症的机制可能是运动诱导小胶质细胞极化表型转向M2型,降低小胶质细胞过度激活。因此,本研究是已有研究的深入,突出了小胶质细胞活化水平和极化表型在青春期酒精滥用导致脑损伤及其运动干预中的潜在作用,为青春期酒精滥用所致认知障碍的治疗提供了潜在靶点。但本研究并未对运动调控小胶质细胞激活和极化表型的分子机制进行探索,这是本研究的不足之处。已有文献报道,AIE可导致脑内的内源性大麻素系统出现紊乱[33],而大麻素1型受体和2型受体在小胶质细胞激活和极化表型调控过程中发挥重要作用[34]。运动可以促进内源性大麻素释放[35],因此推测运动通过调节内源性大麻素系统抑制AIE大鼠海马小胶质细胞激活,诱导极化表型转向M2型,但其具体机制仍待进一步深入研究。
综上所示,本研究结果提示运动诱导海马小胶质细胞M2型极化增加,降低小胶质细胞激活,抑制神经炎症。本研究为运动改善青春期酒精滥用导致的认知障碍提供了一定实验依据。

