拮抗茶树炭疽病土壤细菌的筛选与培养条件的优化
郑世仲, 高佩淇, 张晓青, 陈晓慧
(宁德师范学院生命科学学院,福建 宁德 352100)
我国茶园分布广泛,但由于管理粗放,加上部分茶区品种单一,导致茶树受病害影响较大[1]。我国茶树病害有140余种[2],大多为真菌病害,可为害茶树的叶部、茎部、根部和花。茶树炭疽病 (Gloeosporiumtheae-sinensisMiyake)是我国茶区常见的一种叶部病害,在西南、江南等山区茶园普遍发生,且春秋两季较为严重,大多为害成叶或嫩叶,导致茶树大量落叶,影响产量[3-5]。茶树炭疽病是由炭疽菌属(Colletotrichum)真菌引起[6],能侵染茶树的炭疽菌种类有C.carveri、C.majus、C.crassipes、C.gloeosporioides、C.siamense、C.acutatum、C.henanense、C.endophytica、C.camelliae、C.jiangxiense、C.aenigma、C.fructicola、C.boninense等[7-9],其中C.gloeosporioides(胶孢炭疽菌)为常见的病原菌。
微生物对真菌类病害具有较好的抑制作用,当前利用微生物菌剂防治植物病害越来越受到重视。相关研究表明,土壤细菌是具有很大开发潜力的一类微生物,既可以改良土壤结构,促进植物生长,还能抑制病原菌,提高植物防御能力[10-11],已成为开发防治植物病害的微生物农药的重要来源。近年来,国内外学者对茶树炭疽病侵染进行了大量的研究,并取得了一定的成果[4,6,12],但有关拮抗茶树炭疽病的微生物研究主要集中在放线菌和真菌上[13-15],针对土壤细菌在茶树炭疽病防治方面的研究相对较少。因此,本研究筛选了对茶树炭疽病具有较强拮抗作用的土壤细菌,并进行生理生化和分子水平鉴定以及液体发酵培养条件优化,以期为开发高效且低价的茶树炭疽病生防菌剂提供依据。
1 材料与方法
1.1 试验材料
2023年5月,在宁德市蕉城区茶园基地采集土壤样品。取表层约15 cm的土壤,风干过筛后保存,备用。病原菌为茶树胶孢炭疽菌,由闽东特色生物资源福建省高效工程研究中心提供。基础培养基为1.5%葡萄糖、1.0%蛋白胨、0.5%酵母膏、0.15%KH2PO4、0.1%K2HPO4、0.05%MgSO4·7H2O、0.01%MnSO4·H2O、0.01%FeSO4·7H2O、0.15%CaCl2(质量分数),pH值为7.0。
1.2 试验方法
1.2.1 土壤细菌的分离 称取1.0 g土壤样品,置于装有99 mL灭菌水的三角瓶中,沉淀后吸取1 mL的上清液配制成浓度梯度为10-1、10-2、10-3、10-4、10-5、10-6的稀释液备用。分别取100 μL不同浓度梯度的稀释液,涂布于牛肉膏蛋白胨培养基平板上。 37 ℃恒温培养3 d后,根据菌落形态挑取单菌落划线纯化,4 ℃冰箱保种。
1.2.2 高效拮抗菌的筛选 采用平板对峙法进行菌株筛选。将茶树炭疽菌菌饼接种在PDA平板中心位置,周围等距离分别接种分离纯化的土壤细菌,以只接种茶树炭疽菌菌饼为对照。30 ℃恒温培养,当对照长至培养皿边缘时,测量菌落直径,计算菌株的抑制率,筛选出对茶树炭疽菌具有较强抑制作用的菌株。抑制率/%=[(对照组炭疽菌菌落直径-炭疽菌菌落直径)/对照组炭疽菌菌落直径]×100。
1.2.3 拮抗菌的分类鉴定 参照《伯杰细菌鉴定手册》[16]和《常见细菌鉴定手册》[17],通过形态学观察、革兰氏和芽孢染色及糖类分解试验、吲哚试验、V-P试验、淀粉水解试验、柠檬酸盐利用试验、接触酶试验和硝酸盐还原试验等生理生化试验,对筛选出的拮抗菌进行初步鉴定。
提取基因组DNA,PCR扩增16S rDNA后克隆,将阳性克隆子送往华大基因测序。通过NCBI-Blast序列比对,选取亲缘关系较近和序列相似度较高的序列,采用MEGA 11.0软件构建系统发育进化树。
1.2.4 拮抗菌产酶能力分析 菌株活化后分别接种于酪蛋白培养基、纤维素—刚果红培养基和淀粉培养基,37 ℃恒温培养48 h,1 mol·L-1NaCl溶液脱色30 min后,观察有无水解圈出现。
1.2.5 液体发酵工艺优化 (1)种子液的配制。刮取1环活化后的Y-8菌株,接入50 mL灭菌的营养肉汤,37 ℃,200 r·min-1摇床培养20 h。(2)生长曲线的测定。将种子液按5.0%(v/v)接种量接种到50 mL的基础培养基中,37 ℃、220 r·min-1摇瓶发酵培养。每2 h取发酵液测定D600 nm,连续测量26 h,以不接菌的基础培养基为空白对照,3次重复。(3)单因素试验。①碳源筛选。用2.0%(w/v)的可溶性淀粉、大豆粕、麸皮、甘露醇、蔗糖、玉米粉作为碳源取代基础培养基中的葡萄糖,制备成含不同碳源的50 mL液体培养基,pH 7.0,37 ℃、220 r·min-1摇瓶发酵培养18 h。发酵液经双层纱布过滤后测量D600 nm值,筛选最适碳源。分别设置碳源浓度为1.0%、2.0%、3.0%、4.0%、5.0%,采用上述方式确定最适碳源浓度,每个处理3次重复。②氮源筛选。用2.0%(w/v)的大豆饼粉、(NH4)2SO4、NaNO3、尿素为氮源代替基础发酵培养基中的蛋白胨,制备成含不同氮源的50 mL液体培养基,培养条件与碳源筛选试验一致,测量D600 nm值,筛选最适氮源。设置氮源浓度为0.5%、1.0%、2.0%、3.0%、4.0%,采用上述方法确定最适氮源浓度,每个处理3次重复。③最适接种量筛选。在最适碳源和最适氮源组合的培养基上分别接种2.0%、3.0%、4.0%、5.0%、6.0% (v/v)种子液,pH 7.0,其他培养条件不变,测量D600 nm值,筛选最佳接种量,每个处理3次重复。(4)响应面法试验设计。根据单因素试验结果,运用Box-Behnken Design试验设计进行响应面优化,采用Design-Expert 8.0软件进行试验设计,将麸皮(X1)、(NH4)2SO4(X2)、接种量(X3)3个因素作为自变量分别设计3个水平(表1),将D600 nm值作为响应值,测量不同条件下菌体的生长量,得到最优的发酵条件。

表1 Box-Behnken设计试验因素与水平
2 结果与分析
2.1 拮抗细菌的分离筛选
从土壤中分离得到不同形态细菌157株,采用平板对峙法筛选出对茶树胶孢炭疽菌拮抗作用最强的菌株Y-8,抑制率为53.2%(图1)。
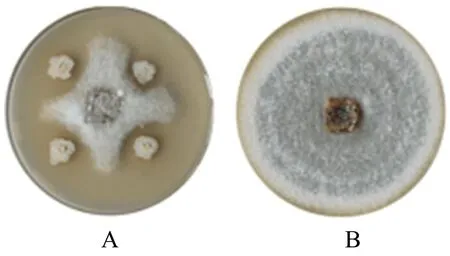
A:试验组;B:对照组。图1 Y-8菌株对茶树胶孢炭疽菌的抑制作用Figure 1 Inhibitory effect of Y-8 strain against C.gloeosporioides
2.2 Y-8菌株的菌种鉴定
2.2.1 形态学与生理生化鉴定 Y-8菌株菌落呈乳白色,圆形,中央隆起,不透明,表面不光滑、边缘光滑,革兰氏染色阳性,有芽孢。生理生化试验表明,Y-8菌株糖类分解、V-P试验、淀粉水解、吲哚试验、柠檬酸盐利用和接触酶试验均为阳性,甲基红和硝酸盐还原试验为阴性。参照《伯杰细菌鉴定手册》[16]和《常见细菌系统鉴定手册》[17],初步鉴定Y-8菌株为芽孢杆菌属。
2.2.2 16S rDNA分子水平鉴定 Y-8菌株16S rDNA序列PCR扩增,产物回收纯化后测序,全长共1 448 bp,MEGA 11.0软件构建系统发育进化树,结果见图2。Y-8菌株与萎缩芽孢杆菌(Bacillusatrophaeusstrain CNEB8)处于同一分支。NCBI-Blast结果表明,Y-8菌株与B.atrophaeusstrain CNEB8序列相似度高达99.59%。综合形态学与生理生化鉴定结果,Y-8菌株确定为萎缩芽孢杆菌。

图2 Y-8菌株的系统发育进化树Figure 2 Phylogenetic tree of strain Y-8
2.3 Y-8菌株产酶能力测定
Y-8菌株在相应底物培养基培养和脱色处理后,可以清晰地观察到酪蛋白固体培养基、淀粉固体培养基和纤维素—刚果红固体培养基上菌落周围形成了明显的水解圈(图3),说明Y-8菌株能够产蛋白酶、淀粉酶和纤维素水解酶。
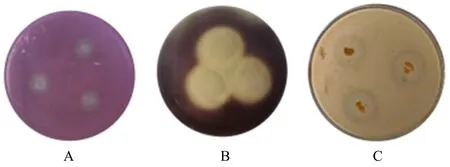
A.纤维素;B.淀粉;C.酪蛋白。图3 Y-8菌株的产酶能力Figure 3 Enzyme production capacity of strain Y-8
2.4 Y-8菌株液体发酵工艺优化
2.4.1 Y-8菌株的生长曲线测定 Y-8菌株的生长曲线如图4所示。Y-8菌株延滞期为0~2 h,指数期为2~18 h,稳定期为18~22 h,22 h后进入衰亡期。因此,选择16~18 h作为种子液的培养时间,此时种子液菌体具有较高活性和繁殖能力,且活菌数也相对较多。

图4 Y-8菌株的生长曲线Figure 4 Growth curve of strain Y-8
2.4.2 培养条件的单因素试验 如图5所示,与对照组(葡萄糖)相比,麸皮作为碳源时,菌体的生长量差异最小;菌体生长量随麸皮添加量增大呈先升高后下降趋势,当添加量为4.0%时,菌体生长量最大。(NH4)2SO4作为氮源时,菌体生长量与对照组(蛋白胨)最为接近;菌体生长量随(NH4)2SO4添加量的增大呈先升高后降低的趋势,当添加量为1.0%时,菌体生长量最大。因此,综合考虑生产实际和成本,最适碳源为麸皮,添加量为4.0%,最适氮源为(NH4)2SO4,添加量为1.0%。
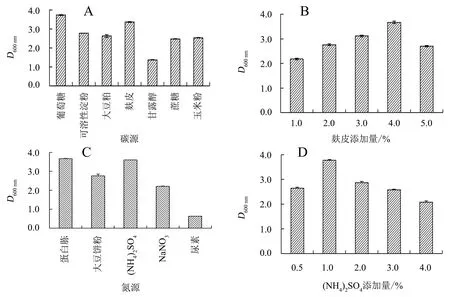
A.碳源;B.麸皮添加量;C.氮源;D.(NH4)2SO4添加量。图5 不同碳源、氮源对Y-8菌株生长的影响Figure 5 Effect of different carbon and nitrogen sources on growth of strain Y-8
接种量对菌株Y-8生长的影响见图6。当接种量为5.0%时,菌体生长量最大。因此,以5.0%为最佳接种量。
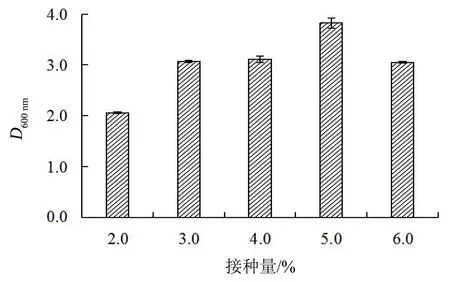
图6 不同接种量对Y-8菌株生长的影响Figure 6 Effect of inoculum level on growth of strain Y-8

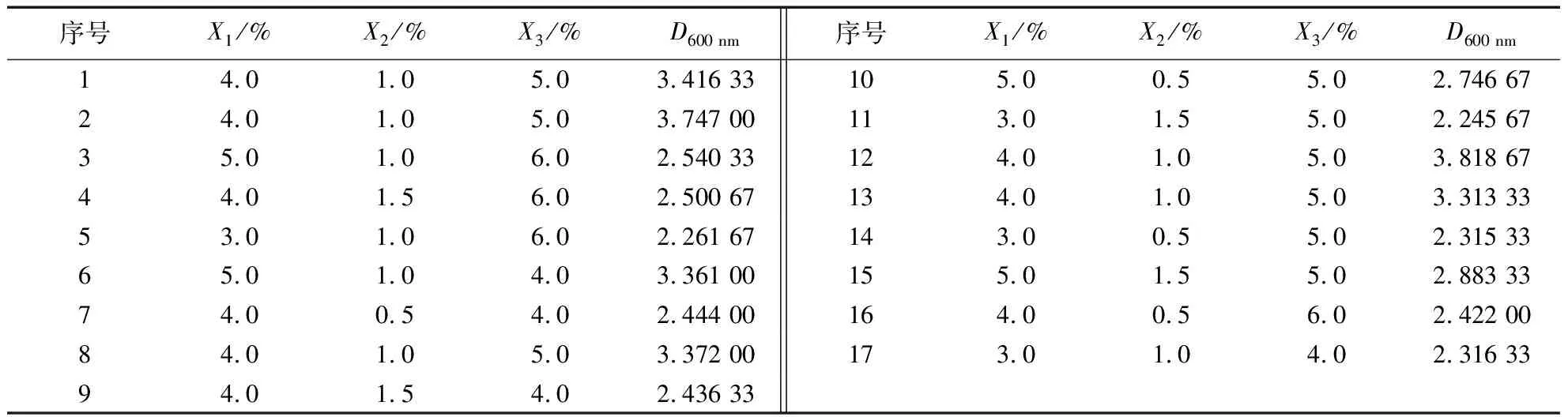
表2 Box-Behnken试验设计结果1)
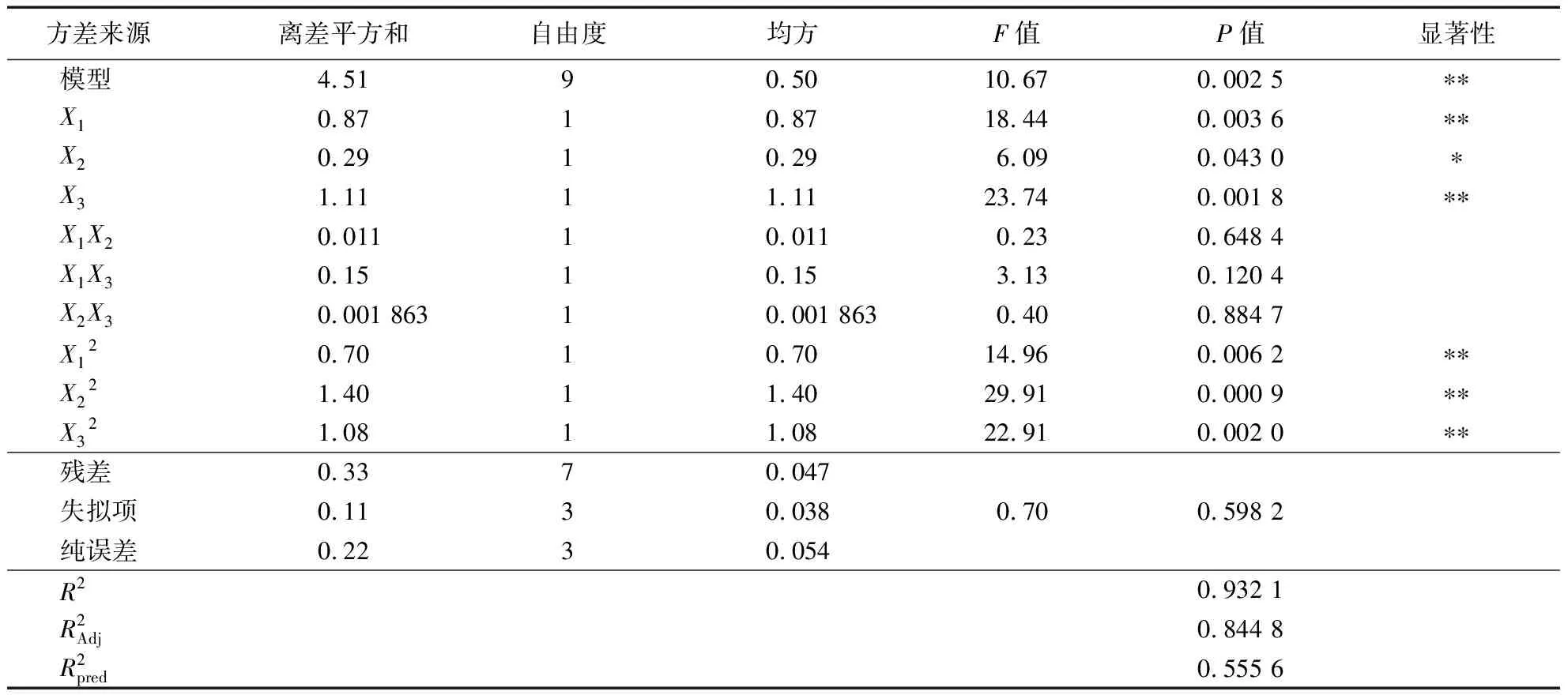
表3 回归模型方差分析1)
自变量X1和X3,以及平方项X12、X22、X32对结果(D600 nm)具有极显著的影响(P<0.01),自变量X2对结果影响显著(P<0.05),交互项X1X2、X1X3、X2X3对结果影响不显著(P>0.05)。3个因素对菌株生长影响大小为:X3(接种量)>X1(麸皮)>X2[(NH4)2SO4]。
2.4.4 交互作用分析 麸皮、(NH4)2SO4、接种量之间的交互作用对菌体生长量的影响见图7。由图7A和7B可以看出,接种量固定为5.0%时,D600 nm值随麸皮添加量的增加呈先升高后下降趋势,麸皮添加量约为4.5%时菌体生长量最大,(NH4)2SO4添加量约为1.0%时菌体生长量最大;由图7C和7D可以看出,(NH4)2SO4添加量固定为1.0%时,随着接种量的增加,菌体生长量先升高后下降,麸皮添加量对菌体生长量的影响与接种量一致;由图7E和7F可以看出,麸皮添加量固定为4.0%,接种量为5.0%时菌体生长量达到最大,同时随着(NH4)2SO4添加量的增加呈先升高后下降趋势,(NH4)2SO4添加量为1.0%时,菌体生长量达到最大。进一步分析等高线图,麸皮添加量和(NH4)2SO4添加量、麸皮添加量和接种量、(NH4)2SO4添加量与接种量,两两之间交互作用均不显著。

A、B为麸皮添加量与(NH4)2SO4添加量交互作用的等高线图和曲面图;C、D为麸皮添加量与接种量交互作用的等高线图和曲面图;E、F为(NH4)2SO4添加量与接种量交互作用的等高线图和曲面图。图7 不同因素对Y-8菌株生长的交互作用分析Figure 7 Interactive effect of different factors on growth of strain Y-8
用Design-Expert 8.0软件求解方程,得到理想组合为:麸皮添加量4.41%、(NH4)2SO4添加量1.01%、接种量4.82%,此时预测的菌体生长量为3.604 45。
2.4.5 回归模型的试验验证 结合生产实际,调整麸皮添加量4.5%、(NH4)2SO4添加量1.0%、接种量5.0%,进行3次重复验证试验,测得的菌体生长量平均值为3.63。得到的结果与预测值基本一致,表明该模型可信度高,可用于预测不同条件下Y-8菌株生长。
3 讨论与小结
目前,对植物病害的防治以化学防治和农业防治相结合的手段为主,但同时也造成病原菌产生抗药性和环境污染等问题。利用具有拮抗作用或抑制作用的微生物抑制病原菌的生长是目前植物病害防治研究的一个重要课题。土壤含有大量的微生物,其中细菌占比最大,在生防菌剂和生物有机肥方面具有很大的开发潜力与价值[18]。Carrión et al[19]研究表明,土壤细菌可与病原菌发生拮抗作用,诱导系统产生抗性,还能改善根际微生态环境,从而促进种子萌发和植物生长。
本研究从茶园土壤中筛选出一株对茶树炭疽病具有较高拮抗活性的土壤细菌菌株Y-8,通过形态学观察、生理生化鉴定及16S rDNA鉴定,最终鉴定为萎缩芽孢杆菌。产生各种水解酶是芽孢杆菌起抑菌作用的一种重要方式[20],Y-8菌株能产蛋白酶、纤维素水解酶、淀粉酶,说明Y-8菌株可能通过抑制病原菌细胞壁的形成进而抑制菌丝生长。生长曲线测定结果表明,2 h后就进入对数生长期,18 h后进入稳定期,说明Y-8菌株可以快速适应环境,生长周期短,快速繁殖、易培养。单因素试验和响应面优化后的液体培养条件为麸皮添加量4.5%、(NH4)2SO4添加量1.0%、接种量5.0%。麸皮和(NH4)2SO4在工艺当中相对廉价。因此,Y-8菌株具有开发为低成本生防菌剂的潜力,可用于茶树炭疽病的高效防治。
拮抗菌对病原菌的拮抗机制主要通过合成胞外水解酶或抑菌的次生代谢产物,或与病原菌竞争生长空间和营养实现[20-21]。本研究主要开展了拮抗茶树炭疽病的土壤细菌筛选和培养条件优化,Y-8菌株是否与拮抗菌有相同的抑菌机理,包括抑菌成分分离鉴定及对病原菌的菌丝生长和孢子萌发的影响,以及与宿主茶树之间的互作关系有待进一步研究。

