耐盐植物乳杆菌的选育及其对高盐稀态发酵酱油品质的影响
张伟,杨俊文,余冰艳,林琛,谢梦雪,罗晓明,周尚庭,蒋雪薇,3*
1(长沙理工大学 食品与生物工程学院,湖南 长沙,410114)2(长沙理工大学 化学化工学院,湖南 长沙,410114)3(湖南省调味品发酵工程技术研究中心,湖南 长沙,410600)4(加加食品集团股份有限公司,湖南 长沙,410600)
酱油酿造是以微生物生命活动为基础的复杂生物化学反应过程,有益微生物的相互协同作用是决定酱油风味与品质的重要因素[1-2]。目前,我国规模化的酱油酿造多采用现代高盐稀态发酵工艺,其主要特征是发酵酱醪盐分含量高,通常能达到16%左右,水分含量高,温度较低,发酵周期长至6个月及以上;设备上则采用圆盘制曲机、发酵罐等封闭式设备替代了开放式制曲箱及发酵池。现代高盐稀态发酵工艺使酱油酿造由间歇开放式工艺升级为连续封闭式工艺,该工艺较好地防控了开放式工艺带来的微生物污染风险[3],但自然接种的风味菌也随之减少,致使酱香形成缓慢,酱油酿造周期延长[4-5]。因此,要想在封闭的发酵系统及高盐浓度的发酵条件下获得品质上乘的酱油,加快选育耐高盐的风味菌是最主要的解决途径。酱油酿造过程中的常见风味菌主要有酵母和乳酸菌,由于对酱油酿造酵母的研究及产业化开展得较早,目前已有商业化的酱油酿造酵母[6],而对乳酸菌等风味细菌的研究起步较晚,导致其在酱油中的商业化应用一直滞后于酿造酵母。
植物乳杆菌是发酵食品中常见的乳酸菌[7],常应用于发酵泡菜中,是异型乳酸发酵菌株,除代谢生成乳酸外,还能生成乙醇、乙酸,可以赋予发酵食品愉悦的风味[8-9]。植物乳杆菌代谢的乳酸、乙酸等有机酸能与乙醇等醇类物质酯化生成乳酸乙酯、乙酸乙酯等风味物质,丰富发酵食品的香气[10-11];还能提高发酵体系的总酸,抑制杂菌的污染。酱油发酵中的食盐质量浓度可以从低盐的100 g/L达到高盐的160 g/L及以上,泡菜发酵用的植物乳杆菌需要耐盐驯化才能应用于酱油发酵,这使得在高盐的酱油发酵中植物乳杆菌的发酵性能受到制约。为了促进植物乳杆菌在酱油发酵中的应用,本文以发酵泡菜中筛选得到的耐盐植物乳杆菌L04(可耐受160 g/L NaCl)为出发菌株,利用紫外诱变选育耐盐稳定、产酸性能良好的突变株,并在高盐稀态酱油发酵中进行发酵试验,分析发酵过程中乳酸含量、理化指标与挥发性风味物质的变化,结合感官评分,以期获得能应用于高盐稀态酱油发酵中的优良菌株,提升酿造酱油的风味。
1 材料与方法
1.1 菌种与主要材料
菌种:植物乳杆菌(Lactobacillusplantarum)L04,长沙理工大学食品与生物工程学院调味品发酵研究室筛选并保藏,可耐受160 g/L NaCl。
主要材料:成品曲,湖南某酱油厂。
1.2 培养基
MRS(de Man,Rogosa Sharpe)培养基(g/L):牛肉膏10,蛋白胨10,酵母膏3,柠檬酸氢二铵2,葡萄糖40,乙酸钠5,K2HPO42,MgSO40.58,MnSO40.25,吐温-80 1 mL,琼脂粉20,121 ℃灭菌20 min。不添加琼脂粉为MRS液体培养基。
高锰酸钾-溴化钾-MRS培养基:MRS培养基,2.0 g/L K2MnO4,2.5 g/L KBr,115 ℃灭菌30 min。
1.3 仪器与设备
ARZ-200游标卡尺,青岛美吉特精密仪器工具有限公司;722S可见分光光度计,上海仪电分析仪器有限公司;ZWY-2102C恒温振荡培养箱,上海智城分析仪器制造有限公司;436 GC/EVOQ TQ/PAL气质联用仪,美国布鲁克科技有限公司;DB-5 MS气相色谱柱、ZORBAX Eclipse XDB-C18液相色谱柱,安捷伦科技(中国)有限公司;65 μm PDMS/DVB固相微萃取针,美国色谱科公司;Waters 2695型高效液相色谱仪,美国沃特世有限公司。
1.4 试验方法
1.4.1 紫外诱变致死率曲线的测定
将菌种接种至NaCl质量浓度为100 g/L的MRS液体培养基中,37 ℃、150 r/min培养48 h,取菌体离心洗涤3次后制成108CFU/mL的菌悬液备用;吸取10 mL菌悬液于15 W的紫外灯下距离45 cm照射0、15、30、45、60、90、120 s后分别取样稀释涂平板,37 ℃避光培养48 h后计数,绘制致死率曲线。致死率按公式(1)计算:
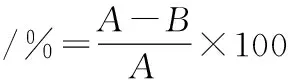
(1)
式中:A,对照菌落数;B,紫外照射后的菌落数。
1.4.2 突变株筛选
诱变后的菌悬液涂布于高锰酸钾-溴化钾-MRS培养基,37 ℃恒温培养2~3 d后观察产生的透明圈,游标卡尺精准测量透明圈直径(D)及菌落直径(d),挑选D/d>2.0的菌株,耐盐驯化后接入含有160 g/L的MRS液体培养基中,37 ℃静置培养60 h后测定发酵液中乳酸的含量,筛选乳酸含量最高的2株出发菌株的突变株进入后续试验。
1.4.3 突变株的耐盐稳定性
将筛选得到的突变株接续接种5代至160 g/L的MRS液体培养基中,37 ℃,150 r/min培养60 h,测定每代菌株发酵液的净增OD600值,并以出发菌株为对照,确定突变株的耐盐稳定性。
1.4.4 高盐稀态酱醪发酵工艺
将成品曲与230 g/L的盐水按1∶2(质量比)混合制成高盐稀态发酵酱醪,28 ℃发酵120 d。将筛选得到的突变株和出发菌株制成107CFU/mL的菌悬液,于发酵第45天分别添加至高盐稀态发酵酱醪中[12],添加量为5%[13],以不添菌的酱醪为对照组。发酵结束后,利用300目滤布压榨酱醪获得酱油。
1.4.5 乳酸菌总数和细菌总数测定
酱醪中细菌总数测定参照GB 4789.2—2016《食品微生物学检验 菌落总数测定》;酱醪中乳酸菌总数参考MRS平板计数法[14]测定。
1.4.6 酱油感官评分
由10名经过专业培训的人员(5名男性和5名女性,年龄25~45岁)组成感官评分小组,小组每位成员均至少有150 h以上的感官评分经验。对酱油色泽、香气、滋味、体态4个方面进行感官评分,满分为100分,评分标准参考GB/T 18186—2000《酿造酱油》中感官特性进行拟定,见表1。

表1 酱油的感官评分标准Table 1 Sensory evaluation standard of soy sauce
1.4.7 分析方法
1.4.7.1 乳酸含量的测定
取2 mL发酵液或酱油,5 mL 30 g/L ZnSO4溶液,5 mL 106 g/L亚铁氰化钾混合定容至100 mL,静置30 min后离心取上清液,0.22 μm水系膜过滤后,液相色谱进样分析;液相色谱条件:色谱柱为Agilent ZORBAX Eclipse XDB-C18,流动相为0.1%磷酸-甲醇(95∶5,V∶V),流速为0.6 mL/min,进样量10 μL,紫外检测波长为210 nm,柱温30 ℃。
1.4.7.2 理化指标的测定
还原糖含量测定参照GB 5009.7—2016《食品中的还原糖测定》;总酸含量测定参照GB 12456—2021《食品中总酸的测定》;氨态氮含量测定参照GB/T 18186—2000《酿造酱油》。
1.4.7.3 SPME-GC-MS分析
样品准备:取5 mL酱油和5 μL 2-甲基-3-庚酮甲醇溶液(0.816 μg/μL,内标物)于20 mL的顶空进样瓶中,在振荡器中50 ℃加热振荡25 min后,利用固相微萃取针吸附20 min后进样;GC条件:进样口温度250 ℃,解析时间为5 min;程序升温为40 ℃保持2 min,以5 ℃/min升温至120 ℃,保持2 min,以10 ℃/min升温至230 ℃,保持5 min,载气为高纯氦气,载气流速为1.0 mL/min,不分流。MS条件:EI离子源电子能量为70 eV,发射电流200 μA,离子源和传输线温度为250 ℃,扫描模式为全扫描,扫描时间为1~45 min,m/z扫描范围30~500。挥发性化合物定性分析:采用NIST 14谱库检索比对,再根据保留时间和标准质谱比对来确定物质结构。
挥发性物质含量计算如公式(2)所示:
(2)
式中:ρ1,挥发性物质质量浓度,μg/L;ρ0,内标物质量浓度,0.816 μg/μL;A1,挥发性物质峰面积;A0,内标物峰面积;V1,酱油的体积,mL;V0,添加内标物的体积,μL。
1.5 数据处理
利用SPSS 22及SIMCA 14软件进行相关性分析及多元统计分析;利用Excel 2019及Origin 2021 软件进行数据分析及可视化。
2 结果与分析
2.1 植物乳杆菌耐盐产乳酸突变株的选育
植物乳杆菌L04是从发酵泡菜中筛选并鉴定的1株能产乳酸的细菌,经过耐盐驯化后,在含160 g/L NaCl的MRS液体培养基中可以较好地生长和产乳酸,其发酵60 h后乳酸的积累量为3.18 g/L,有较好的耐盐产乳酸能力,适合作为选育酱醪发酵耐盐乳酸菌的出发菌株。
采用不同的照射时间处理L04菌悬液,绘制致死率曲线,结果见图1-a。
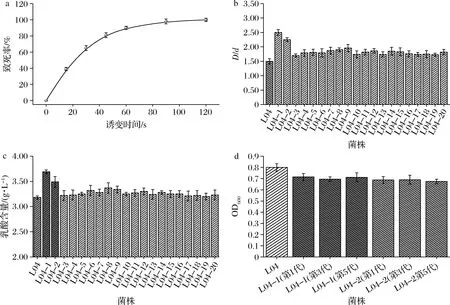
a-紫外诱变致死率曲线;b-高锰酸钾-溴化钾-MRS平板筛选;c-耐盐产乳酸能力筛选;d-菌株耐盐稳定性测试图1 耐盐产乳酸突变株的筛选Fig.1 Screening of salt-tolerant lactic acid-producing mutants
研究发现紫外诱变致死率为70%~80%能获得较高的正突变率[15],故选择诱变时间为40 s处理菌株L04。诱变后的菌株涂布于高锰酸钾-溴化钾-MRS培养基,乳酸可以使高锰酸钾-溴化钾-MRS平板褪色形成透明圈[16],以透明圈与菌落直径比值(D/d值)为指标进行初筛,获得20株D/d值大于L04的菌株,将其编号为L04-1~L04-20(图1-b),将初筛得到的20株菌经耐盐驯化后接种至160 g/L NaCl的MRS液体培养基静置发酵60 h,测定发酵液中积累的乳酸含量,其中乳酸积累量最高的两株菌为L04-1和L04-2(图1-c),其发酵液中乳酸含量分别为3.69和3.49 g/L,相比L04提升了16.03%和9.75%;L04-1和L04-2经5次传代及保藏,其在160 g/L NaCl下均有稳定的耐盐生长能力(图1-d),故选择这2株菌进入后续研究。
2.2 耐盐植物乳杆菌突变株对高盐稀态发酵酱油的影响
2.2.1 酱油酿造过程中乳酸菌总数及细菌总数的变化
如图2所示,发酵0~45 d,4组酱醪中乳酸菌总数和细菌总数由于还未添加乳酸菌而无明显差异,但在未添菌酱醪中也检测到了乳酸菌,这是由于成品曲中带入了乳酸菌。
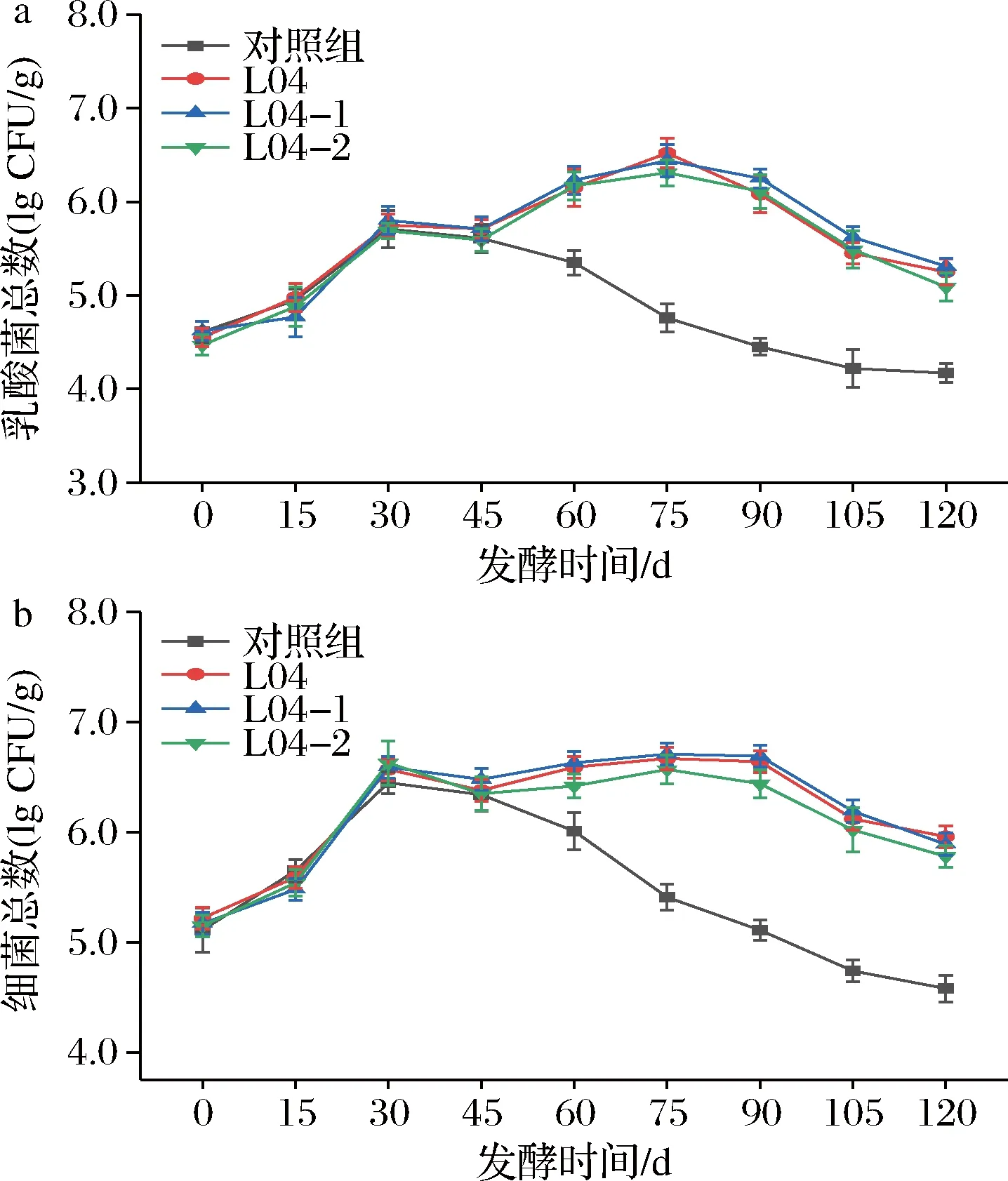
a-乳酸菌总数的变化;b-细菌总数的变化图2 酱油发酵过程中乳酸菌总数和细菌总数的变化Fig.2 Changes in total number of lactic acid bacteria and total bacteria during soy sauce fermentation
发酵45~75 d,添加L04、L04-1、L04-2的酱醪中乳酸菌的总数和细菌总数明显高于对照组,且均呈现上升趋势,在发酵第75天达到最大值,其乳酸总数分别为3.31×106、2.75×106、2.04×106CFU/g,分别比发酵45 d的酱醪增加了2.80×106、2.24×106、1.65×106CFU/g,其中由于出发菌株的耐盐生长能力比突变株好,使得酱醪中乳酸菌总数稍高于添加突变株的酱醪;细菌总数分别为9.77×106、1.32×107、8.71×106CFU/g,分别比发酵45 d的酱醪增加了2.37×106、2.06×106、1.47×106CFU/g,可见细菌总数的增加量小于乳酸菌的增加量,说明耐盐植物乳杆菌的加入抑制了酱醪中其他细菌的生长。发酵75~120 d,由于发酵体系的营养物质大量被利用,生长条件受限,使得添加3株耐盐植物乳杆菌的酱醪中乳酸菌总数和细菌总数均呈现降低的趋势。
2.2.2 耐盐植物乳杆菌突变株对高盐稀态酱油理化指标的影响
酱油发酵过程中与酱油品质相关的重要理化指标有氨态氮、还原糖、总酸和乳酸[17]。为了考察添加突变株L04-1、L04-2及出发菌株L04发酵对酱油品质的影响,对比分析添加耐盐植物乳杆菌发酵的酱油与未添菌发酵的酱油在理化指标方面的差异,结果见图3。
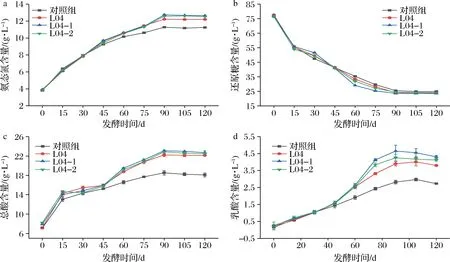
a-氨态氮含量变化;b-还原糖含量变化;c-总酸含量变化;d-乳酸含量变化图3 酱油发酵过程中的理化指标变化Fig.3 Changes in physicochemical indicators during soy sauce fermentation
0~45 d,此发酵阶段未添加耐盐植物乳杆菌,各样品均为同样条件下酿造,4组酱油中氨态氮、还原糖和总酸含量无明显差异。发酵45 d后,添加3株菌发酵的酱油中氨态氮的积累速率、还原糖的消耗速率以及总酸的积累速率均高于对照组,其中添加突变株L04-1和L04-2发酵的酱油中还原糖消耗速率和总酸的积累速率比L04更快,但其对应的酱醪中乳酸菌总数相差不大,说明选育得到的突变株在发酵产酸上性能更好。耐盐植物乳杆菌在此阶段内产生有机酸可降低发酵体系的pH,有助于酱醪中酸性蛋白酶发挥作用,能促进蛋白质原料的水解,从而使得酱油中氨态氮的含量高于对照组。发酵结束时,添加L04-1和L04-2发酵酱油的氨态氮和总酸含量均高于L04及对照组,其氨态氮含量分别为12.64、12.61 g/L,比L04高3.61%、2.53%;总酸含量分别为22.70和22.50 g/L,比L04高2.53%、1.63%,可见2株耐盐植物乳杆菌突变株在促进酱油总酸及氨态氮的积累上均优于出发菌株,其中突变株L04-1性能更好。
发酵第45天添加L04-1、L04-2后,所发酵酱油的乳酸积累速率明显高于L04及对照组,但添加耐盐植物乳杆菌发酵的酱醪中乳酸菌总数相差不大,说明选育得到的突变株在酱醪发酵中有更好的乳酸积累能力;发酵90 d时,乳酸含量达到最高值,分别为4.65和4.25 g/L;发酵结束时,乳酸含量分别降低至4.31和4.12 g/L,比L04高13.12%和8.14%,较对照组提升了57.88%及50.92%,发酵后期乳酸含量的减少可能是与醇类物质酯化形成了乳酸酯类物质。乳酸是酱油中重要的有机酸,具有柔和适口的酸感,是酱油酸味的重要来源,同时还是乳酸酯类物质的前体物,能促进酱油香气的形成,添加突变株和出发菌株均能促进乳酸积累,其中添加突变株L04-1和L04-2发酵的酱油中乳酸含量提升更为明显。
2.2.3 耐盐植物乳杆菌突变株对高盐稀态酱油挥发性风味物质的影响
为进一步探明选育的耐盐植物乳杆菌在高盐稀态酱油发酵中对挥发性风味物质形成的影响,利用固相微萃取气质联用技术分析发酵120 d的3组添菌发酵酱油及未添菌的对照组酱油中挥发性物质的种类及含量,其结果见表2及图4。4组酱油中共检测出65种挥发性风味物质,其中添加突变株L04-1及L04-2发酵的酱油中挥发性风味物质种类分别为48及43种,相比出发菌株无太大差异,但相比对照组分别增加了11种及6种;添加L04-1和L04-2发酵酱油的挥发性风味物质总含量分别为7 104.04和6 073.53 μg/L,比出发菌株高31.33%和12.28%,较对照组分别提高了58.15%及35.21%。突变株L04-1添加发酵对酱油在挥发性风味物质种类及含量的提升最明显,主要对酯类和醇类物质的贡献较大。
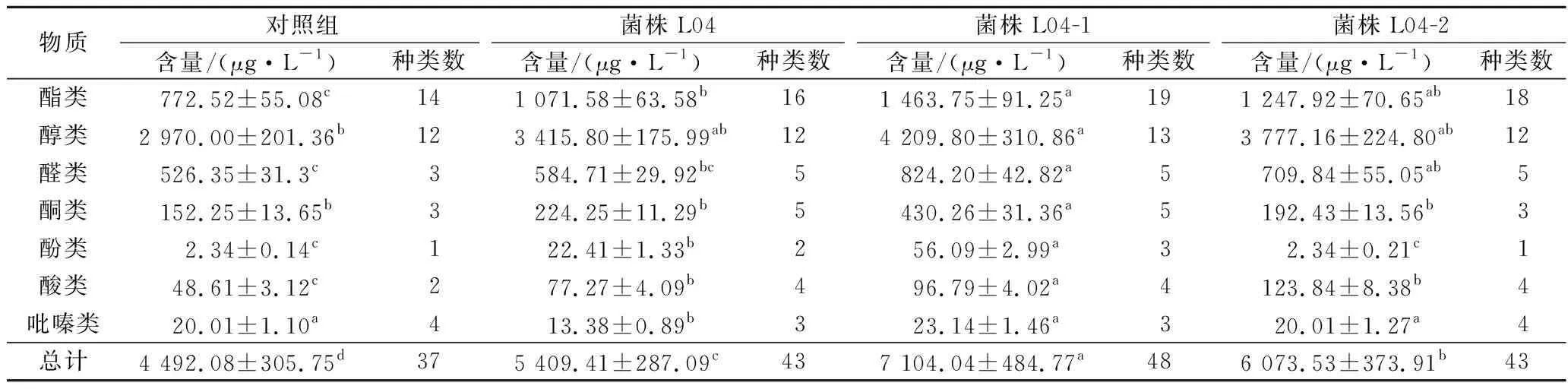
表2 酱油中挥发性风味物质分析结果Table 2 The results of various volatile flavor compounds in soy sauce
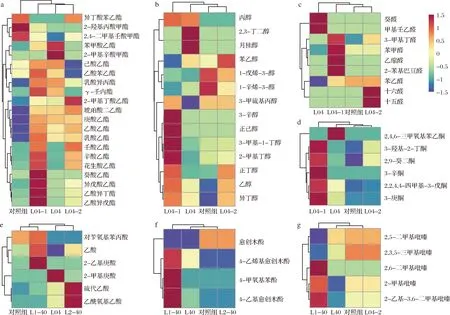
a-酯类;b-醇类;c-醛类;d-酮类;e-酸类;f-酚类;g-吡嗪类图4 酱油中挥发性风味物质聚类热图Fig.4 Clustering heatmap of volatile flavor compounds in soy sauce
酯类物质和醇类物质是酱油中主要的香气物质。由表2可知,添加菌株L04-1、L04-2发酵的酱油中检出的酯类物质含量分别为1 463.75及1 247.92 μg/L,比出发菌株高36.60%和16.46%,较对照组分别提升了89.48%及61.54%;2株突变株添加发酵的酱油中检出的醇类物质种类数与L04及对照组相比差别不大,但总含量较L04及对照组有明显增加,分别为4 209.80和3 777.16 μg/L,比出发菌株高23.24%和10.58%,相比对照组提升了41.74%及27.18%;添加突变株L04-1发酵的酱油中酯类和醇类物质的种类最多且总含量最高,对酱油酯类香气的贡献最明显。由图4-a可知,L04-1发酵的酱油中增加的酯类物质主要为乳酸乙酯、乙酸乙酯、异戊酸乙酯等12种乙酯类物质,其含量占酯类总含量的70.95%,其中乳酸乙酯含量的增加与L04-1的发酵产乳酸相关,其代谢生成的乳酸可与乙醇酯化促进乳酸乙酯的形成。此外,添加L04-1、L04-2发酵酱油中乙醇含量明显高于L04及对照组,这可能是由于诱变后菌株的异型乳酸发酵相关代谢途径的代谢流增强,使其在酱醪发酵中可代谢积累更多的乙醇,乙醇含量的提升促进乙醇与有机酸的酯化反应,使得酱油中的乙酯类物质含量增加。
醛类物质主要来源于氨基酸的降解和微生物的发酵转化,具有调和香气的作用[18]。图4-c显示,一共检测到9种醛类物质,添加3株突变株发酵的酱油中醛类物质的含量均比L04和对照组高,其中添加L04-1发酵对醛类物质的提升作用最明显,可促进苯乙醛、3-甲基丁醛、2-苯基巴豆醛及乙缩醛的积累。检测到的挥发性酸类共有6种,3株菌分别促进了不同酸类物质的增加,L04添加发酵增加的酸类为2-甲基庚酸;L04-1添加发酵增加的酸类为乙酸、2-乙基庚酸和对苄氧基苯甲酸;L04-2添加发酵增加的酸类为硫代乙酸和乙酰氧基乙酸。酮类物质共检测到6种,仅L04-1促进了酮类物质的积累,其可明显提升3-羟基-2-丁酮(奶油香)、3-庚酮(油脂香)、3-辛酮(果香)的含量[19],丰富酱油的香气。酚类和吡嗪类是构成酱油特征香气的重要物质[20],L04和L04-2的添加发酵对酚类和吡嗪类物质影响不大,而L04-1可促进4-乙基愈创木酚、4-乙烯基愈创木酚、4-甲氧基苯酚、2,6-二甲基吡嗪、2-甲基吡嗪和2-乙基-3,6-二甲基吡嗪的积累,有助于酱油特征酱香的形成。由此可见,3株耐盐植物乳杆菌均有提升酱油香气的作用,其中突变株L04-1在酱油酯香、醇香及酱香的形成上相比其他2株菌具有一定的优势。
利用偏最小二乘法(partial least squares discriminant analysis,PLS-DA)分析2株突变株和出发菌株发酵的酱油与对照组酱油之间的差异风味物质,其结果见图5。图5-a显示,2株突变株的添加发酵与多种挥发性风味物质积累的呈现正相关,其中与突变株L04-1呈现正相关的物质更多,主要为醇类和酯类物质,说明添加L04-1发酵对酱油酯类和醇类物质的生成贡献较大;VIP值分析显示,VIP值大于1的差异风味物质为5种酯类、6种醇类、1种酮类、3种酸类和1种酚类。图5-b中物质点偏离坐标轴原点越远,表明耐盐植物乳杆菌的添加发酵对其影响越大[21],酯类物质中VIP值较大的是花生酸乙酯(花生香气)、乳酸乙酯(奶油香)和辛酸乙酯(花果香)[22],添加L04-1和L04-2发酵的酱油中这3种酯类的含量均明显高于L04;醇类物质中VIP值较大的是3-甲基-1-丁醇(麦芽香)、2-甲基丁醇(果香)[23-24],添加L04-2发酵的酱油中这2种醇类和L04无明显区别,但添加L04-1发酵的酱油这2种醇的含量显著高于L04,说明添加L04-1发酵有利于促进酱油形成花果香为特征的前香和主体香。
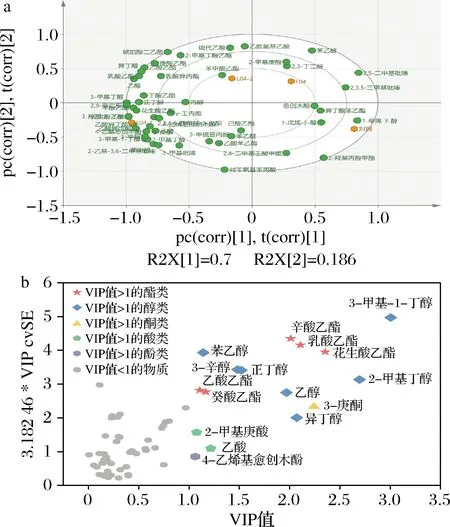
a-Biplot图;b-VIP值分析图5 四组酱油中差异挥发性风味物质分析Fig.5 Analysis of differential volatile flavor compounds of four groups of soy sauce
2.2.4 酱油感官评分
感官评分是评价酱油的重要指标,可直观地反映酱油的风味及品质[25]。通过感官评分对比分析添加突变株L04-1、L04-2发酵的酱油与L04及对照组酱油的感官差异,考察其对酱油整体风味及品质的影响,其结果见图6。添加L04-1和L04-2发酵的酱油在香气、滋味及总分上均比L04及对照组高,香气评分比L04分别提升了5.62%和2.85%,较对照组提升了9.10%和6.01%,其感官香气特征为更加浓郁的酯香且前香饱满、丰富,与挥发性风味物质分析的结论一致;滋味评分相比L04提升了4.75%及1.78%,较对照组提升了14.04%和11.17%,其滋味感受表现为酸鲜适口,相比对照组酱油以及添加L04发酵的酱油口感更加清爽。感官评分的结果表明筛选得到的2株耐盐植物乳杆菌突变株对酱油的香气、滋味及整体风味有着明显的增益效果,其中突变株L04-1的效果最佳,有较好的酱油酿造应用潜力。

图6 添加3株耐盐植物乳杆菌发酵酱油的感官评分Fig.6 Sensory scoring of soy sauce added with the three salt-tolerant L.plantarum
3 结论
本研究以耐盐植物乳杆菌L04为出发菌株,通过紫外诱变选育获得了2株耐盐稳定、产酸性能较好的突变菌株L04-1和L04-2,其在160 g/L NaCl的MRS中发酵60 h后乳酸积累量分别可达3.69和3.49 g/L。在高盐稀态酱醪发酵45 d分别添加3株耐盐植物乳杆菌进行为期120 d的发酵,结果表明耐盐植物乳杆菌加入可提升酱醪中乳酸菌的数量并抑制其他细菌的生长;2株耐盐植物乳杆菌突变株均可促进酱油的乳酸、总酸及氨态氮的积累,其中突变株L04-1的发酵性能最好,其添加发酵酱油的乳酸、总酸和氨态氮含量均要高于对照组和出发菌株L04,其乳酸含量为4.31 g/L,在酱油滋味评分较高的乳酸含量范围内。此外,2株突变株的添加发酵还可促进挥发性风味物质的形成,其中突变株L04-1的作用最明显。添加L04-1发酵的酱油挥发性风味物质总含量为7 104.04 μg/L,比对照组和L04分别增加了58.15%和31.33%,增加的主要是酯类和醇类物质,有利于酱油前香及主体香气的形成。此外,感官评分的结果也表明L04-1对酱油的香气、滋味有着明显的增益效果。综上,本研究选育的耐盐植物乳杆菌有应用于高盐稀态酱油酿造产乳酸、增风味的潜力。

