胃癌高发地区慢性萎缩性胃炎血清幽门螺杆菌抗体分型情况以及癌变风险的差异
石振旺,方东,鲍德明,王黎明,许勤 ,赵敏,陈正
合肥市地处江淮之间,居民喜食盐浸食物,调查显示,2015—2019年合肥市胃癌发病率69.02/10万,高于全国平均水平[1],属于胃癌高发区域。慢性萎缩性胃炎(chronic atrophic gastritis,CAG)是肠型胃癌演变过程中的重要转折点,也是胃癌监控、伺机性筛查的主要对象。幽门螺杆菌(helicobacter pylori,Hp)是最重要的致癌因子之一,根除Hp治疗对CAG病人的获益得到普遍认可。但是,我国Hp感染人口基数庞大,广泛的Hp根除治疗增加医疗资源消耗,也可能进一步加重Hp高耐药性的局面,近年来有学者提出Hp根除的“精准治疗”设想[2],但这一设想尚缺乏大样本、长期随访研究进行证实。本研究旨在探讨不同分型Hp感染病人癌变风险的差异,报告如下。
1 资料与方法
1.1 一般资料选取2019年12月至2021年1月合肥市第二人民医院就诊的168例CAG病人作为研究对象,其中男性99例,女性69例,年龄范围为42~75岁,年龄(62.47±8.44)岁。纳入标准:①诊断CAG明确;②Hp分型、C13呼气试验、胃黏膜功能、胃镜和病理等数据资料齐全;③能够独立完成问卷调查资料填写;④取得知情同意。排除标准:①胃镜和病理诊断结果不一致;②Hp分型检测和C13呼气试验结果不一致;③既往有Hp根除治疗史、Hp再感染;④手术后残胃萎缩;⑤1月内口服PPI制剂次数≥3次,连续服用时间≥3 d。本研究符合《世界医学协会赫尔辛基宣言》相关要求。
1.2 CAG问卷采用合肥市第二人民医院消化内科自行设计的“CAG病人问卷调查和随访登记表”,收集病人人口学资料(性别、年龄),生活(盐浸食物、饮酒史、吸烟史),消化道疾病史,肿瘤家族史,药物过敏史等资料。
1.3 Hp分型采用深圳海德威有限公司生产的C13尿素呼气试验胶囊和试纸板,空腹8 h、口服胶囊后15 min完成呼气试验;使用深圳劳伯特有限公司生产的Hp分型抗体检测试剂盒,蛋白质印迹法检测血清样本,根据Ure、CagA、VacA结果进行分类:CagA和(或)VacA阳性为Ⅰ型Hp,单纯UreA和(或)UreB阳性为Ⅱ型Hp,Hp阴性者4项全阴。
1.4 内镜、病理和OLGA分期采用Fujifilm7000型电子内镜检查,术前空腹8 h,口服达克罗宁胶浆(扬子江药业集团,批次20070311)+二甲硅油散(自贡鸿鹤制药有限责任公司,批次200504)作为祛泡剂;参考《中国慢性胃炎共识意见(2017年,上海)》[3]中CAG内镜诊断意见以及病理取材标准,在胃黏膜皱襞充分膨展的情况下,依据萎缩范围使用“木村-竹本”分类法进行分级,C型(闭锁型,C1、C2、C3)、O型(开放型,O1、O2、O3);由两位具有中级以上职称的病理医师对组织标本进行判读,采用新悉尼系统“可操作的与胃癌风险联系的胃炎评估”(OLGA)进行胃炎分期,0~Ⅱ期为低危病人,Ⅲ~Ⅳ期为高危病人。
1.5 胃黏膜功能检测使用安徽安科生物有限公司生产胃黏膜功能试剂盒,酶联免疫吸附试验(ELISA)定量检测胃蛋白酶原(PG)Ⅰ、PGⅡ、胃蛋白酶原比值(PRG)、胃泌素17(G17)水平,计算PGR=PGⅠ/PGⅡ。根据《中国早期胃癌筛查流程专家共识意见(草案)》提出的“改良ABC”法[4],将PGⅠ≤70 μg/L且 PGR≤7.0定义为 PG(+),G17≤1 pmol/L或G17≥15 pmol/L定义为G17(+),进行风险程度分组:A组[G17(-)PG(-)],B组[G17 (+)PG(-)],C组[G17(-)PG(+)]和D组[G17(+)PG(+)]。A、B组为低危病人,C、D组为高危病人。
1.6 统计学方法数据采用SPSS 20.0统计软件分析。PG、PGR、G17经Shapiro-Wilktest检验呈偏态分布,采用中位数(下、上四分位数)表示,即M(P25,P75)表示,三组间差异采用Kruskal-WallisH检验;计数资料采用χ2检验;检验统计量α=0.05,三组之间的两两比较采用校正后α为0.05/3=0.017。
2 结果
2.1 CAG病人Hp分型情况168例病人中Ⅰ型Hp 83例(CagA、VacA双阳27例;CagA单阳30例;VacA单阳26例),占比49.40%。Ⅱ型Hp 39例,占比23.21%。Hp阴性46例,占比27.38%。单纯胃窦萎缩病人95例,胃窦+胃体萎缩病人73例。
2.2 Hp分型与 CAG病人胃黏膜功能的关系单纯胃窦萎缩病人,Ⅰ型Hp病人G17低于Ⅱ型和Hp阴性组(P<0.05);胃窦+胃体萎缩病人,Ⅰ型Hp病人PGⅠ、PRG 低于Ⅱ型和 Hp阴性组(P<0.05);见表1,2。

表1 单纯胃窦萎缩病人Hp分型与胃黏膜功能情况/M(P25,P75)
2.3 Hp分型与“改良ABC法”危险分层的关系三组“改良ABC”癌变风险分层比较,差异有统计学意义(P<0.05),其中Ⅰ型Hp病人高危层占比最高,达33.74%;Ⅰ型Hp和Ⅱ型Hp、Ⅰ型Hp和Hp阴性以及Ⅱ型Hp和Hp阴性组之间的两两比较差异无统计学意义(χ2=6.02,P=0.049)。见表3。
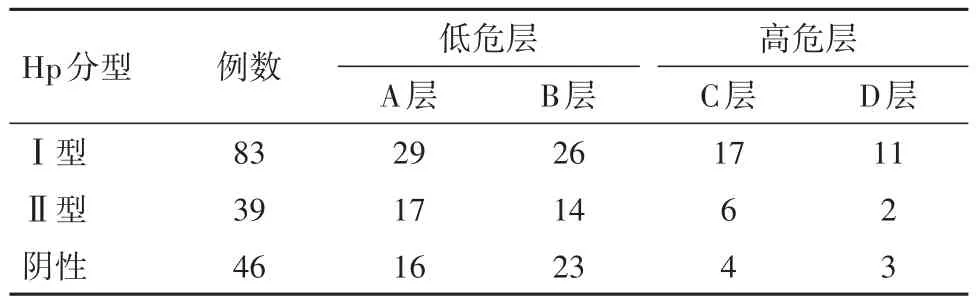
表3 不同分型Hp感染CAG病人“改良ABC法”危险分层/例
2.4 Hp分型与“木村-竹本”分类法的关系三组“木村-竹本”分类法“C型”和“O型”的比例比较,差异无统计学意义(χ2=1.45,P=0.483)。见表4。
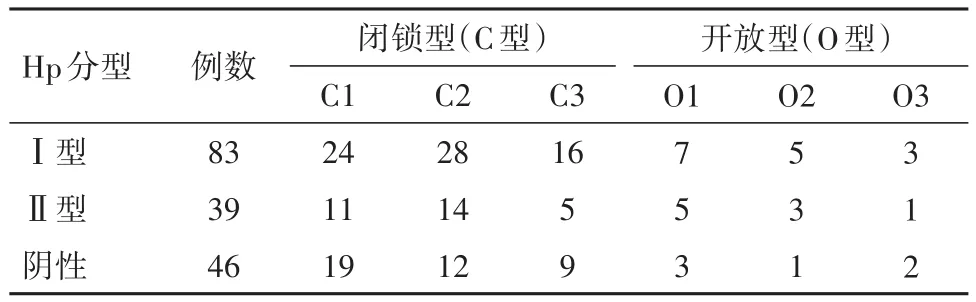
表4 不同Hp分型CAG病人“木村-竹本”分类/例
2.5 Hp分型与OLGA分期的关系Ⅰ型、Ⅱ型和阴性Hp三组病人间OLGA分期比较,差异有统计学意义(P<0.05),Ⅰ型Hp病人Ⅲ期和Ⅳ期共19例,占比最高(22.89%),但三组间对比结果显示,Ⅰ型和Ⅱ型Hp病人间OLGA分组比较,差异无统计学意义(χ2=6.28,P=0.043),Ⅰ型Hp病人OLGA高危组占比高于Hp阴性组(P<0.017)。见表5。
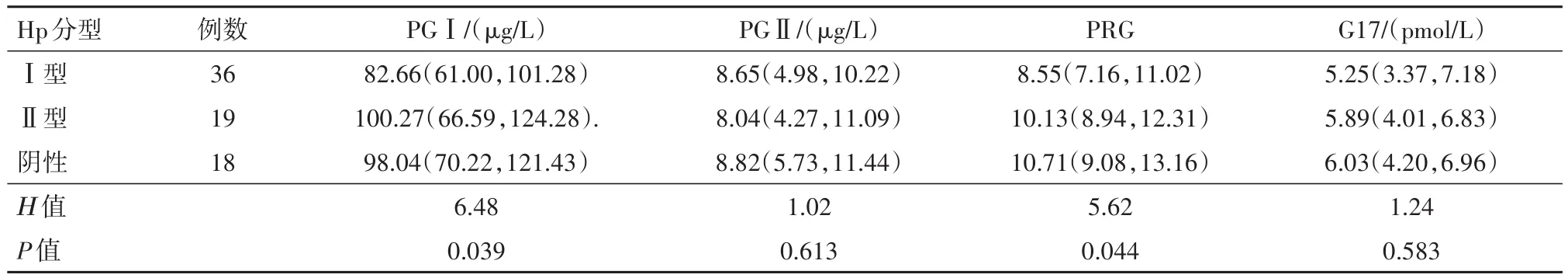
表2 胃窦+胃体萎缩病人Hp分型与胃黏膜功能情况/M(P25,P75)

表5 不同分型Hp感染CAG病人OLGA分期/例
3 讨论
CAG是胃癌演变过程中重要的癌前疾病,从胃癌早诊早治的角度出发,需要对CAG病人定期进行内镜监测和随诊,尤其是携带高危癌变因素,如Hp感染、盐浸饮食习惯、胃癌家族史的人群应该及早干预。
Hp是国际公认的Ⅰ类致癌因子,Hp的致病性与毒力因子CagA和VacA有关,根据基因携带类型将Hp分为Ⅰ型和Ⅱ型,分子遗传学层面的研究发现,Ⅰ型Hp具有更强的细菌毒力,其携带的CagA基因可以改变细胞形态、增强细胞的移动性、降低细胞之间的黏附能力、促进上皮细胞向间叶细胞转化,干扰宿主细胞信号传导[5-6];而VacA基因可引起靶细胞发生空泡变性、细胞凋亡、细胞骨架重排,甚至细胞死亡等形态学改变[7]。在引起宿主胃黏膜炎症、糜烂、溃疡以及癌变等一系列病变中,Ⅰ型的致病能力明显更强,而仅仅尿素酶阳性Ⅱ型 Hp 往往并不具有致病能力。显而易见,Ⅰ型 Hp 根除治疗的必要性和病人的获益也相对更高,因此有的学者提出Hp的“精准治疗”设想,旨在缓解当前Hp高耐药率的局面,但是目前仍缺乏相关临床研究进行佐证。对CAG病人进行癌变风险分层是近年来研究的热点之一,包括日本学者推荐的无创血清学活检(ABC法)、基于萎缩肠化范围和程度的OLGA/OLGIM分期以及针对我国国情提出的慢性胃炎癌变风险评分系统等[8-9],筛选出高危CAG病人有助于指导临床治疗和制定随诊方案。当前国内外研究认为Hp阳性和阴性病人胃黏膜功能存在差异,有一些对于不同分型Hp感染对胃黏膜炎症、损伤差别的报道,但是对不同菌株Hp感染的CAG病人临床癌变危险程度的差异研究十分少见。
在本研究中,CAG病人Hp感染率72.61%,高于安徽省平均水平56.30%,说明Hp感染在CAG病人中十分常见,参与萎缩、肠化的发生发展,其中Ⅰ型和Ⅱ型 Hp感染比值为2.13∶1,Ⅰ型Hp“致病毒株”相对多见。既往研究表明,Hp感染可能影响血清PG和G17水平,Kikuchi等[10]针对日本健康体检人群的大样本研究结果显示,Hp感染组人群PGⅡ升高而PGR下降,通过检测PG可能用于Hp感染的筛查,并指出PGⅡ>10 μg/L或者PGR<5.0标准预测Hp感染的敏感性和特异性分别达96.3%和82.8%。另一项对萎缩性胃炎病人的研究显示,92.79%的CAG病人Hp感染阳性,Hp阳性和阴性病人之间PGⅠ水平差异无统计学意义,而Hp感染可能引起PGⅡ升高,从而引起PGR相对降低[11];Cho等[12]指出,Hp感染CAG病人在根除Hp治疗后PGR水平可以升高,但目前具体机制尚未完全明确。
上述研究主要集中在CAG病人Hp感染与PG水平的相关性,但是血清PG、G17水平受萎缩范围影响程度更高,分别探讨对胃窦萎缩、胃窦+胃体萎缩病人Hp分型对PG影响的研究结论则更加准确可靠。在本研究中,胃窦萎缩病人Ⅰ型Hp组G17高于Ⅱ型和Hp阴性组(P<0.05),而三组间PGⅠ、PGⅡ、PGR差异无统计学意义,考虑与Hp定植部位主要位于胃窦部,Ⅰ型Hp携带的CagA和VacV因子引起黏膜损伤、萎缩的严重程度可能更高[13],也有研究认为Ⅰ型Hp通过诱导产生TNF-α、IL-6、IL-8等多种炎性因子影响G17高分泌[14]。胃窦+胃体萎缩病人Ⅰ型Hp病人PGⅠ、PRG低于Ⅱ型和Hp阴性组,这与Shiota等[15]的研究结果基本一致,Ⅰ型Hp携带的致病因子CagA引起胃体底黏膜炎症反应,也增加黏膜表面的渗透性、有利于分泌的PG再吸收,从而引起PGⅠ、PRG下降。
我国提出的“改良ABC”法是建立在日本“ABC血清学活检”基础上,结合PGR和G17的无创胃癌风险分层方法,随着分层等级提升,癌变风险呈逐渐增高趋势[16-17]。倪栋琼等[18]一项纳入30 126例的大样本研究结果显示,“改良ABC”法对早期胃癌筛查能力优于传统“ABC”法和新型评分系统,高风险分层(C、D层)慢性胃炎病人中早期胃癌的检出率明显更高。袁林等[19]研究指出,不同基因分型的Hp感染人群G17和PG水平存在一定差异,Ⅰ型Hp可以引起G17和PG异常分泌,是导致胃黏膜病变、早期胃癌的高风险菌株。在本研究进一步根据“改良ABC”法分别对不同Hp感染情况的病人进行风险分层,三组病人间“改良ABC”癌变风险分层差异有统计学意义,其中Ⅰ型Hp病人高危层占比最高,达33.74%,提示Ⅰ型Hp可能具有更高致病风险的特点。同时,从内镜和病理学角度探讨,Ⅰ型、Ⅱ型和阴性Hp三组病人间OLGA分期也差异有统计学意义,OLGA分期将慢性胃炎的组织病理学与癌变危险性联系起来,与“改良ABC”法具有协同参考价值,Ⅰ型Hp携带的致病基因造成黏膜炎症、萎缩损伤更强。研究认为,对Ⅰ型Hp感染病人积极根除治疗,在后期的随访过程中,6个月至1年内CAG病人的OLGA分期有所下降,有助于降低癌变的风险,根除治疗的获益-风险比明显占优。值得一提的是,在本研究中,三组病人之间的“木村-竹本”分类法分级差异无统计学意义,与OLGA分期不同的是,“木村-竹本”分类法分级的主要依据是萎缩的部位和范围,并未考虑萎缩的严重程度、萎缩深度,而Hp主要定植部位位于胃窦,考虑不同分型Hp在胃内定植范围可能不存在差异。
综上所述,本研究在胃癌高发的江淮地区针对CAG病人进行分型检测,根据携带致病基因的差异分为Ⅰ型和Ⅱ型Hp,发现不同分型Hp感染的CAG病人“改良ABC”法和OLGA分期存在差异,提示Ⅰ型Hp感染病人癌变风险更高,更加值得关注。基于部分学者提出的不同分型Hp感染病人的根除策略可能需要“区别对待”的设想,从降低耐药率的角度出发,后期期待更多的大样本研究来对Hp感染病人根除治疗的风险-获益比进行分析探讨。

