反复控制性超促排卵对胚胎发育及妊娠结局的影响
谢娟珂,张亚楠,王 倩,陈圆辉,张翠莲
(河南省人民医院生殖医学中心,河南 郑州 450000)
自1978年世界首例试管婴儿Louise Brown诞生以来,辅助生殖技术(assisted reproductive technology,ART)已成为治疗不孕症的重要方法[1]。但同时ART技术的安全性也日益成为人们关注的焦点。在ART治疗过程中,超生理剂量的激素类药物使用是否会对女性远期健康产生不良影响,值得关注;促排卵药物的使用会使机体性激素水平升高,反复周期性使用促排卵药物是否会增加女性远期罹患乳腺癌、子宫内膜癌和卵巢癌等妇科肿瘤的风险,以及内分泌代谢系统和心血管系统的远期并发症等风险是否会增加,目前尚无定论[2]。虽然,目前大多数研究报道对ART的安全性持乐观态度,但由于ART未经正常生殖活动中的自然选择过程,可能会将一些缺陷遗传给下一代[3]。
在临床工作中,为提高妊娠率,常使用控制性超促排卵(controlled ovarian hyperstimulation,COH)来促进卵巢内多个卵泡同时发育,由此获得更多的胚胎进行移植。但部分不孕患者在接受1次COH治疗后并不能成功妊娠,需要接受多个COH周期。本研究通过比较不同COH次数患者的临床资料,探讨反复COH对胚胎发育潜能及临床妊娠结局的影响。
1 资料与方法
1.1 一般资料回顾性分析2014年1月至2020年7月于河南省人民医院生殖医学中心接受体外受精-胚胎移植(invitrofertilization-embryo transfer,IVF-ET)助孕治疗的7 086例患者的临床资料。病例纳入标准:(1)女方年龄≤35岁;(2)新鲜取卵周期,受精方式为IVF;(3)不孕年限<5 a;(4)基础卵泡刺激素(follicle stimulating hormone,FSH) 5.00~10.00 IU·L-1;(5)COH次数≤4。排除标准:(1)夫妇双方染色体均异常;(2)卵巢功能不全[4];(3)复发性流产[5]及反复种植失败[6]者;(4)补救单精子卵胞浆内注射(rescue intra-cytoplasmic sperm injection,Re-ICSI)助孕周期、经皮附睾穿刺取精(percutaneous epididymal sperm aspiration,PESA)助孕周期、睾丸穿刺取精(testicular sperm aspiration,TESA)周期、显微手术取精助孕周期、供精/卵助孕周期者。根据COH次数将患者分为A组(首次行COH者)、B组(第2次行COH者)及C组(第3次或第4次行COH者)。3组患者的年龄、体质量指数(body mass index,BMI)、不孕类型、基础卵泡雌激素(base follicle-stimulating hormone,b-FSH)、抗苗勒管激素(anti-müllerian hormone,AMH)比较差异均无统计学意义(P>0.05)(表1),具有可比性。本研究经河南省人民医院医学伦理委员会批准通过。
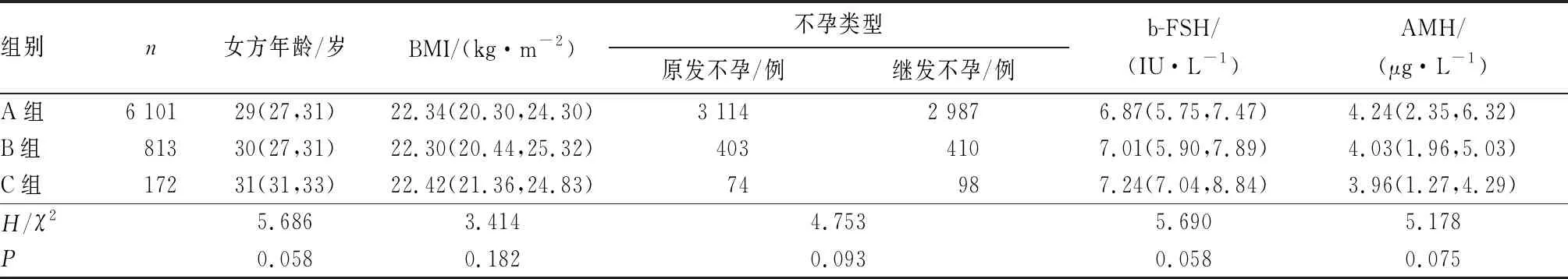
表1 3组患者一般资料比较
1.2 方法
1.2.1 促排卵方案及卵母细胞的采集与处理接受助孕治疗的患者按常规方案进行COH[7],当双侧卵巢的主导卵泡直径≥18 mm时,肌内注射人绒毛膜促性腺激素(human chorionic gonadotropin,HCG)10 000 U,36~37 h后在阴道超声引导下,采集卵冠丘复合物,置于37 ℃、含体积分数6%CO2、体积分数5%O2的饱和湿度培养箱中培养。
1.2.2 精液处理采用密度梯度离心法处理精液。对液化后的精液进行充分混匀,将精液放入密度梯度液上方,以1 500 r·min-1离心15 min,弃去精子沉淀团上的大部分上清液,用2 mL培养液重悬精子沉淀团,轻轻吹打后,1 500 r·min-1离心5 min,用培养液再次重悬精子沉淀团,并用精子全自动分析仪测定精子浓度和活动率。
1.2.3 授精授精时取精子上游液最上层精子调整密度至(1~2)×109L-1,精子加入含有卵冠丘复合物的培养液微滴,每滴(50 μL)约含5 000~10 000 条精子;短时受精患者,精卵共孵育约4 h后机械剥离颗粒细胞;长时受精患者,授精16~18 h后机械剥离颗粒细胞。
1.2.4 胚胎观察及评分授精后16~18 h观察胚胎受精情况,以出现2个原核及2个极体作为正常受精的标准。按照本中心常规培养胚胎流程进行培养。取卵后第2天和第3天分别于倒置显微镜下评估卵裂期胚胎的形态。本中心卵裂期胚胎评分参考Brian Dale评分标准[8]:1级:细胞大小均匀、形态规则,透明带完整,胞质清晰、无颗粒现象,碎片比例<5%;2级:细胞大小略不均匀、形态略不规则,胞质内可见颗粒现象,碎片比例6%~20%;2.5级:细胞大小均匀或略不均匀、形态规则或略不规则,碎片比例21%~25%;3级:细胞大小明显不均匀、形态明显不规则,胞质内可见颗粒现象,碎片比例 26%~50%;4级:细胞大小严重不均匀,胞质内可见严重的颗粒现象,碎片比例>50%。可利用胚胎判断标准为:1级、2级或2.5级胚胎,且同时满足取卵后第1天正常受精、取卵后第2天至第3天至少增长2个卵裂球、取卵后第3天胚胎卵裂球数≥4个。
1.3 观察指标记录3组患者胚胎发育指标,包括卵子成熟率、正常受精率、正常卵裂率和可利用胚胎率。卵子成熟率=成熟卵子数/获卵数×100%;正常受精率=两原核胚胎数/获卵数×100%;正常卵裂率=第2天发生卵裂的两原核胚胎数/两原核胚胎总数×100%;可利用胚胎率=第3天可利用胚胎数/第2天发生卵裂的两原核胚胎数×100%。
1.4 临床结局评价患者于胚胎移植后按黄体支持方案继续给予黄体支持,移植后14 d测外周血β-人绒毛膜促性腺激素(β-human chorionic gonadotropin,β-HCG)水平,β-HCG≥50 IU·L-1为生化妊娠。生化妊娠者于移植后4~5周行阴道超声检查,若有孕囊及原始心管搏动,则为临床妊娠。若 β-HCG阳性、子宫内未见孕囊,但宫外附件区可见孕囊者,经腹腔镜及术后组织病理检查确诊为异位妊娠,并及时处理。妊娠不足28周、胎儿体质量不足1 000 g而终止妊娠者为流产。流产发生于妊娠12周前者为早期流产。胚胎种植率=胎心数/移植胚胎数×100%;生化妊娠率=生化妊娠例数/移植周期数×100%;临床妊娠率=临床妊娠例数/移植周期数×100%;异位妊娠率=异位妊娠例数/临床妊娠例数×100%;流产率=早期流产例数/临床妊娠例数×100%;早期流产率=早期流产例数/临床妊娠例数×100%。

2 结果
2.1 3组患者胚胎发育指标比较结果见表2。3组患者的卵子成熟率、正常受精率随COH次数的增加有下降趋势,但差异无统计学意义(P>0.05)。A组患者的正常卵裂率和可利用胚胎率均显著高于B组、C组,差异有统计学意义(P<0.05);B组与C组患者的正常卵裂率、可利用胚胎率比较差异无统计学意义(P>0.05)。
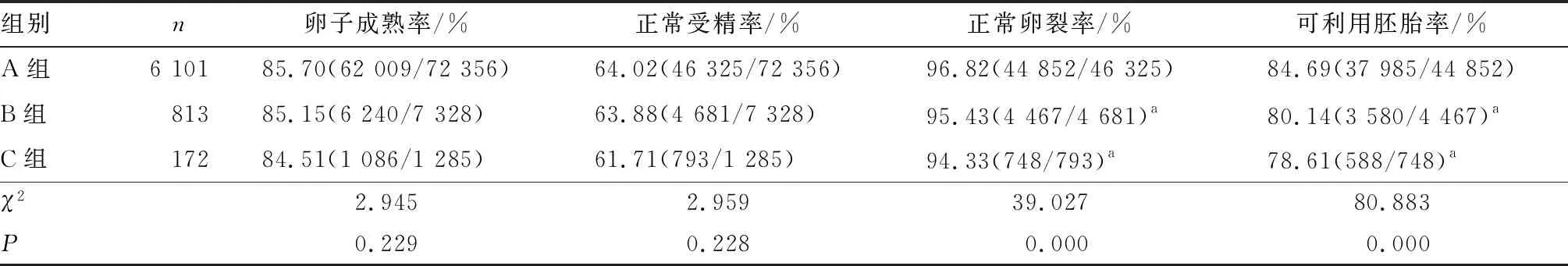
表2 3组患者胚胎发育指标比较
2.2 3组患者临床妊娠结局比较结果见表3。A组患者的胚胎种植率、生化妊娠率、临床妊娠率均显著高于B组和C组,差异有统计学意义(P<0.05);B组与C组患者的胚胎种植率、生化妊娠率、临床妊娠率比较差异无统计学意义(P>0.05)。3组患者的异位妊娠率比较差异无统计学意义(P>0.05)。B组患者的流产率和早期流产率显著高于A组,差异有统计学意义(P<0.05);其余各组患者流产率和早期流产率比较差异均无统计学意义(P>0.05)。

表3 3组患者妊娠结局比较
3 讨论
在应用ART治疗不孕不育患者的过程中,很多患者由于没有足够的可利用胚胎,需要经过多个治疗周期才能得到活产婴儿。这些患者在一定时间内需要进行多次控制性促排卵治疗,COH治疗是否会对子代健康、女性健康,尤其是卵巢的结构和功能造成影响,已成为不可忽视的问题。基于此,本研究回顾性分析了接受IVF-ET助孕治疗患者的临床资料,旨在探讨反复COH对胚胎发育潜能及妊娠结局的影响。为排除由于年龄及卵巢功能不全造成的影响,研究对象均为年龄≤35岁且卵巢储备功能正常的女性,同时排除夫妇双方染色体异常者、复发性流产及反复种植失败者;为排除男方因素的影响,排除Re-ICSI周期、PESA周期、TESA周期、显微手术取精周期及供精/卵助孕周期者。通过比较各组患者胚胎发育指标发现,3组患者的卵子成熟率、正常受精率比较差异无统计学意义;A组患者正常卵裂率和可利用胚胎率均显著高于B组、C组,B组与C组患者的正常卵裂率、可利用胚胎率比较差异无统计学意义。本研究还发现,A组患者的胚胎种植率、生化妊娠率、临床妊娠率均显著高于B组和C组,但A组患者的异位妊娠率与B组和C组比较差异无统计学意义。以上结果提示,多次COH可能会影响卵母细胞的质量及胚胎的发育潜能,继而影响妊娠结局。
目前已有关于COH治疗的安全性评估报道,但尚无定论。这些评估大多是针对临床病例的调查性研究,缺乏对COH远期影响的评估。ART的实施阶段正处于表观遗传重编辑的关键时期,若在ART治疗过程中,基因印记缺失发生于配子形成过程,不仅会影响胚胎形成、发育、胎盘分化及胎儿生长,还会导致印记基因失调性疾病[9],这可能与 IVF 过程中应用培养液或促排卵药物有关,但也不能排除是不孕因素本身导致的配子形成受损,目前尚缺乏确切的证据。对动物模型的研究发现,COH以剂量依赖的方式影响卵母细胞DNA的甲基化修饰水平[10],且对早期胚胎表观遗传学修饰有明显的影响[11]。在小鼠实验和人体研究中[12],使用大剂量的促性腺激素后,除H19以外,印记基因DNA甲基化并未发生改变。但另有研究发现,COH并不会引起胚胎印记基因的改变[13]。以上研究均表明了COH不会明显影响卵母细胞印记基因的DNA甲基化模式,但会影响卵母细胞的质量。
反复COH可影响卵母细胞的质量,但具体机制尚不明确。研究发现,反复COH可以对小鼠的卵巢造成氧化损伤,引起线粒体DNA突变[14],造成小鼠卵母细胞中细胞器分布的改变[15],引起胚胎发育延缓,增加异常囊胚形成的概率,造成胎儿生长迟缓。这些改变表明COH可能影响了小鼠卵母细胞的质量[16]。另有报道指出,反复的卵巢刺激可增加小鼠卵母细胞纺锤体缺陷的发生率[17]。本课题组前期研究证明,反复COH可降低小鼠颗粒细胞线粒体DNA拷贝数,影响颗粒细胞线粒体编码基因的表达[18]。卵母细胞的发育潜能与其周围的颗粒细胞相关[19]。颗粒细胞为卵母细胞的发育提供能量及必要的营养物质。在真核生物中,线粒体是提供能量和代谢底物的基础细胞器。有研究表明,小鼠卵母细胞线粒体DNA拷贝数下降至正常值的11%时不会影响排卵及卵子的受精能力,但当小鼠胚胎的线粒体拷贝数少于50 000时其着床能力会受到影响[20]。说明线粒体拷贝数达到一定阈值时胚胎才能正常发育。因此,推测反复COH可能影响了颗粒细胞的线粒体功能,从而影响卵母细胞的发育潜能。本研究中患者的2PN胚胎卵裂率及可利用胚胎率随促排次数的增加而下降,证实了反复COH对卵子成熟及胚胎发育潜能有影响。
此外,有研究发现,COH对小鼠子代有不利影响[21]。有研究发现,反复COH可以造成恒河猴子代卵巢结构和功能的改变[22]。DIAMOND等[23]进行的临床调查研究发现,连续的COH可能会影响卵巢的反应性和(或)改变卵母细胞的质量。有研究发现,在IVF治疗的5个周期中,每个周期获得的卵子数目基本相同,并且卵子质量也无明显差异,故反复COH过程中年龄的增长可能才是妊娠率、出生率低的决定性因素[24]。虽然越来越多的研究者专注于反复COH对卵巢或卵母细胞的影响,但迄今为止未能得到明确结论,这可能是因为不同研究中患者的身体状况不同、药物使用不一致或随访时间不同等造成的[25]。
目前主要提倡自然周期IVF,有研究认为,自然周期可以减少潜在的不良围产期结局,同时得到健康子代的概率又不低于COH治疗的患者[26]。本研究结果也提示,多次COH可能会影响卵母细胞的质量、胚胎发育潜能及妊娠结局。ART治疗不应追求获卵数,而应提高卵子的利用率,减少并发症的发生。但本研究尚有一定的局限性,如不同患者使用的促排卵药物不尽相同,且不能排除混杂因素的影响,故反复COH对胚胎发育潜能及妊娠结局的影响,尚需进一步的研究。

