血清25-羟维生素D3水平与帕金森病患者脑小血管病的相关性
宋晓贇,杨改清,徐志强,胡琼琼,陈赛男,胥丽霞,贺彩红,张东亚
(1.新乡医学院,河南 新乡 453003;2.郑州大学附属郑州中心医院神经内科,河南 郑州 450002)
预计2030年全球范围内帕金森病(Parkinson′s disease,PD)的年患病率将增加到(15~27)/10万[1]。神经影像学技术的进步,明显提高了脑小血管病(cerebral small vessel disease,CSVD)的诊断率。研究发现,PD 患者伴发CSVD的比例可高达76%[2]。合并CSVD会严重影响PD患者的生活质量、生存寿命、社会功能,给家庭和社会造成巨大的负担[3-4],因此,应加强对PD患者伴发CSVD的重视,探索PD 患者伴发CSVD的影响因素。维生素D(vitamin D,VD)不仅是一种调节人体血清钙磷代谢和维持骨骼健康的必需维生素,还是一种可与维生素D受体(vitamin D receptor,VDR)结合发挥相应生物学效应的固醇类衍生物。VDR主要存在于内皮细胞、血管平滑肌细胞、神经元、神经胶质细胞等[5];VD直接激活VDR,使核受体定位在靶基因调节区,结合VD反应元件,从而调节特定基因产物的转录和表达[6]。临床上常选择半衰期较长、成分较稳定的血清25-羟维生素D3[25-hydroxyvitamin D3,25-(OH)D3]作为评估VD的生物标志物。目前许多研究发现,PD患者普遍存在血清 25-(OH)D3不足或缺乏的现象[7-10]。有研究发现,较低水平的血清25-(OH)D3是CSVD发病的危险因素,与CSVD的严重程度具有相关性[11-15]。因此,本研究旨在探讨血清25-(OH)D3水平与PD患者伴发CSVD的相关性,以期为临床医生对PD 患者伴发CSVD的早期预防及诊疗提供参考。
1 资料与方法
1.1 一般资料选择2017年6月至2021年12月郑州大学附属郑州中心医院神经内科收治的203例PD患者为研究对象(PD组),其中男98例,女105例;年龄60~75(67.23±3.16)岁,体质量指数(body mass index,BMI)17~28(22.82±2.56)kg·m-2。病例纳入标准:(1)符合英国PD脑库制定的PD诊断标准[1];(2)年龄60~75岁;(3)病历资料完善。排除标准:(1)脑炎、外伤、中毒、药物等所导致的帕金森综合征和帕金森叠加综合征;(2)近期有外伤或外科手术史(如脑深部电刺激术等)的PD患者;(3)有内分泌、血液、免疫系统疾病、恶性肿瘤及肝肾功能障碍的PD患者;(4)近0.5 a内服用VD和钙的PD患者。另选择50例同期在本院进行体检的健康人群为对照组,其中男23例,女27例;年龄60~75(67.02±3.44)岁,BMI 17~28(22.75±2.70)kg·m-2。PD组与对照组受试者的性别、年龄、BMI比较差异均无统计学意义(P>0.05),具有可比性。根据中国脑小血管病诊治共识关于CSVD影像学诊断标准[16],通过颅脑磁共振成像资料确定PD患者是否伴发CSVD,根据是否伴发CSVD将PD患者分为PD伴CSVD组(n=117)与PD不伴CSVD组(n=86)。本研究通过郑州大学附属郑州中心医院伦理委员会批准,受试者均知情同意并签署知情同意。
1.2 观察指标(1)一般临床资料:通过查阅病历收集PD患者的临床资料,包括性别、年龄、BMI、既往有无糖尿病、高血压、高脂血症、吸烟史。(2)血细胞计数:采集PD患者清晨空腹静脉血3 mL,应用Sysmex公司全自动血细胞分析仪XN9000 测定白细胞(white blood cell,WBC)、红细胞(red blood cell,RBC)、血小板(platelet,PLT)计数。(3)糖化血红蛋白(glycated hemoglobin,HbA1C):采集PD患者清晨空腹静脉血3 mL,应用上海惠中生物科技有限公司全自动糖化血红蛋白分析仪MQ-6000及配套试剂盒测定HbA1C水平。(4)同型半胱氨酸(homocysteine,Hcy):采集PD患者清晨空腹静脉血3 mL,3 500 r·min-1离心15 min后,取上层血清,应用美国雅培公司全自动化学发光免疫分析仪i2000SR及配套试剂盒测定血清中Hcy水平。(5)血脂及肾功能指标:采集PD患者清晨空腹静脉血5 mL,3 500 r·min-1离心15 min后,取上层血清,应用美国雅培公司全自动生物化学分析仪C16000及配套试剂盒测定血清中总胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)、三酰甘油(triglyceride,TG)、胱抑素C (cystatin C,Cys-C)、尿酸(uric acid,UA)水平。(6)血清C反应蛋白(C-reactive protein,CRP):采集PD患者清晨空腹静脉血5 mL,3 500 r·min-1离心15 min后,取上层血清,采用乳胶增强免疫比浊法测定血清CRP水平,试剂盒购自上海惠中生物科技有限公司,严格按试剂盒说明书进行操作。(7)血清 25-(OH)D3水平:采集2组受试者清晨空腹静脉血3 mL,3 500 r·min-1离心10 min 后,取上层血清,应用罗氏公司e601型全自动电化学发光免疫分析仪以及配套试剂盒测定血清 25-(OH)D3水平,严格按试剂盒说明书进行操作。

2 结果
2.1 PD组与对照组受试者血清25-(OH)D3水平比较对照组和PD组受试者的血清25-(OH)D3水平分别为26.33(22.46,26.33) 、11.40(7.69,14.91) μg·L-1;PD组患者的血清25-(OH)D3水平显著低于对照组,差异有统计学意义(Z=-9.965,P<0.05)。
2.2 PD不伴CSVD组和PD伴CSVD组患者的一般资料比较结果见表1。PD不伴CSVD组和PD伴CSVD组患者的年龄、糖尿病病史比例、BMI及WBC、RBC、PLT、TC、HbA1C、UA、TG、Hcy、CRP水平比较差异均无统计学意义(P>0.05);PD伴CSVD组男性比例、高血压病史比例、高脂血症史比例、吸烟者比例及血清LDL-C、Cys-C水平显著高于PD不伴CSVD组,血清HDL-C、25-(OH)D3水平显著低于PD不伴CSVD组,差异有统计学意义(P<0.05)。

表1 PD不伴CSVD组和PD伴CSVD组患者的一般资料比较
2.3 PD伴发CSVD的影响因素单因素分析结果见表2。以PD患者是否伴发CSVD为因变量(是=1,否=0),以性别、年龄、BMI、糖尿病病史、高血压病史、高脂血症、吸烟、WBC、RBC、PLT、TC、LDL-C、HDL-C、TG、HbA1C、Hcy、Cys-C、25-(OH)D3、UA、CRP为自变量建立logistic回归模型,结果显示,男性、高血压病史、高脂血症、吸烟、LDL-C、HDL-C、Cys-C、25-(OH)D3与PD伴发CSVD相关(OR=2.184、2.920、1.928、2.049、1.895、0.346、9.229、0.854,P<0.05)。

表2 PD伴CSVD的影响因素单因素logistic分析结果
2.4 PD伴发CSVD的影响因素多因素分析结果见表3。以PD患者是否伴发CSVD为因变量(否=0,是=1),以单因素分析中差异有统计学意义的指标为自变量进行多因素logistic回归分析,结果显示,男性、高血压病史、吸烟、LDL-C是PD伴发CSVD的危险因素(OR=2.290、2.556、2.003、1.667,P<0.05),25-(OH)D3是PD伴发CSVD的保护因素(OR=0.862,P<0.05)。校正性别、高血压病史、吸烟、LDL-C后,25-(OH)D3仍是影响PD伴发CSVD的独立影响因素。
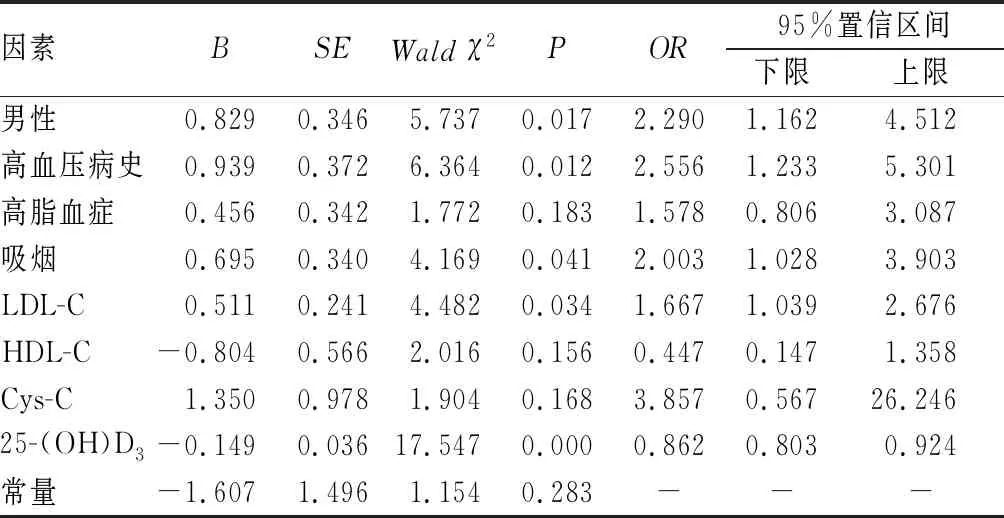
表3 PD伴发CSVD的影响因素多因素logistic分析结果
2.5 血清25-(OH)D3对PD伴发CSVD的预测价值结果见图1。ROC曲线分析结果显示,血清25-(OH)D3预测PD伴发CSVD的曲线下面积为0.721(95%置信区间:0.651~0.791,P<0.05)。当血清25-(OH)D3<10.465 μg·L-1,预测PD伴发CSVD的灵敏度为59.8%,特异度为77.9%。
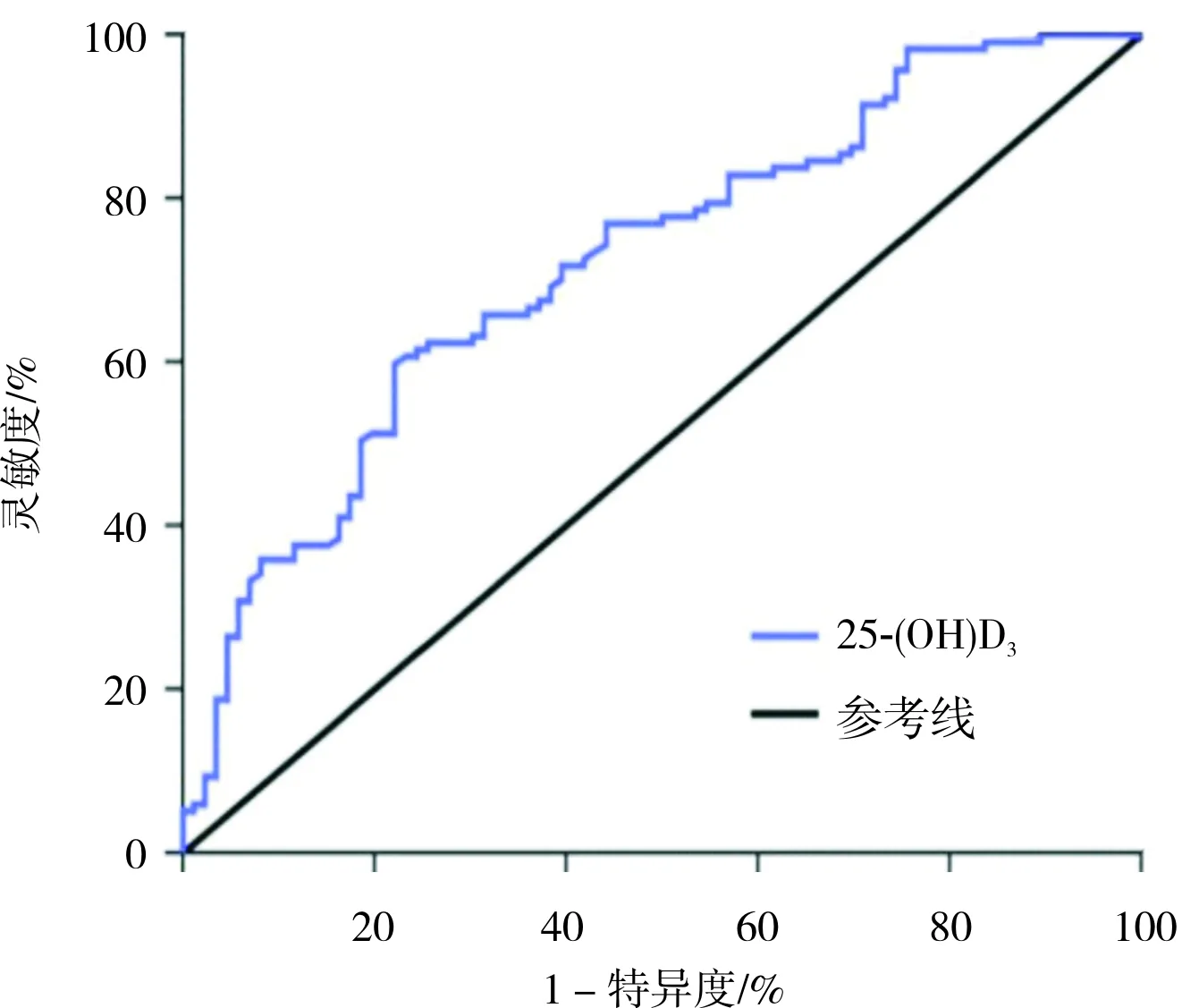
图1 血清25-(OH)D3预测PD患者伴发CSVD的ROC曲线
3 讨论
PD是一种慢性进行性神经变性疾病,临床主要表现为静止性震颤、肌强直、动作迟缓、姿势平衡障碍等运动症状,以及嗅觉减退、睡眠障碍、自主神经功能紊乱、认知功能减退、焦虑抑郁等非运动症状。有研究表明,2030年我国PD患病人数将达到500万[17]。CSVD起病隐匿、发展缓慢,临床表现常缺乏特异性,可表现为认知功能下降、精神情感改变、步态障碍、吞咽及排尿功能异常等症状。近年来,约76%的PD患者可合并CSVD[2]。研究发现,合并CSVD与PD患者临床症状的严重程度密切相关[18],CSVD将会进一步加重PD患者的运动症状和部分非运动症状[19-20]。目前,CSVD和PD均无特效药,无法彻底治愈,只能通过对症治疗来改善患者临床症状,二者均对患者的生活质量、生存寿命、社会功能带来不良影响,给家庭和社会造成巨大的经济负担和生活负担。因此,关注PD伴发CSVD的危险因素和保护因素至关重要。
VD是具有多种生物学效应的脂溶性类固醇激素,临床上常选定半衰期较长、成分较稳定的25-(OH)D3作为评估VD的生物标志物。25-(OH)D3的主要作用是调节人体血清钙磷代谢和维持骨骼健康,但有研究发现,血清25-(OH)D3水平较低会激活肾素-血管紧张素-醛固酮系统(reninangiotensin-aldosterone system,RAAS),导致血管平滑肌、内皮细胞发生变化,从而产生致病作用[21]。此外,25-(OH)D3水平降低还对动脉粥样硬化斑块中淋巴细胞和巨噬细胞的活性产生影响,导致动脉血管壁出现慢性炎症[22]。有研究发现,25-(OH)D3还会通过使脂代谢和血压失调,导致微血管损伤[23]。因此,推测25-(OH)D3可能参与PD患者伴发CSVD的发生发展,其潜在作用机制可能为:低水平的25-(OH)D3通过降低一氧化氮水平、增加氧化应激反应、促进炎症细胞增殖、激活活性氧、调节RAAS等,造成脑部血管内皮功能障碍,使脑部血管的结构和排列发生变化,从而参与CSVD的发生发展。
研究发现,在血清25-(OH)D3不足或缺乏的情况下,CSVD的发病率增加[11]。老年人血清25-(OH)D3水平与CSVD呈负相关[12]。研究报道,血清25-(OH)D3水平和腔隙性梗死患者血管周围间隙扩大的严重程度独立相关[13];血清25-(OH)D3水平与老年腔隙性脑梗死和脑白质病变显著相关,可通过监测血清25-(OH)D3水平预测CSVD病变发生[14]。既往研究发现,与健康人群相比,PD患者普遍存在25-(OH)D3不足或缺乏[7]。本研究结果显示,PD患者的血清25-(OH)D3水平显著低于对照组,与既往研究报道[7]一致,这进一步证实,血清25-(OH)D3可能参与了PD的发生发展,监测PD患者的血清25-(OH)D3水平对PD的预防和治疗有重要意义。此外,本研究结果显示,PD伴CSVD组男性比例、高血压病史比例、高脂血症史比例、吸烟者比例及血清LDL-C、Cys-C水平显著高于PD不伴CSVD组,血清HDL-C、25-(OH)D3水平显著低于PD不伴CSVD组;单因素分析结果显示,性别、高血压病史、高脂血症、吸烟、LDL-C、HDL-C、Cys-C、25-(OH)D3与PD伴发CSVD相关;多因素logistic回归分析结果显示,男性、高血压病史、吸烟、LDL-C为PD伴发CSVD的危险因素,25-(OH)D3为PD伴发CSVD的保护因素;校正性别、高血压病史、吸烟、LDL-C后,25-(OH)D3仍为PD患者伴发CSVD的独立影响因素。由此可见,血清25-(OH)D3可能参与了PD伴发CSVD的发生发展,血清25-(OH)D3水平与PD患者伴发CSVD呈负相关,是PD伴发CSVD的保护因素。此外,本研究ROC曲线分析结果显示,血清25-(OH)D3的曲线下面积为0.721(95%置信区间:0.651~0.791,P<0.05),当血清25-(OH)D3水平<10.465 μg·L-1时预测PD患者伴发CSVD的灵敏度为59.8%,特异度为77.9%;这说明,25-(OH)D3对PD伴发CSVD具有良好的预测价值。
综上所述,血清25-(OH)D3水平为PD患者伴发CSVD的保护因素,男性、高血压病史、吸烟、LDL-C 为PD患者伴发CSVD的危险因素;较低血清 25-(OH)D3水平为PD患者伴发CSVD的独立危险因素,血清25-(OH)D3水平对PD患者伴发CSVD 具有良好的预测价值。但本研究为单中心、回顾性研究,病例数相对较少,且数据收集过程中有缺失数据,可能在最终入组时存在选择偏倚;另外,入组的个体选取于不同季节,而季节不同会使个体外出活动接受光照时间不同,这会影响个体的血清25-(OH)D3水平;因此,还需要多中心、长时间、大样本的前瞻性研究来进一步探讨。

