多囊蛋白-1在急性主动脉夹层发病机制中的作用
王 蕾,崔立坤,张 琳,刘 娜
(郑州大学第一附属医院急救中心,河南 郑州 450052)
急性主动脉夹层(aortic dissection,AD)是一种急性大血管病变,致死率极高,严重危及人类健康,目前其发病机制仍不明确[1-2]。AD的主要病理特征是动脉壁中层退行性变[3-4],血管平滑肌细胞(vascular smooth muscle cell,VSMC)凋亡被认为是主动脉中层退行性变的重要原因[5-6]。多囊蛋白-1(polycystin-1,PC-1)是由多囊肾病1型(polycystic kidney disease 1,PKD1)基因编码的蛋白,是常染色体显性遗传多囊肾病(autosomal dominant polycystic kidney disease,ADPKD)的重要致病基因之一。研究表明,约85%的ADPKD患者存在PKD1基因突变[7-8]。PC-1广泛存在于肾小管上皮细胞及VSMC,对维持血管壁结构的完整性和稳定性具有重要作用。研究显示,PC-1在AD的发病机制中起重要作用,其可以通过活化磷脂酰肌醇-3-激酶/蛋白激酶B(phosphatidylinositol 3-hydroxy kinase/protein kinase B,PI3K/Akt)信号通路而参与调控多种细胞凋亡过程[9-12],但其是否影响主动脉VSMC凋亡过程而参与急性AD发病机制,目前尚未见文献报道。本研究通过观察AD患者主动脉组织中PC-1及相关信号通路蛋白、细胞凋亡相关蛋白的表达,探讨PC-1在AD发病机制中的作用及分子机制。
1 资料与方法
1.1 组织标本来源收集2019年10月至2020年1月于郑州大学第一附属医院行主动脉弓置换术的6例急性AD患者的病变主动脉组织标本作为AD组。其中男4例,女2例;年龄39~64(50.33±8.80)岁。纳入标准:从发病到确诊时间≤24 h,且经血管超声、CT血管成像和磁共振血管成像检查确诊。排除标准:(1)年龄小于18岁;(2)马方综合征;(3)Ehlers-Danlos综合征;(4)Turner综合征;(5)家族性胸(腹)主动脉瘤;(6)主动脉溃疡或主动脉壁间血肿形成者;(7)妊娠;(8)术中证明非主动脉夹层的患者;(9)创伤所致夹层;(10)术后患者。另选择6例非主动脉疾病的器官捐赠者的正常主动脉组织标本作为对照组。其中男3例,女3例;年龄33~68(51.67±12.34)岁。器官捐赠者选择既往身体健康,突发疾病引起不可逆的脑死亡患者,且无心血管疾病。2组受试者的性别、年龄比较差异无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会批准,所有受试者和(或)家属签署知情同意书。将一部分主动脉组织离体10 min内置于液氮后转移至-80 ℃冰箱中保存,用于蛋白表达分析;另一部分主动脉组织保存于甲醛溶液中,用于SM22α免疫荧光/DNA末端转移酶介导的dUTP缺口末端标记法(TdT-mediated biotinylated-dUTP nick end labeling,TUNEL)双标染色分析。
1.2 试剂与仪器TUNEL细胞凋亡检测试剂盒购自德国Roche公司,4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)染料购自美国Sigma-Aldrich公司,二喹啉甲酸蛋白定量试剂盒购自北京康为世纪生物科技股份有限公司,聚偏二氟乙烯膜购自美国Millipore公司,cleaved caspase-3、cleaved caspase-7、cleaved caspase-9、Bcl-2、Bax、PI3K(p85)、PI3K(p110β)、Akt(p-Ser-Akt和p-Thr-Akt)等抗体均购自英国Abcam公司,SM22α抗体购自武汉三鹰生物技术有限公司,Pierce增强化学发光(enhanced chemiluminescence,ECL)试剂购自芬兰Affifinity Biosciences公司。
1.3 Western blot法检测2组受试者主动脉组织中凋亡相关蛋白及PI3K/Akt信号通路相关蛋白的磷酸化位点表达取主动脉组织,加入组织裂解液提取总蛋白,二喹啉甲酸蛋白测定试剂盒检测蛋白浓度,以β-actin为内参对样本蛋白进行标准化处理。每组取40 μg样品蛋白与等量的标准蛋白,进行100 g·L-1十二烷基硫酸钠-聚丙烯酰胺凝胶电泳;然后电转移到聚偏二氟乙烯膜上,加入50 g·L-1脱脂奶粉封闭膜1 h,用兔抗人cleaved caspase-3(滴度1500)、cleaved caspase-7(滴度11 000)、cleaved caspase-9(滴度1500)、Bcl-2(滴度11 000)、Bax(滴度11 000)、p85(滴度11 000)、p110β(滴度1500)、Akt(滴度1500)、p-Ser-Akt(滴度12 000)、p-Thr-Akt(滴度1500)、β-actin(滴度12 000)一抗,4 ℃孵育过夜;然后加入羊抗兔辣根过氧化物酶二抗(滴度120 000),37 ℃孵育4 h;加入ECL试剂发光,应用Image-pro Plus 6.0凝胶图像处理系统分析条带灰度值,以目的蛋白与内参蛋白条带灰度值的比值表示目的蛋白的相对表达量。
1.4 SM22α免疫荧光/TUNEL双标染色法检测2组受试者主动脉VSMC凋亡情况采用免疫荧光染色定位VSMC分子标记SM22α,通过TUNEL染色评估细胞凋亡情况。取主动脉组织石蜡切片,脱蜡、水化,先加入抗SM22α单克隆抗体(滴度1500),放在湿盒中,4 ℃过夜;磷酸盐缓冲液(phosphate buffered solution,PBS)漂洗3次,再滴加Cy3标记的二抗(滴度1100),37 ℃避光孵育1 h,PBS漂洗3次;根据TUNEL凋亡检测试剂盒说明书操作,配置、滴加反应液,37 ℃避光孵育1 h,PBS漂洗3次,封片。在荧光显微镜下观察并采集图像,每组至少选取5张切片,每张切片选取5个不重复视野,用Image-pro Plus 6.0软件分析图片的荧光强度。

2 结果
2.1 2组受试者主动脉组织中PC-1蛋白表达比较结果见图1。对照组和AD组主动脉组织中PC-1蛋白的相对表达量分别为1.00±0.07和0.72±0.04,AD组主动脉组织中PC-1蛋白的相对表达量显著低于对照组,差异有统计学意义(t=7.614,P<0.01)。
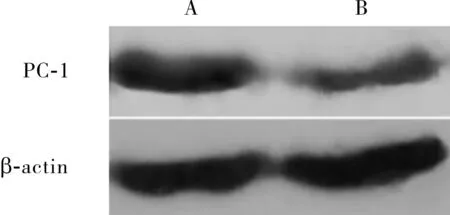
注:A:对照组;B:AD组。
2.2 2组主动脉VSMC凋亡水平比较结果见图2。对照组和AD组主动脉VSMC凋亡的荧光强度分别为59.03±4.57和71.26±8.25,AD组主动脉VSMC凋亡的荧光强度显著高于对照组,差异有统计学意义(t=3.178,P<0.05)。
2.3 2组主动脉组织中凋亡相关蛋白表达比较结果见图3和表1。AD组患者主动脉组织中cleaved caspase-3、cleaved caspase-7、cleaved caspase-9、Bax蛋白相对表达量显著高于对照组,差异有统计学意义(P<0.01);AD组患者主动脉组织中Bcl-2蛋白相对表达量显著低于对照组,差异有统计学意义(P<0.01)。
2.4 2组主动脉组织中PI3K/Akt信号通路相关蛋白的磷酸化位点表达比较结果见图4和表2。AD组患者主动脉组织中PI3K的p85、P110β磷酸化位点及Akt的p-Ser-Akt、p-Thr-Akt磷酸化位点的相对表达量显著低于对照组,差异有统计学意义(P<0.01)。
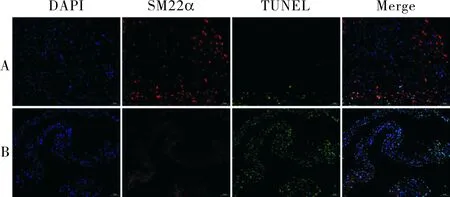
注:A:对照组;B:AD组。

注:A:对照组;B:AD组。

表1 2组受试者主动脉组织中凋亡相关蛋白相对表达量比较

注:A:对照组;B:AD组。

表2 2组受试者主动脉组织中PI3K/Akt信号通路相关蛋白的磷酸化位点表达比较
3 讨论
AD是一种严重危及患者生命的大血管疾病,发病率为(6~30)/100万,其凶险程度远高于脑梗死、心肌梗死和恶性肿瘤[1]。VSMC凋亡导致大量细胞丢失引起的中层退行性变在AD的发病机制中起重要作用,但其分子发病机制至今尚未完全阐明。因此,进一步研究AD的发病机制对AD的有效预防、早期诊断和治疗具有重要意义。
本课题组前期研究发现,AD患者血浆和主动脉组织中miR-4787-5p表达显著升高,还通过生物信息分析、双荧光素报告和Western bolt法证实了miR-4787-5p与PC-1之间的靶基因及负调节关系[13]。关于PC-1的研究大多集中于ADPKD的发病机制与治疗[14-16],但仍有少量阐述PC-1与AD发病机制的相关研究。有研究显示,AD患者的主动脉组织中PC-1表达显著下调[17]。FENG等[10]研究发现,AD患者主动脉组织中PC-1表达下调可以通过提高细胞外调节蛋白激酶的磷酸化来改变VSMC的表型,使其从收缩型向增殖型转变,从而参与AD的发病机制。有研究显示,PC-1可以通过活化PI3K/Akt信号通路参与调控细胞凋亡过程[12,18],这说明miR-4787-5p有可能通过调控PC-1来参与AD的发病机制,但其具体机制仍不清楚。
PC-1是一个大分子的膜蛋白,其结构主要包括胞外区、跨膜区和胞内区3部分。PC-1的胞外区具有一个很长的N-末端,有许多与配体结合的区域,在细胞间和(或)细胞基质间的相互连接中起重要作用。PC-1有11个跨膜区域,外部刺激可以通过该区域向细胞内传递信号。PC-1的胞内区是具有约200个氨基酸的C-末端区域,有很多磷酸化位点,通过调控其磷酸化水平来介导细胞内的各种信号转导通路,从而影响细胞的各项功能[19]。有研究显示,PC-1参与调控多种细胞的凋亡过程[12],BOCA 等[18]研究发现,过表达PC-1的犬肾上皮细胞(MDCK细胞)和肝癌细胞(HepG2细胞)可以通过活化PI3K/Akt信号通路来抑制凋亡的发生,而下调或敲除PKD1可以使细胞凋亡率明显升高。本研究结果显示,AD患者主动脉组织中PC-1蛋白表达显著降低,这说明PC-1有可能通过促进主动脉组织的细胞凋亡参与AD的发生发展。
为探讨AD组织中PC-1蛋白低表达是否会促进细胞凋亡,本研究采用免疫荧光/TUNEL双标染色检测了AD患者病变主动脉VSMC的凋亡情况,结果显示,AD患者病变主动脉VSMC凋亡显著增多,且AD患者主动脉组织中促凋亡蛋白cleaved caspase-3、cleaved caspase-7、cleaved caspase-9、Bax表达显著升高,抗凋亡蛋白Bcl-2表达显著降低,提示AD患者促凋亡机制增强而抗凋亡机制减弱。为了进一步明确PC-1通过何种机制影响细胞凋亡,本研究检测了PI3K/Akt信号通路相关蛋白磷酸化位点的表达,结果显示,AD患者主动脉组织中PI3K的p85、p110β磷酸化位点及Akt的p-Ser-Akt、p-Thr-Akt 磷酸化位点的表达显著降低。磷酸化位点表达水平越高说明该通路处于活化状态,而反之磷酸化位点表达水平降低表示该通路处于抑制状态,本研究结果表明,AD患者主动脉组织中PI3K/Akt信号通路处于抑制状态,这可能与PC-1蛋白低表达导致该通路失活有关。
综上所述,AD患者主动脉组织中PC-1蛋白表达降低,PC-1蛋白低表达可能通过抑制PI3K/Akt信号通路活化、提高促凋亡基因表达、降低抗凋亡基因表达而促进VSMC凋亡,导致主动脉壁薄弱,这可能是AD发病的潜在机制之一。本研究为AD的发病机制提供了一定的理论基础和依据,不足之处在于尚未完全明确其分子机制及内在联系,还有待后续实验进一步研究。

