双峰驼β-NGF基因的克隆及在生殖轴系的表达
王 杰,王 琪,张 勇,南京宏,成力童,赵兴绪*
(1.甘肃农业大学 动物医学院,甘肃 兰州 730070;2.甘肃省动物生殖生理及繁殖调控重点实验室,甘肃 兰州 730070)
双峰驼(camelus bactrianus)是我国重要的优势畜种资源,具有十分重要的经济和科研价值。由于其具有独特的生殖生理特性,它们对极其严酷的荒漠环境具有很强的适应能力。近40年来,双峰驼的存栏数量急剧下降,究其原因,除养驼业经济效益低和草场退化外,其最主要的原因是双峰驼繁殖性能低,生长速度缓慢,而且是严格的季节性发情和诱导排卵型动物。
研究发现,公驼的精清中存在 “诱导排卵因子”(ovulation inducing factor,OIF)[1]。据报道,推测OIF是通过子宫内膜吸收,通过血液循环刺激下丘脑和垂体分泌LH,进而促使卵泡破裂而排卵[2]。同时,研究还发现OIF是一种神经生长因子(nerve growth factor,NGF),对哺乳动物卵泡发育、诱导排卵等方面有重要作用[3]。其中NGF包含了α、β和 γ 3个亚单位,活性区是β亚单位,由2个118个氨基酸组成的单链通过非共价键结合而成的二聚体。有人通过X衍射技术,检测到这种OIF是一种β型神经生长因子(β-NGF)[4]。研究发现,β-NGF大量存在于在小鼠肉瘤[5]、蛇毒[6]和小鼠唾液腺中[7]。β-NGF已被证明在多种非神经元系统中发挥作用,如免疫[8]、炎症[9]、生殖[10]和内皮组织中[11]。NGF被认为是生殖系统不同发育阶段的局部中介[7]。NGF敲除的幼鼠,初级和次级卵泡数量均低于野生型小鼠[11],说明NGF信号系统在胎儿卵巢发育中发挥着重要的作用。
本试验以双峰驼为研究对象,首先对β-NGF基因进行克隆和生物信息学分析,再通过免疫组织化学染色、qRT-PCR、免疫印迹技术检测β-NGF在双峰驼生殖轴系的表达,为深入研究双峰驼的繁殖及生殖调控提供理论依据。
1 材料与方法
1.1 样品选用张掖市雌性骆驼3峰(5~6岁),屠宰后取下丘脑、垂体、卵巢、子宫角和输卵管5种组织,部分投入液氮中保存,之后转入-80℃长期保存待用,取另一部分组织于10% 甲醛溶液固定备用。
1.2 主要仪器与试剂PCR仪(Applied Biosystems Veriti96 well,美国),离心机(Eppendorf Centrifuge 5424,德国),移液器(Eppendorf,德国),水浴锅(Boekl HOTTUB,美国),凝胶成像系统(Pland CA91786,美国),电子天平(FA2004C,中国),垂直超净工作台(AV-100,西班牙),分析天平(GB303,中国),超纯水仪(AFZ-0502-U,中国)。
TransZol UP RNA提取试剂盒(Code:ET111)购自北京全式金生物技术有限公司;TranStart Tip Green qPCR SuperMix(Code:AQ101-01)、焦碳酸二乙酯(Diethy pyrocarbonate,DEPC)(Code:R00-22)、蛋白裂解液RIPA(Code:P0013)、PMSF购自上海碧云天生物技术有限公司;SDS、PAGE、Blue PlusⅡ Protein Marker购自北京全式金生物技术有限公司;ECL发光液购自苏州新赛美生物科技有限公司;兔抗β-NGF(Code:BA10611)、羊抗兔IgG (Code:Bs-0295G-HRP)、DAB (3,3N-diaminobenzidine)显色试剂盒和免疫组化试剂盒(Code:SP-0022)购自北京博奥森生物技术有限公司。
1.3 引物设计根据GenBank数据库中双峰驼β-NGFCDS区,通过NCBI Primer-BLAST设计引物,引物由西安擎科生物公司进行合成。引物序列如下表1。

表1 目的基因及内参基因引物序列
1.4 总RNA的提取及cDNA的合成将双峰驼心脏、下丘脑、垂体、卵巢、子宫角和输卵管等组织置于预冷的研钵中,加入适量的液氮充分磨后,根据TransZol UP RNA试剂盒操作说明提取双峰驼各组织总RNA。每个样品取1 μL Total RNA,用超微量分光光度计(Pultton P200,美国)测定质量浓度。根据测定结果,统一将其质量浓度调至300~1 000 mg/L。按Revert Aid First Strand cDNA Synthesis Kit操作说明中的两步法进行第1链cDNA合成,产物于-20℃短期保存,于-80℃长期保存备用。
1.5 双峰驼β-NGF基因的测序与分子特征分析
1.5.1基因克隆 以双峰驼心脏cDNA 为模板,用引物β-NGF-2进行PCR扩增,将获得的产物按照Gel Extraction Kit试剂盒操作说明处理后,将回收后的产物送至西安擎科生物公司测序。
1.5.2分子特征分析 将扩增的PCR产物,经凝胶电泳及胶回收测序后,利用DNAMAN分析双峰驼β-NGF基因同源性;利用MEGA7.0软件绘制系统进化树;利用在线软件ExPASy Protparam (https://web.expasy.org/protparam)分析理化性质;利用PSIPRED在线软件(http:bioinf.cs.ucl.ac.uk/psipred)预测β-NGF蛋白的二级结构;利用软件 SWISS-MODEL (https://swissmodel.ex-pasy.org)预测β-NGF蛋白三级结构;利用在线软件Prots Cale (https://web.expasy.org/protscale)分析蛋白亲疏水性;利用在线软件TMHMMServer V2.0 (http:www.cbs.dtu.dk/services/TMHMM-2.0/)预测蛋白跨膜区域;利用在线软件Netphos预测磷酸化位点(http:www.cbs.dtu.dk/services/NetPhos)。
1.6 β-NGF蛋白在双峰驼精清和精浆的含量利用假阴道法,从成熟的雄性双峰驼(5~7岁)采精2~3次,采集的精液以1 500×g离心30 min,分别得到精清(无精子)和精浆(大量精子),将精清和精浆分别与上样缓冲液混匀,沸水浴10 min变性后,-20℃ 保存待用。分别取30~40 μg总蛋白,12% SDS-PAGE分离蛋白,电转移法将蛋白转移至聚偏氟乙烯膜(PVDF);5%脱脂奶粉室温封闭2 h,分别加兔抗一抗β-NGF(博士德,1∶1 000,中国)和兔抗GAPDH(武汉三鹰,1∶5 000,中国),4℃孵育过夜,洗膜3次,每次5 min,加羊抗兔二抗(博奥森,1∶5 000,中国),37℃孵育2 h,洗膜3次,每次5 min,化学发光法ECL显影。
1.7 免疫组织化学染色10%甲醛溶液中固定的组织经常规方法制作石蜡切片,37℃烤片2~4 h,二甲苯脱蜡,梯度酒精水化,柠檬酸盐缓冲液进行抗原修复;3%H2O2室温孵育以灭活内源性过氧化氢酶;PBS冲洗后,封闭液室温封闭30 min;去除封闭液,分别滴加兔源β-NGF一抗(博士德,1∶50,中国), 4℃孵育过夜;滴加二抗,37℃孵育30 min;滴加SABC,37℃孵育20 min;DAB显色后终止;苏木素复染后,1%盐酸乙醇分化,流水冲洗30 min蓝化,脱水,透明,封片。在显微镜下观察拍照,每个组织取3张切片,每张切片随机选取5个视野。
1.8 qRT-PCR检测双峰驼β-NGFmRNA的表达以反转录获得的cDNA为模板,通过实时荧光定量PCR对β-NGF和GAPDH基因mRNA表达水平检测。其反应体系为20 μL:2×TranStart Tip Green qPCR SuperMix 10 μL,上、下游引物各1 μL,cDNA 1 μL,Free water 7 μL。扩增程序采用三步法:94℃ 30 s,94℃ 5 s,56℃ 15 s,72℃ 10 s;共42个循环。每个样品重复3次,反应结束后观察扩增曲线和溶解曲线,采集Ct值。采用2-△△Ct方法计算出β-NGF基因相对表达量,并用SPASS 26.0软件分析表达差异性。
1.9 Western blot检测β-NGF蛋白的表达将保存于-80℃冰箱的下丘脑、垂体、卵巢、子宫角和输卵管等组织样品经液氮研磨成粉末,称取0.1 g并加入裂解液(1 mL RIPA+10 μL PMSF),用匀浆器低速匀浆30 s,冰上裂解3 h,15 000 r/min离心5 min后吸取上清,蛋白于-80℃冰箱保存。使用Branford蛋白定量试剂盒测定其总质量浓度。将待测蛋白与上样缓冲液混匀,沸水浴10 min 变性后,-20℃ 保存待用。每组取30~40 μg总蛋白,12% SDS-PAGE分离蛋白,电转移法将蛋白转移至聚偏氟乙烯膜(PVDF);5%脱脂奶粉室温封闭2 h,分别加兔抗β-NGF(博士德,1∶1 000,中国)和兔抗GAPDH(博士德,1∶5 000,中国)一抗,4℃孵育过夜,洗膜3次,每次5 min,加羊抗兔二抗(1∶5 000),37℃孵育2 h,洗膜3次,每次5 min,化学发光法ECL显影。利用Image-Pro Plus 6.0软件扫描测定条带的灰度值,并用SPASS 26.0软件分析表达差异性。
2 结果
2.1 双峰驼β-NGF基因的克隆用引物β-NGF-2进行CDS区的扩增,利用1%的凝胶电泳检测其产物,结果如图1所示,PCR产物大小与预期的双峰驼β-NGF基因的大小一致(783 bp)。

M.DL2000 DNA Marker;1.双峰驼β-NGF基因扩增产物
2.2 基因的分子特征分析
2.2.1理化性质分析 双峰驼β-NGF蛋白的氨基酸残基数为261个,其中脯氨酸(Pro)含量最高为12.3%,天冬酰胺(Asn)含量最低为0.4%。分子式为C1219H1914N402O365S11,原子总数为3 911,理论等电点(PI)为9.57,相对分子质量为28.393 74 kDa。Protscale软件预测显示,该蛋白为水溶性蛋白,但其在第 28~33、70~79、94~103、109~119、120~126、158~166、182~189、203~212、213~219和220~226处有较高的峰(图2A),说明其具有一定的疏水性。TMHMM Server V 2.0预测显示:该蛋白不存在跨膜区域(图2B),提示该蛋白在细胞内发挥作用。PSORT2 prediction预测结果显示,该蛋白主要分布于细胞核、线粒体和细胞质,含量分别为73.9%,13.0%和13.0%(图2C)。Net-Phos 3.1 Serve 预测结果显示,该蛋白有22个丝氨酸(Ser)磷酸化位点,11个苏氨酸(Thr)磷酸化位点;2个酪氨酸(Thr)磷酸化位点(图2D)。
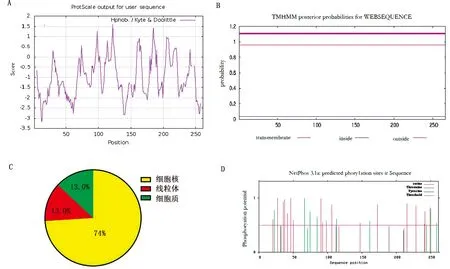
A.β-NGF蛋白的疏水性预测;B.β-NGF蛋白跨膜区域预测;C.β-NGF蛋白在细胞中的分布;D.β-NGF蛋白磷酸化位点预测
2.2.2蛋白质结构预测 ExPASy-Protparam 软件预测结果显示,不同类型的氨基酸含量如图3A所示,GOR Ⅳ软件预测显示,该蛋白由α-螺旋17个(6.51%);延伸链43个(16.48%);无规则卷曲201个(77.01%)构成。Phyre2 软件预测结果显示,该蛋白具有三级结构(图3C),且与二级结构的预测结果相符。

A.氨基酸数量;B.二级结构;C.三级结构(a.α-螺旋;b.延伸链;c.无规则卷曲)
2.3 同源性分析将双峰驼β-NGF核苷酸序列与单峰驼(Camelusdromedarius)、羊驼(Vicugnapacos)、野猪(Susscrofa)、山羊(Caprahircus)、马(Equuscaballus)、黄牛(Bostaurus)、人(Homosapiens)、犬(Canislupusfamiliaris)、家鼠(Musmusculus)及家兔(Oryctolaguscuniculus)的β-NGF核苷酸序列进行同源对比,同源性依次为99.6%,99.0%,92.8%,92.6%,91.7%,91.0%,89.5%,89.1%,84.4%和83.7%。利用MEGA7.0软件制作系统进化树,结果显示双峰驼β-NGF与单峰驼的进化水平较近,与家兔的进化水平较远(图4)。
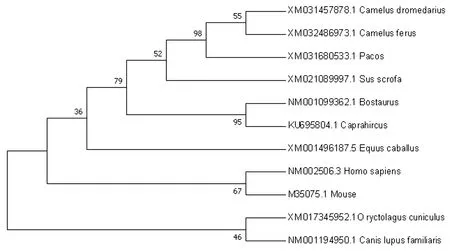
图4 β-NGF 基因系统进化树
2.4 β-NGF蛋白在双峰驼精清和精浆中的表达利用Western blot检测双峰驼精清和精浆中β-NGF蛋白的含量,结果显示:β-NGF蛋白在精清和精浆中均有表达(图5B),但精清中β-NGF的含量极显著高于精浆,含量约为精浆的5.5倍(图5A)。

A.Western blot检测蛋白水平(1~2.精清;3~4.精浆);B.积分光密度值分析
2.5 免疫组织化学检测β-NGF蛋白在双峰驼不同组织的分布免疫组化结果显示:在双峰驼下丘脑、垂体、卵巢、子宫角和输卵管中均有β-NGF蛋白的阳性表达。下丘脑中主要表达于下丘脑细胞,垂体中主要表达于嗜色细胞和嫌色细胞,卵巢中主要表达于颗粒细胞、膜细胞和间质细胞,子宫角中主要表达于子宫皱褶的肌细胞及子宫腺上皮细胞,在输卵管中主要表达于黏膜上皮细胞。
2.6β-NGF基因在双峰驼各组织中的表达分析通过qRT-PCR,以内参基因GAPDH对双峰驼不同组织β-NGF表达量进行校正,以下丘脑组织为对照组,以检测双峰驼下丘脑、垂体、卵巢、子宫角、输卵管中β-NGF的mRNA表达量。结果显示,β-NGF的mRNA在下丘脑、垂体、卵巢、子宫角和输卵管中均有表达,β-NGF在子宫角中表达量最高,且极显著高于其他组织(P<0.01),表达水平由高到低依次是子宫角、卵巢、垂体、下丘脑和输卵管(图6,7)。

图6 β-NGF蛋白在双峰驼下丘脑-垂体-生殖轴系中的分布
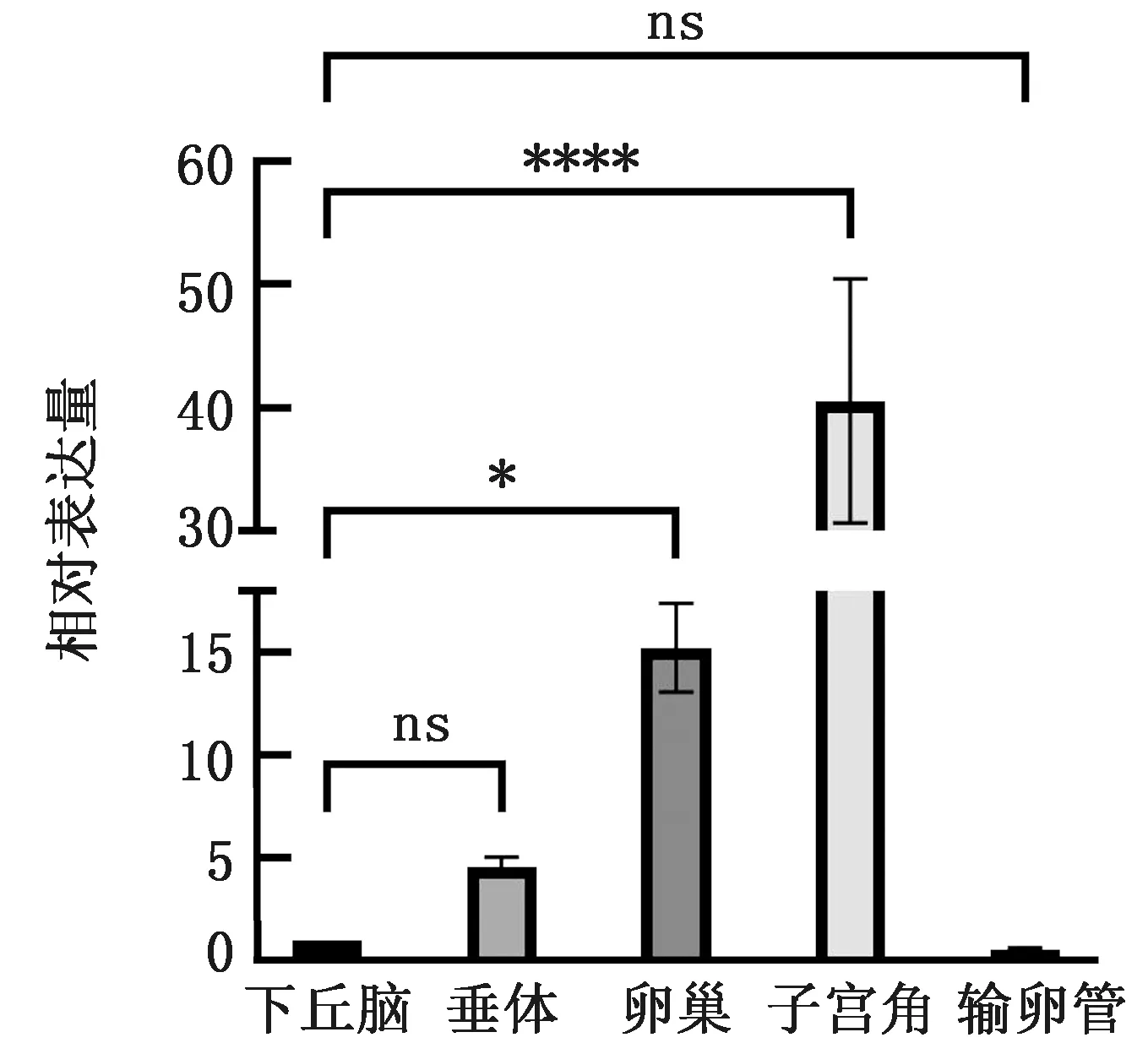
图7 qRT-PCR 检测双峰驼不同组织β-NGF mRNA 的相对表达
2.7 β-NGF蛋白在双峰驼各组织中的表达分析以GAPDH为内参,下丘脑组织为对照组,利用Western blot检测双峰驼下丘脑、垂体、卵巢、子宫角、输卵管中β-NGF蛋白的表达水平,结果显示:β-NGF 蛋白在被检测的所有组织中均有表达,且表达量存在差异(图8A),利用Image Pro Plus 6.0和SPASS 26.0软件对其结果进行统计分析发现,β-NGF蛋白在子宫角中表达量最高,且极显著高于下丘脑和输卵管(P<0.01),显著高于垂体(P<0.05)。表达顺序依次是子宫角、卵巢、垂体、下丘脑和输卵管(图8B)。
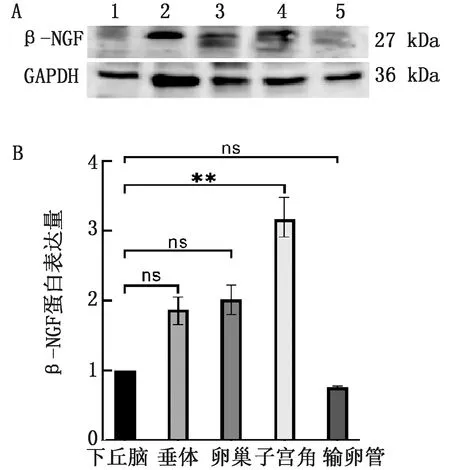
A.Western blot检测蛋白水平(1.下丘脑;2.垂体;3.卵巢;4.子宫角;5.输卵管);B.积分光密度值分析
3 讨论
最初的研究结果表明,NGF仅在神经系统中发挥生物学功能,但越来越多的研究表明,其也能够作用于其他系统的非神经细胞[12]。如,NGF在卵泡发育、诱导排卵、卵巢激素合成、子宫的周期性发育和输卵管运输、受精、精子获能、早期胚胎发育等方面均有重要调控作用[13-17]。早期研究表明:NGF生物活性部位为β亚基,是由2个各长118个氨基酸残基组成的二聚体[18]。本试验成功克隆了双峰驼β-NGF基因完整的CDS序列,通过生物信息学分析发现β-NGF编码的为非跨膜可溶性蛋白,且主要表达于细胞核(73.9%),提示其在细胞内发挥作用这与其在细胞内发挥信号传导作用的研究结果[19]相一致。系统进化树分析结果表明,双峰驼β-NGF核苷酸序列与单峰驼和羊驼高度保守,与其他物种存在进化差异。研究表明,NGF与其受体酪氨酸激酶(tyrosine kinase,TrkA)结合后,使TrkA磷酸化[20],磷酸化的TrkA经过一系列反应,形成复杂的化合物,最终激活苏氨酸-丝氨酸激酶(threonine serine kinase,Raf)将NGF的信号传至细胞核,从而影响基因的表达。本试验发现,双峰驼β-NGF蛋白有22个丝氨酸磷酸化位点,11个苏氨酸磷酸化位点和2个酪氨酸磷酸化位点,推测双峰驼β-NGF蛋白也能通过一系列反应激活Raf,从而影响基因的表达。
为探究β-NGF在双峰驼生殖轴系的表达规律,本试验通过qRT-PCR、Western blot和免疫组织化学染色的方法检测β-NGF在下丘脑-垂体-卵巢生殖轴系的表达规律。结果表明,β-NGF在各组织中均有表达,且在子宫角中表达最高。免疫组化结果表明,在子宫皱褶的肌细胞及子宫腺上皮细胞有微弱的免疫阳性,在卵巢的颗粒细胞、膜细胞和间质细胞以及输卵管的黏膜上皮细胞有中等强度的免疫阳性,在下丘脑细胞和垂体的嗜色细胞、嫌色细胞有很强的免疫阳性。研究表明,NGF在胎儿卵巢原始卵泡形成前就有表达,但缺乏NGF或阻断NGF生物活性可使原始卵泡的生成受阻,说明 NGF参与早期卵泡的发生[21]。DISSEN等[22]发现,NGF表达于牛卵巢的颗粒细胞和膜细胞。SHI等[23]研究表明,NGF在仓鼠的子宫内膜上皮细胞、腺细胞及基质细胞中均有表达。WENG等[24]研究发现,NGF在金仓鼠输卵管的上皮细胞和平滑肌细胞中有表达。垂体是体内复杂而重要的内分泌腺,对下丘脑中枢受到的内外刺激作出反应[25-26]。研究表明,β-NGF在诱导排卵的生殖轴的调节和激活中起着关键作用,其可以穿过血脑屏障,最终可能到达下丘脑细胞[27]。据此推测,β-NGF可以影响双峰驼下丘脑细胞的激活和调节,从而影响诱导排卵过程。卵巢不仅是卵泡发生和排卵的场所,更是雌性动物分泌雌激素和孕酮的器官[28]。输卵管和子宫是受精卵形成和着床的场所[29]。马永和[20]研究发现,在卵泡期,牛子宫中NGFmRNA表达量显著高于卵巢中的表达量。本次试验中,β-NGF主要分布在雌性双峰驼的子宫角中,提示β-NGF可能通过子宫内膜参与了双峰驼的诱导排卵过程,但具体的调控机制,还需进一步研究。
综上,β-NGF在双峰驼下丘脑-垂体-生殖轴系上发挥重要作用。本研究结果表明,β-NGF基因在子宫角中高表达,推测β-NGF可能通过子宫内膜参与了双峰驼的诱导排卵的某些生理学过程。

