猪圆环病毒3型PCR-ELISA检测方法的研究与应用
李 鹏,孙延举,雷梦瑶,孙国鹏,银 梅,苏为为,王选年,刘兴友,王利平*
(1.新乡学院 生命科学与基础医学学院,河南 新乡 453003;2.河南科技学院 动物科技学院,河南 新乡 453003)
猪圆环病毒(porcine circovirus,PCV)属于圆环病毒科(Circoviridae),是一种单链环状DNA病毒,基因组大小1.7~2.0 kb,无包膜,病毒粒子约为20 nm的二十面体[1]。已知有4种PCV(PCV1~4)可感染猪[2],其中PCV1为非致病性病毒,PCV2则可引起多种疾病发生,包括断奶仔猪多系统衰竭综合征、皮炎和肾病综合征、繁殖障碍等疾病[3-4]。2016年,美国首次报道检出PCV3,此后世界各地猪场分别检出PCV3病原,并发现其与猪的多种临床疾病有关,包括流产和产木乃伊胎、多系统炎症、皮炎和肾病综合征、腹泻和呼吸道疾病、先天性震颤等[5-6]。且通过对病变组织原位杂交(ISH)试验显示,PCV3与发病仔猪的心肌炎、血管炎和脑炎有关[7]。由于猪群在感染PCV3和PCV2后具有相似的临床体征,因此研发PCV3高敏感性和特异性检测方法具有重要的临床意义。
PCR-ELISA是一种包含基因扩增、核酸杂交和酶联免疫分析的检测方法[8]。与常规PCR相比,不仅大幅度提升了灵敏度,还可用于大规模样品的半定量分析[9]。本研究针对PCV3基因高度保守序列设计特异性引物,分别标记生物素和地高辛标,利用链霉亲和素与生物素之间特异性结合的原理,使PCR产物牢牢的结合在酶标板上,然后进行ELISA检测。PCR-ELISA将PCR与ELISA高灵敏性的特性有效的结合,消除了PCR凝胶电泳灵敏度低和ELISA样品制备复杂等过程,降低了试验难度,有效提高了检测的特异性和灵敏性,为PCV3的预防与控制提供了一定的技术支撑。
1 材料与方法
1.1 病毒株猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)、猪瘟病毒(classical swine fever virus,CSFV)、猪细小病毒(porcine parvovirus,PPV)、猪圆环病毒2型(porcine circovirus 2,PCV2)、猪圆环病毒3型(porcine circovirus 3,PCV3)阳性病料均由动物疫病分子诊断河南省工程实验室保存提供。
1.2 主要试剂病毒核酸提取试剂盒、DL2000 DNA Marker、pMD19-T载体、E.coliDH5α感受态细胞、QuickCutTMBamHⅠ、QuickCutTMHind Ⅲ和Premix Taq酶均购自TaKaRa公司;琼脂糖凝胶回收试剂盒和质粒提取试剂盒采购自OMEGA公司;链霉亲和素、羊抗DIG-HRP采购自Merck公司。
1.3 引物设计从GenBank数据库下载具有代表性的国内外PCV3全基因组序列,并使用DNAMAN软件进行比对,确定高度保守区域。用Primer 5.0软件设计特异引物,同时标记生物素与地高辛,上游引物PCV3-BIOF序列:5′-BIO-TGCTAC-GAGTGTCCTGAAGA-3′,下游引物PCV3-DIGR序列:5′-DIG-CTGCTGCTTGAAGATCCGAT-3′。引物由上海生工合成,同时合成1对未标记引物。
1.4 PCR退火温度筛选以提取的PCV3基因组DNA为模板,使用引物PCV3-BIOF和PCV3-DIGR进行扩增。反应体系:Premix Taq 25 μL,模板DNA 1 μL,上、下游引物各1 μL,ddH2O补齐至50 μL。反应程序:95℃ 4 min;95℃ 30 s,50~60℃ 30 s,72℃ 1 min,30个循环;72℃ 10 min。以条带最亮的温度作为最佳退火温度进行PCR反应。
1.5 标准质粒的制备使用未标记引物按照1.4进行PCR反应,目的基因片段回收纯化后连接至pMD19-T载体,再转化进DH5α感受态细胞,提取质粒,使用菌液PCR和双酶切(BamHⅠ和Hind Ⅲ)鉴定后测序分析,然后测定PCV3标准质粒的质量浓度并转换成相应拷贝数,以此作为PCR-ELSIA检测的标准品。
1.6 PCR-ELISA检测将链霉亲和素使用PBS缓冲液稀释后,50 μL/孔加入酶标板,于4℃包被过夜。弃去包被液后使用PBST 300 μL/孔重复洗板6次,拍干后每孔加入200 μL 5%脱脂奶于37℃封闭2 h。洗板6次拍干,加入带有标记物的PCR扩增产物,50 μL/孔37℃孵育1 h。洗板6次拍干,加入使用封闭液稀释的羊抗DIG-HRP,50 μL/孔,于37℃反应1 h。洗板6次拍干,每孔加入50 μL TMB单组份显色液,避光显色10 min,50 μL/孔加入H2SO4终止液,最后用酶标仪读取D450 nm值。
1.7 PCR-ELISA检测方法的优化对PCR-ELISA的各个主要反应条件进行优化。筛选链霉亲和素包被质量浓度(20.000 0,10.000 0,5.000 0,2.500 0,1.250 0,0.625 0,0.312 5 mg/L)和包被条件(4℃过夜,37℃ 2 h,37℃ 1 h,37℃ 30 min和37℃ 15 min),以5%脱脂奶作为封闭液筛选封闭条件(37℃ 2 h,37℃ 1 h,37℃ 45 min,37℃ 30 min和37℃ 15 min),加入PCR产物的反应时间(60,45,30,15,5 min)进行优化,再对羊抗DIG-HRP的稀释度(1∶500,1∶1 000,1∶2 000,1∶4 000,1∶8 000 和1∶16 000)及反应时间(60,45,30,15,5 min)进行筛选。根据以上筛选出的条件,优化PCR-ELISA的显色时间(15,10,7,5,3,1 min)及PCR反应时的循环次数(35,30,25,20,15,10次),确定PCR-ELISA的最佳反应条件。

1.9 特异性试验使用优化反应条件后的PCR-ELISA检测方法分别检测PRRSV、CSFV、PPV、PCV2和PCV3样品,确定PCR-ELISA方法的特异性。
1.10 敏感性试验将鉴定成功的PCV3标准质粒做10倍梯度稀释,以此为模板进行检测,每个梯度设置3个重复,以各梯度D450 nm均值确定PCR-ELISA检测方法的敏感性。
1.11 重复性试验选取4份不同质量浓度的PCV3标准质粒以及1份PCV3阴性样品,使用同批次的5块酶标板同时对其进行检测,再使用不同批次制备的酶标板检测该PCV3阳性和阴性样品,进行批内和批间重复性检测,每个样品设置3个重复。通过计算不同批次酶标板上各样品的D450 nm值的变异系数(CV),测定PCR-ELISA的稳定性。
1.12 临床样品的检测临床收集132份猪的组织和血清样品,使用建立的PCR-ELISA方法进行PCV3检测,同时使用常规PCR作对比,统计并分析临床样品的PCV3阳性率。
2 结果
2.1 目的基因PCR扩增及退火温度筛选结果以提取的PCV3全基因组DNA为模板进行PCR扩增,结果显示,出现392 bp左右的目的条带,同预期相符。退火温度筛选(50,51,53,55,57,60℃)结果见图1,当退火温度为55℃时,有较好的PCR扩增效果。
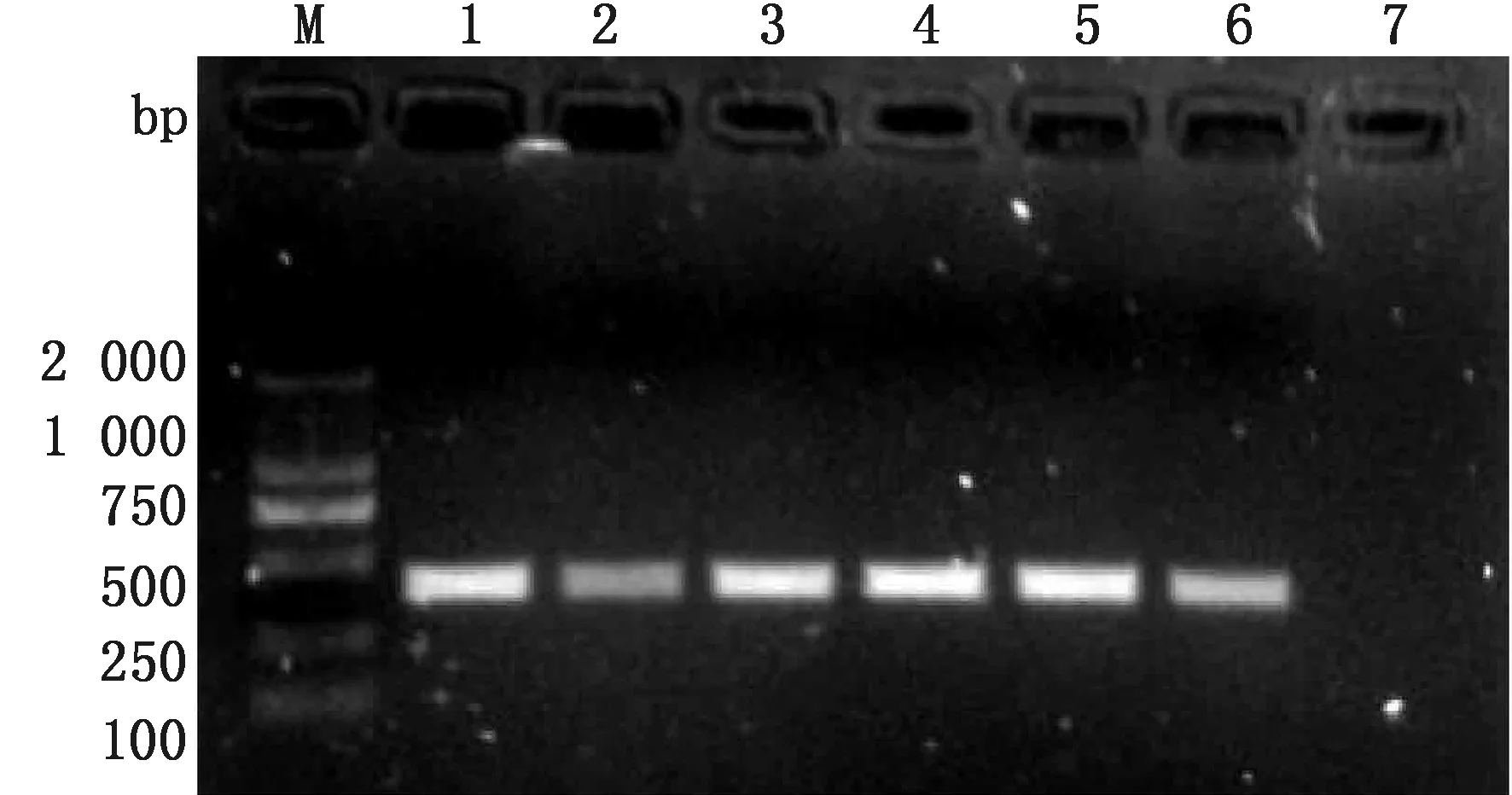
M.DL2000 DNA Marker;1.50℃;2.51℃;3.53℃;4.55℃;5.57℃;6.60℃;7.阴性对照
2.2 标准质粒的制备结果使用未标记引物按2.1确定的PCR反应条件,以PCV3 DNA为模板进行PCR反应,获得的目的产物经回收纯化、连接载体、转化、克隆后得到重组克隆质粒,经PCR和双酶切确定插入的片段大小在392 bp左右(图2)。测序结果显示同PCV3参考毒株的基因同源性为100%,表明成功构建PCV3目的基因克隆质粒。测得其质量浓度为188.7 mg/L,换算成拷贝数为5.58×1010copies/μL。

M.DL2000 DNA Marker;1.重组质粒PCR鉴定;2.阴性对照;3.重组质粒双酶切鉴定;4.阴性对照
2.3 PCR-ELISA检测方法优化结果对PCR-ELISA检测方法的反应条件优化结果显示,PCR循环次数为30次,链霉亲和素最佳包被质量浓度为2.5 mg/L,包被条件为37℃ 30 min,5%脱脂奶于37℃封闭60 min,目的基因的固定条件为37℃ 60 min,羊抗DIG-HRP按1∶2 000稀释后于37℃反应30 min,TMB显色10 min。


图3 30份阴性样品D450 nm的正态分布图
2.5 PCR-ELISA特异性试验结果利用建立的PCR-ELISA检测方法对PRRSV、CSFV、PPV、PCV2和PCV3样品进行检测,结果显示,仅PCV3样品为阳性(D450 nm=0.807),与其他病原体无交叉反应(图4);表明该方法具有良好的特异性。

图4 特异性试验结果
2.6 PCR-ELISA敏感性试验结果将构建的PCV3标准质粒做10倍梯度稀释,以得到的5.58×109~5.58×101copies/μL质粒为模板,使用建立的PCR-ELISA方法进行检测,同时以常规PCR做对比。结果显示,常规PCR可检测到5.58×104copies/μL的样品,PCR-ELISA可检测到5.58×102copies/μL(图5,6);表明该方法具有良好敏感性,其灵敏度是常规PCR的100倍。

M.DL2000 DNA Marker;1~9.分别是PCV3质粒稀释浓度5.58×109~5.58×101 copies/μL;10.阴性对照

图6 PCR-ELISA敏感性试验

2.8 临床样品检测应用建立的PCR-ELISA检测方法检测临床收集的132 份猪的病料组织和血清样品,同时使用常规PCR检测以做比对。结果显示,常规PCR测定临床样品中PCV3阳性率为4.55%(6/132),PCR-ELISA检测样品阳性率为9.10%(12/132),且常规PCR检测阳性样,在PCR-ELISA检测时均为阳性(表2);表明所建立的PCV3 PCR-ELISA方法可用于临床样品的检测。

表1 PCR-ELISA重复性试验结果

表2 临床样品PCR-ELISA方法和常规PCR方法检测结果 份
3 讨论
自2016 年美国首次报道PCV3后,至今仍无有效的疫苗和药物用于防控[10]。另外,PCV3宿主范围不断扩大,已从犬[11]和驴[12]样品中检测到PCV3。加之无症状感染和混合感染,使PCV3的临床诊断和预防控制难度增加,对各国养猪业造成严重不良影响[13]。建立一种灵敏、特异、高效的检测方法用于PCV3的早防早控,对减少经济损失意义重大。
PCR-ELISA技术通过结合固定化技术、引物标记、PCR扩增和酶联免疫吸附技术,极大增强了目的基因的信号强度,同时使用酶标仪读取和量化结果,做到对目的基因的半定量检测[14]。与常规PCR方法相比,PCR-ELISA在大幅度提升灵敏度基础上省去了凝胶电泳步骤,避免了EB等核酸染料的污染[15]。且该方法使用标准实验室仪器即可完成样品的批量检测,适合在养殖场推广使用。本研究分别在引物的5′端标记生物素和地高辛,PCR扩增后目的产物带有的标记物可直接与载体固定,省去了传统PCR-ELISA技术的探针设计和变性杂交步骤,缩短了检测时间,降低了检测成本。在此基础上,通过对链霉亲和素的包被条件、酶标板封闭条件、目的基因和载体的固定条件、酶标抗体反应条件、显色时间、PCR循环次数等操作步骤进行筛选优化,建立了检测PCV3的PCR-ELISA方法。
对所建立的PCR-ELISA方法进行敏感性评价,结果显示,检测限为5.58×102copies/μL,而常规PCR的检测限为5.58×104copies/μL,表明其具有良好的敏感性,是常规PCR的100倍,这与杨利峰等[16]和耿昕颖等[17]的研究结论一致。使用建立的PCR-ELISA方法,对132 份猪病料组织和血清样品进行PCV3 PCR-ELISA检测,结果显示,阳性率为9.10%,这同赵胜杰等[18]和JIA等[19]报道的PCV3在河南省的流行率5.17%~10.10%相近。在检出的12份PCV3阳性样品中,有7份样品同时为PCV2阳性,说明PCV3常和PCV2发生混合感染[20],但其感染机制仍有待研究。
综上所述,本研究建立并优化了一种用于PCV3的PCR-ELISA检测方法,该方法具有较高的灵敏性和重复性,适用于PCV3的早期诊断、日常监测和流行病学调查。

