利用单个B细胞制备人源SARS⁃CoV⁃2刺突蛋白单克隆抗体
冯泽众,路阳,李佳莹,马平,王英楠,朱瑾琪,孙金福
东北大学生命科学与健康学院,辽宁 沈阳 110169
严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,SARS⁃CoV⁃2)感染引起的新型冠状病毒肺炎(Coronavirus Disease 2019,COVID⁃19)严重威胁人类健康和生命安全,截至2022年 5月 25日,全球确诊病例累计超过 5.2 亿,死亡病例超过 630 万[1]。SARS⁃CoV⁃2 表面带有刺突蛋白(S蛋白),可与宿主细胞表面的人血管紧张素转换酶 2(human angiotensin⁃converting enzyme 2,hACE2)受体结合,介导病毒包膜与细胞膜融合,使病毒侵入细胞[2]。靶向S 蛋白的单克隆抗体可有效干扰S 蛋白与细胞受体结合,阻断病毒感染[3⁃4],因此,S 蛋白成为疫苗开发和抗体治疗的重要靶点[5⁃6]。本研究利用单个B 细胞通过RT⁃PCR 技术克隆S 蛋白单克隆抗体重链、轻链可变区基因,再经重叠PCR 法将可变区基因与CMV 启动子及IgG leader 序列DNA 片段、IgG 恒定区及PolyA 序列DNA 片段连接,构建抗体线性表达盒,转染HEK293T 细胞表达抗体,并检测抗体的中和活性,以期应用于治疗COVID⁃19新型药物和检测试剂的研发。
1 材料与方法
1.1 病毒、质粒及细胞 SARS⁃CoV⁃2 假病毒、SARS⁃CoV⁃2 S蛋白表达质粒PMD2.G⁃S 及过表达 ACE2 的A549细胞均由东北大学生命科学与健康学院费腾教授惠赠;质粒pCDNA3.1⁃myc⁃His 购自赛默飞世尔科技(中国)有限公司;HEK⁃293T 细胞购自北纳创联生物科技有限公司。
1.2 血液 人静脉血液样品采自经2 次SARS⁃CoV⁃2灭活疫苗(Vero 细胞)免疫,且SARS⁃CoV⁃2 抗体水平较高的志愿者。所有志愿者均知情同意,本研究获得东北大学生物与医学伦理委员会批准(文件批号:NEU⁃EC⁃2022A049S)。
1.3 主要试剂及仪器 偶联SARS⁃CoV⁃2 S1 蛋白的磁珠购自北京百普赛斯生物科技有限公司;TritonX⁃100 及 FITC 标记的山羊抗人 IgG 均自美国 Sigma 公司;HRP 标记的山羊抗人IgG 多克隆抗体购自武汉三鹰生物技术有限公司;First⁃Strand cDNA Synthesis SuperMix及2×TaqPlusMasterMix均购自美国APExBIO公司;萤火虫荧光素酶报告基因检测试剂盒购自上海碧云天生物技术有限公司;人外周血淋巴细胞分离液购自天津灏洋生物制品科技有限责任公司;Pro⁃tein A 亲和层析介质购自金斯瑞生物科技有限公司;天能全自动化学发光/荧光图像分析系统(Tanon⁃5500)购自上海天能生命科学有限公司;Eppendorf 显微操作系统购自德国Eppendorf公司。
1.4 B 细胞的分离及筛选 采用人外周血淋巴细胞分离液进行密度梯度离心,分离血液样品外周血单核细胞(peripheral blood mononuclear cell,PBMC),于液氮中冻存;将偶联SARS⁃CoV⁃2 S1蛋白的磁珠100 μg与1 mL PBMC(6.5× 106个细胞)室温孵育60 min,用Eppendorf显微操作系统吸取与磁珠结合的单个B细胞,加至含有裂解液(0.5 μL RNase Inhibitor,1 μL dNTP,1.5 μL RT引物,0.1 μLTritonX⁃100,6.9 μL RNase Free H2O)的PCR管中,立即置冰上速冻,于-80 ℃保存。
1.5 抗体可变区(V片段)基因的扩增 根据文献[7]设计反转录引物,并将单个B 细胞进行反转录。取上述冻存的含有裂解液和B 细胞的PCR 管,72 ℃水浴3 min,再经65 ℃水浴5 min;置冰上,加入4 μL 5 × First⁃Strand Buffer,1 μL Reverse Transcriptase,0. 5 μL RNase Inhibitor,4. 5 μL RNase Free H2O,总体积为20 μL。反转录条件为:42 ℃ 90 min;50 ℃ 2 min,42 ℃ 2 min,共 10 个循环;75 ℃ 15 min。以获得的cDNA 为模板,利用IgG H 链、κ链和λ链(VH、Vκ和Vλ)外套引物进行第1 轮PCR 扩增,PCR 反应体系为:cDNA 5 μL,上下游引物各 1 μL,2 × Taq Plus Mas⁃ter Mix 25 μL,去离子水定容至 50 μL。第2 轮 PCR以第1 轮PCR 产物为模板,参考文献[7]设计内套引物进行第2 轮PCR 扩增,PCR 反应体系为:第1轮PCR产物5 μL,上下游引物各1 μL,2 × Taq Plus Master Mix 25 μL,去离子水定容至50 μL。两轮 PCR 扩增条件均为:94 ℃ 3 min;94 ℃ 30 s,55 ℃ 25 s,72 ℃ 30 s,共30 个循环;72 ℃ 7 min。PCR 产物经 1% 琼脂糖凝胶电泳分析。
1.6 线性表达盒C、H、K和L片段的构建 抗体线性表达盒由包含CMV 启动子和IgG leader 序列的C片段、抗体可变区(VH、Vκ或Vλ)片段及包含抗体恒定区基因和牛生长激素(bovine growth hormone,BGH)polyA信号序列的H、K或L片段 3 部分构成[7]。将 Gen⁃Bank 中登录的IgG leader 序列(E10790.1)经HindⅢ和EcoRⅠ酶切位点插入载体pCDNA3.1⁃myc⁃His,与CMV 启动子构成线性表达盒的C 片段;将抗体重链H 链(BC041037)、轻 链 κ 链(BC073791)和 λ 链(BC073769)的恒定区序列经XhoⅠ和AgeⅠ酶切位点分别插入载体pCDNA3.1⁃myc⁃His,分别与载体的BGH polyA信号序列构成H、K和L片段。
1.7 抗体全长线性表达盒的构建 以1.6 项构建的重组质粒为模板,PCR 分别扩增C、H、K和L片段,引物和方法均参照文献[7],用于重叠PCR 法分别构建抗体H 链、κ链和λ链全长线性表达盒。重叠PCR 体系为:可变区基因VH与C片段和H 片段各50 ng(H链)/Vκ与C片段和K 片段各50 ng(κ 链)/Vλ与C片段和L片段各50 ng(λ链),上下游引物(参考文献[7]设计)各 1 μL,2 × Taq Plus Master Mix 25 μL,去离子水定容至50 μL。PCR扩增条件为:94 ℃3 min;94 ℃ 30 s,55 ℃ 25 s,72 ℃ 2 min,共30个循环;72 ℃7 min。PCR产物进行1%琼脂糖凝胶电泳检测。
1.8 抗体表达 将来源于同一B 细胞的抗体重链和轻链线性表达盒共转染HEK⁃293T 细胞,37 ℃培养48 h,收集上清,经12%SDS⁃PAGE 分离蛋白后,转移至NC 膜,用含1%牛血清白蛋白的PBS 于室温封闭1 h;加入HRP 标记的山羊抗人IgG 多克隆抗体(1∶5 000 稀释),于室温孵育 1 h;PBST 洗涤 3 次,加入ECL 发光液,室温放置1 min,采用天能全自动化学发光/荧光图像分析系统(Tanon⁃5500)生成图像。
1.9 抗体免疫反应活性的检测 采用免疫荧光染色法。将 SARS⁃CoV⁃2 S 蛋白表达质粒 PMD2.G⁃S 转染HEK⁃293T 细胞,同时设对照组(未转染),于37 ℃孵育48 h;用80%冷丙酮固定细胞,PBST 洗涤3 次,加入100 μL表达的抗体上清溶液,室温孵育1 h;PBST洗涤3次,加入FITC标记的山羊抗人IgG(1∶200稀释),室温孵育1 h,PBST洗涤3次,用荧光显微镜观察。
1.10 抗体的纯化 用5 mL平衡缓冲液平衡(20 mmol/L Na2HPO4,0.15 mol/L NaCl,pH 7.0)ProteinA 树脂,将30 mL 抗体表达上清液按约1 mL/min 的流速上样,用30 mL 平衡缓冲液洗涤,流速约2 mL/min;10 ~15 mL 洗脱缓冲液(0.1 mol/L glycine,pH 3.0)洗脱抗体,流速维持约1 mL/min,收集含有目的抗体的洗脱液后,立刻加入1/10 洗脱液体积的中和缓冲液(1 mol/L Tris,pH 8.5),调节 pH 至 7.4。纯化抗体进行12%SDS⁃PAGE分析。
1.11 抗体中和活性的检测 将SARS⁃CoV⁃2 假病毒稀释至4 × 103TCID50/mL,加至96孔板,50 μL/孔;加入纯化抗体(0~4 000 ng/μL),50 μL/孔,每个稀释度设3个复孔,于37 ℃孵育1 h;加入过表达ACE2的A549 细胞(2 × 105个/mL),100 μL/孔,37 ℃培养48 h;加入萤火虫荧光素酶检测试剂,100 μL/孔,室温孵育10 min;用酶标仪检测荧光强度,并计算抗体半数抑制浓度(half⁃maximal inhibitory con⁃centrations,IC50)。
2 结 果
2.1 抗体可变区基因扩增产物的鉴定 PCR产物经1%琼脂糖凝胶电泳分析,可见498 bp 的VH片段、403 bp的Vκ片段和422 bp 的Vλ片段基因条带,大小与预期一致,见图1。表明获得抗体可变区VH、Vκ和Vλ基因正确。
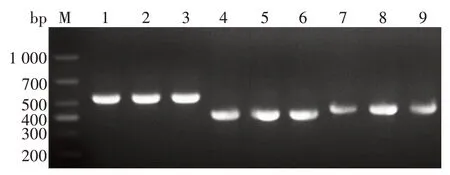
图1 抗体可变区VH、Vκ和Vλ基因片段电泳图Fig.1 Electrophoretic profile of variable region genes VH,Vκ and Vλ fragments of antibody
2.2 抗体全长线性表达盒的的鉴定 重叠PCR 产物经1%琼脂糖凝胶电泳检测,可见约2 631 bp 的H链、1 911 bp的κ 链和1 918 bp的λ链,大小与预期一致,见图2。表明抗体全长线性表达盒构建正确。

图2 抗体全长线性表达盒的电泳图Fig.2 Electrophoretic profile of full⁃length linear expres⁃sion cassettes of antibody
2.3 抗体表达产物的鉴定 共表达了26株单克隆抗体,抗体的表达产物经Western blot 检测,于相对分子质量约55 000 和25 000 处可见目的蛋白条带,与IgG 抗体重链、轻链相对分子质量大小一致,见图3(以3株为例)。表明成功表达了IgG抗体。

图3 Western blot法检测IgG抗体的表达Fig.3 Western blotting of expression of IgG antibodies
2.4 抗体的免疫反应活性 荧光显微镜下观察可见,表达S 蛋白的转染组细胞呈绿色荧光,未表达S蛋白的对照组细胞未见绿色荧光,见图4。表明表达抗体具有S蛋白特异性抗体免疫反应活性。
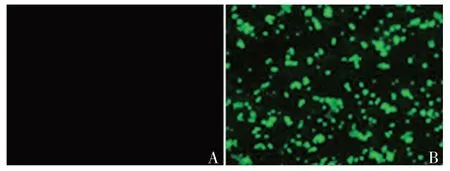
图4 免疫荧光法检测单克隆抗体的免疫反应活性(×200)Fig.4 Detection of monoclonal antibody immunoreactivity by immunofluorescence( × 200)
2.5 纯化抗体的鉴定 纯化抗体经12% SDS⁃PAGE分析,可见相对分子质量约55 000 和25 000 的重链和轻链蛋白条带,且均为单一条带,未纯化抗体未见这两条蛋白条带,见图5。表明纯化效果较好。
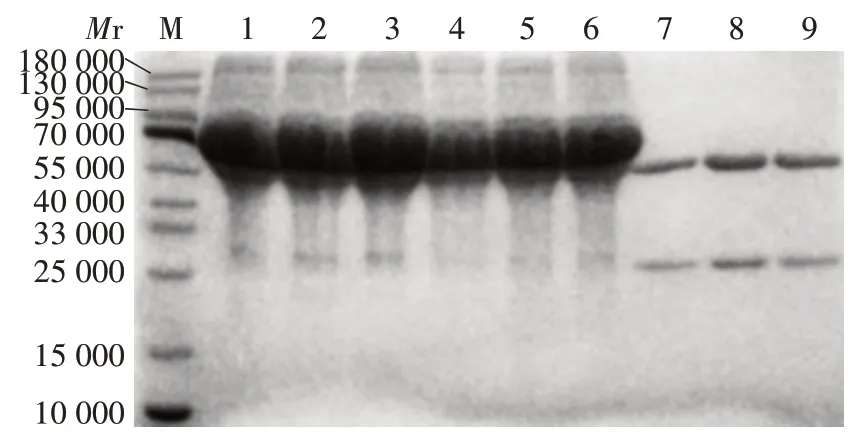
图5 纯化抗体的SDS⁃PAGE分析Fig.5 SDS⁃PAGE analysis of purified antibodies
2.6 抗体的中和活性 26 株单克隆抗体中,有20株具有中和活性,IC50在0.040 ~0.545 μg/mL 之间,见表1。
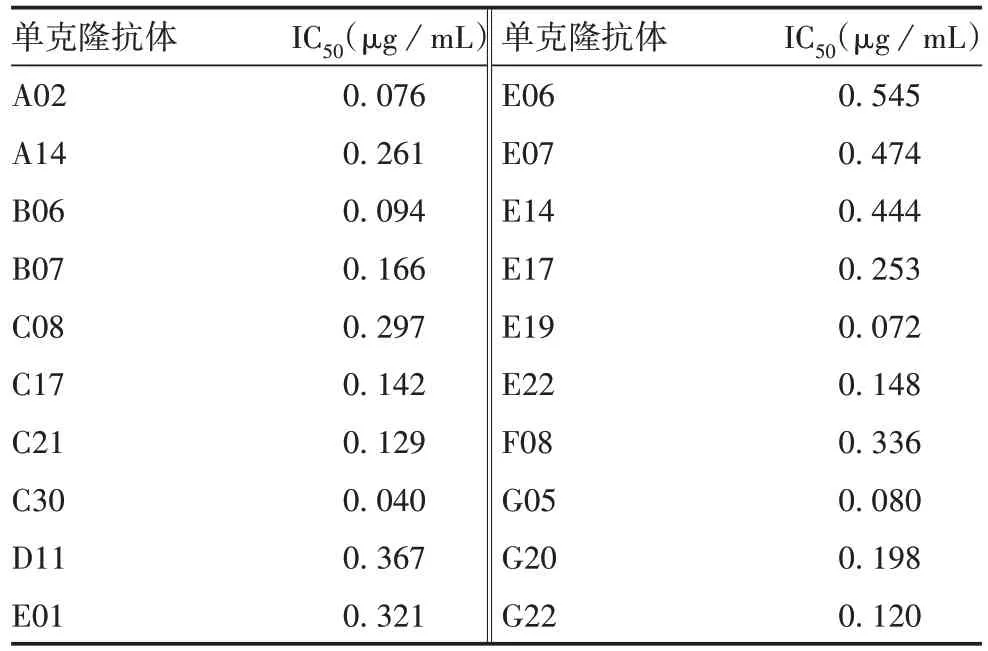
表1 单克隆抗体的中和活性Tab.1 Neutralizing activity of monoclonal antibodies
3 讨 论
制备单克隆抗体的常用方法包括鼠杂交瘤单克隆技术、噬菌体展示库技术和单个B 细胞抗体技术等[8⁃10]。源于杂交瘤技术制备的单克隆抗体用于人或异种动物时存在鼠源单克隆抗体的免疫原性问题。另外,随着时间的延长,杂交瘤细胞系会出现基因丢失、突变、遗传漂移,导致抗体产生微小变化。为了克服免疫原性问题,可将鼠单克隆抗体的可变区与人抗体的恒定区进行重组,构建人鼠嵌合抗体[11]。噬菌体展示库技术在建立抗体重链和轻链可变区随机文库的基础上,通过特定抗原筛选获得单克隆抗体。这种单克隆抗体的轻链和重链可变区随机组合,不是来源于同一B 细胞的天然配对。利用单个B 细胞RT⁃PCR 技术扩增抗体基因,再克隆至表达载体,表达重组抗体,重链和轻链是天然配对,具有良好的稳定性及批间质量均一的优点。
本研究采用偶联 SARS⁃CoV⁃2 S 蛋白 S1 区域的磁珠分选S蛋白特异性的抗体阳性B细胞,与流式细胞分选比较,这种方法的成本及对设备、环境要求均较低,且方便观察B 细胞完整性,但分选效率及分选准确率较低。LIAO 等[7]将 CMV 启动子和 IgG leader序列、抗体重链、轻链恒定区分别与T 载体连接,构建C、H、K和L片段。本研究将IgG leader序列和抗体重链、轻链恒定区分别插入载体pCDNA3.1⁃myc⁃His,与CMV 启动子、BGH polyA序列构成C、H、K和L片段,无需合成CMV启动子和BGH polyA信号序列。本研究利用重叠PCR将扩增的抗体可变区基因与C及H、K或L片段连接,构建抗体的线性表达盒,转染细胞表达抗体,该方法无需构建表达质粒,提高了克隆与筛选的效率。
抗体是治疗和预防新出现或已知病毒感染的有效方法[12]。有研究利用 COVID⁃19 康复患者血浆进行治疗,可显著减少患者住院时间和病情恶化,临床效果较好[13]。有报道表明,获美国食品药品监督管理局(Food and Drug Administration,FDA)批准用于临床的SARS⁃CoV⁃2中和单抗Casirivimab/imdevimab治疗非住院患者,可减少住院或死亡风险70%,治疗严重住院病例可减少20%的死亡率[14],另一获FDA批准的中和单抗Bamlanivimab 具有类似的临床效果[15]。2021年12月8日,SARS⁃CoV⁃2中和抗体联合治疗药物安巴韦/罗米司韦(BRII⁃196/BRII⁃198)获国家药品监督管理局应急批准使用,该药物可降低住院及死亡风险78%[16]。本研究获得的26株SARS⁃CoV⁃2 S 蛋白单克隆抗体中,有20 株具有良好的假病毒中和活性,IC50最小为0.040 μg/mL,具有用于临床诊断和临床治疗的潜力。单克隆抗体作用机理包括病毒中和作用和诱导细胞免疫。抗体的中和活性可阻断病毒的感染,抗体与病毒表面蛋白结合后,抗体Fab片段阻断病毒蛋白与细胞受体结合,阻碍病毒与宿主细胞膜融合所必需的蛋白裂解或构象改变,从而阻止病毒进入细胞[17]。另外,抗体Fc 片段与免疫细胞的Fc 受体结合,激活细胞免疫功能,包括单核细胞、巨噬细胞、中性粒细胞对病毒粒子和感染细胞的吞噬作用及NK细胞对感染细胞的直接杀伤作用[18]。
本研究采用磁珠法筛选特异B 细胞,经单细胞RT⁃PCR 法制备了 SARS⁃CoV S 蛋白单克隆抗体,其对假病毒IC50为0.040~0.545 μg/mL,可用于临床治疗药物及抗原检测试剂的研发。单克隆抗体具有特异性、高效力和代谢稳定性等天然优势,因此抗体类药物是目前医药市场增长最快的药物类别[19],在感染性疾病、肿瘤治疗、免疫性疾病等领域具有广阔的应用前景。另外,病毒的快速变异也对单克隆抗体的临床治疗效果提出了严峻挑战[20⁃21]。

