结核分枝杆菌H37Rv 株PE_PGRS35蛋白的表达、纯化及其生物信息学分析
袁美丽 ,王楚彤 ,李敏英 ,李柏青 ,3,许涛 ,4,汪洪涛 ,3
1.蚌埠医学院检验医学院检验医学实验中心,安徽 蚌埠 233000;2.蚌埠医学院慢性疾病免疫学基础与临床安徽省重点实验室,安徽 蚌埠 233000;3.蚌埠医学院检验医学院免疫学教研室,安徽 蚌埠 233000;4.蚌埠医学院检验医学院临床检验诊断学教研室,安徽 蚌埠 233000
结核病是全球传染病致死的主要疾病之一,每年约有1 000 万人患结核病,约300 万人死于肺结核,结核病的传播严重危害人们的生命健康[1]。结核分枝杆菌(Mycobacterium tuberculosis,MTB)是结核病的主要病原体,其与人类免疫缺陷病毒(human immunodeficiency virus,HIV)共同感染的威胁越来越大[2]。近年来,耐药结核病尤其是耐多药结核病的出现严重影响了结核病的防控,给世界带来巨大挑战。目前,唯一可用于结核病治疗的疫苗为牛分枝杆菌减毒疫苗,即卡介苗(bacille de calmette guérin,BCG),但该疫苗在成人中的效力有限,且用于MTB的实验室诊断方法不敏感,耗时且费力[3]。因此,探索新的MTB 毒力决定因素及其新型药物靶点,对结核病的诊断以及疫苗研发具有积极作用。
PE_PGRS 家族蛋白主要包括 PE 和 PGRS 结构域,PE 结构域位于N⁃末端且高度保守,PE_PGRS 家族所有成员在PE结构域均含有1个保守的四肽基序DEVS 或 DXXS(X 为任意氨基酸)。PGRS 结构域富含GC 序列,位于PE 结构域之后,极富多态性且免疫原性较强,GC 序列是一个不完整的短的重复序列,可用于MTB菌株分型;PGRS结构域具有Gly⁃Gly⁃Ala和Gly⁃Gly⁃X 重复基序(X 为任意氨基酸),是分枝杆菌致病的重要因素[4]。PE_PGRS 蛋白家族主要位于分枝杆菌的细胞壁和细胞膜上,是依赖于ESX⁃5机制的分泌性蛋白,可被ESX⁃5 分泌系统运输和分泌[5]。PE_PGRS35 蛋白(Rv1983)是含558 个氨基酸的蛋白质,具有一个独特的C⁃末端结构域,与PE_PGRS16的C⁃末端结构域具有一定同一性,其在海洋分枝杆菌中的同系物可加工 MTB LipY 蛋白[6]。PE_PGRS35蛋白是一种毒力相关蛋白,其蛋白质结构、相互作用蛋白以及相关的生物学功能,及其在MTB 中的作用和致病机制均尚不明确。因此,深入探讨PE_PGRS35蛋白有助于了解该蛋白在MTB的生长和感染中发挥的重要作用,这为结核病疫苗的开发提供了有效的靶向指标。
本研究利用同源重组克隆技术构建原核表达载体pET28a⁃PE_PGRS35,经异丙基⁃β⁃D半乳糖苷(IPTG)诱导,在大肠埃希菌(E.coli)中表达带His标签的MTB H37Rv 菌株PE_PGRS35 蛋白,经亲和层析纯化后进行生物信息学分析,为进一步鉴定蛋白功能和新型抗结核药物疫苗的研发提供依据。
1 材料与方法
1.1 菌株、载体及DNA 克隆菌株E.coliDH5α,表达菌株E.coliBL21(DE3)和原核表达载体pET28a由蚌埠医学院慢性疾病免疫学基础与临床安徽省重点实验室保存;MTB 标准菌株H37Rv 基因组DNA 购自上海晶诺生物科技有限公司。
1.2 主要试剂及仪器 Phanta Max Super⁃Fidelity DNA Polymerase、同源重组试剂盒购自南京诺唯赞生物科技股份有限公司;质粒小提试剂盒和琼脂糖凝胶DNA 试剂盒均购自天根生化科技(北京)有限公司;组氨酸(His)标签小鼠单克隆抗体、HRP 标记的山羊抗小鼠IgG 和ECL 底物化学发光显色试剂盒、5'⁃四甲基联苯胺(TMB)显色液均购自碧云天生物科技有限公司;IPTG、苯甲基磺酰氟(PMSF)均购自美国Sigma 公司;Ni⁃IDA SepharoseCl⁃6B 亲和层析柱购自德国Novagen 公司;其他常规试剂均为国产分析纯试剂。
1.3 引物设计及合成 根据NCBI GenBank数据库中H37RvPE_PGRS35基因序列(885921)设计引物。pET28a⁃PE_PGRS35正向引物:5'⁃AAGAAGGAGAT⁃ATACCATGGGCATGGTGTCATTTCTGGTCGTGGT⁃3,'pET28a⁃PE_PGRS35反向引物:5'⁃TGGTGGTGGTG⁃GTGCTVGAGCGCCGGATGATCAAAGACTG⁃3',扩增片段大小为1 677 bp(全长PCR产物大小为1 719 bp)。引物由上海派森诺生物科技有限公司合成。
1.4 原核表达载体的构建及鉴定 以MTB H37Rv 标准菌株基因组DNA为模板,利用pET28a⁃PE_PGRS35正反向引物进行 PCR 扩增。50 μL 反应体系:2 ×Max Buffer 25 μL,dNTP Mix 1 μL,正、反向引物各1 μL,DNA Max Polymerase 1 μL,基因组DNA 2 μL,ddH2O 19 μL。反应条件:95 ℃预变性3 min;95 ℃变性15 s,60 ℃退火 15 s,72 ℃延伸 2 min,共 40 个循环;72 ℃继续延伸7 min。1.2%琼脂糖凝胶电泳分离PCR 产物,琼脂糖凝胶DNA 回收试剂盒回收目的基因片段。将表达载体pET28a 经NcoⅠ和XhoⅠ双酶切,30 ℃酶切过夜;胶回收载体片段,按以下反应体系进行同源重组反应:酶切pET28a 1 μL,胶回收目的基因PE_PGRS351 μL,5 × CEBuffer 5 μL,ExnasoMultis 2 μL,ddH2O 12 μL。将10 μL重组产物转化至100 μLE.coliDH5α 感受态细胞中,混匀,冰上静置30 min;42 ℃热激90 s,迅速至冰上冷却2 min;加至900 μL LB液体培养基,37 ℃振摇1 h;离心后涂布LB固体培养板(含50 μg/mL 卡那霉素),37 ℃摇床培养过夜;随机挑取单个阳性菌落进行菌落PCR 鉴定,并送上海派森诺生物科技有限公司测序。选择测序正确的阳性菌株提取质粒,用于后续试验。
1.5 重组PE_PGRS35 蛋白的表达 将原核表达载体 pET28a⁃PE_PGRS35转化至E.coliBL21(DE3)中,挑取单克隆菌落接种至含50 μg/mL 卡那霉素的3 mL LB 液体培养基中,37 ℃,220 r/min 摇床振摇培养过夜;进一步扩大培养,按1∶100 比例接种至含50 μg/mL 卡那霉素的30 mL LB 液体培养基中,37 ℃,220 r/min 摇床振摇培养;至A600值达 0.6 ~0.8 时,加入IPTG 至终浓度为0.5 mmol/L,37 ℃诱导过夜;室温,8 910 ×g离心,弃上清,PBS 重悬菌体沉淀,重悬液经超声破碎后,分别取超声破碎后上清和沉淀液进行12% SDS⁃PAGE 分析,考马斯亮蓝染色显示条带。
1.6 包涵体溶解及蛋白纯化 将菌体沉淀重悬于20 mL裂解缓冲液中(20 mmol/L Tris⁃HCl,含 1 mmol/L PMSF 和细菌蛋白酶抑制物混合液,pH 8.0),进行超声破碎(功率400 W,工作4 s,间歇8 s,共20 min);4 ℃,8 910 ×g离心20 min;收集沉淀,包涵体洗涤液(20 mmol/L Tris,1 mmol/L EDTA,2 mol/L 尿素,1 mol/L NaCl,1%TritonX⁃100,pH 8.0)洗涤3次,溶解缓冲液(20 mmol/L Tris,5 mmol/L DTT,8 mol/L尿素,pH 8.0)溶解包涵体,4 ℃过夜;室温,8 910 ×g离心15 min。将PE_PGRS35蛋白滴加至20 mmol/L Tris⁃HCl,0.15 mol/L NaCl,pH 8.0缓冲液中,倍比稀释后装入透析袋,于20 mmol/L Tris⁃HCl,0.15 mol/L NaCl,pH 8.0缓冲液中透析过夜;将透析后的蛋白上清溶液转移至 Ni⁃IDA SepharoseCl⁃6B 亲和层析柱中,用 Ni⁃IDABinding⁃buffer 冲洗,直至流出液A280值达到基线,用Ni⁃IDAWashing⁃buffe(r20 mmol/L Tris⁃HCl,20 mmol/L 咪唑,0.15 mol/L NaCl,pH 8.0)冲洗,直至流出液A280值达到基线,用Ni⁃IDAElution⁃Buffer(20 mmol/L Tris⁃HCl,20 mmol/L 咪 唑 ,0.15 mol/L NaCl,pH 8.0)洗脱目的蛋白,收集流出液,置含PBS的透析袋中透析过夜后,进行12%SDS⁃PAGE分析。
1.7 纯化的PE_PGRS35 蛋白的鉴定 采用Western blot 法。将纯化的变性蛋白经12%SDS⁃PAGE 分离,电转至PVDF 膜上(恒流280 mA,2 h),PBST 洗膜3次,用含5%脱脂奶粉的PBST 摇床封闭5 h;加入His标签的小鼠单克隆抗体(1∶1 000稀释),4 ℃孵育过夜;PBST 洗膜3 次,加入HRP 标记的山羊抗小鼠IgG(1∶1 500 稀释),室温孵育2 h;PBST 洗膜3 次,ECL显影,曝光。
1.8 生物信息学分析 用ExPasy 网站ProParam 工具进行PE_PGRS35 氨基酸理化参数解析,ExPasy 网站Proscale工具进行亲疏水性特征分析,TMHMM2.0工具进行PE_PGRS35 跨膜区预测,NetPhos3.1 软件进行磷酸化位点预测,NCBI 数据库中CD⁃Search 工具进行保守域分析。用SOPMA 软件进行PE_PGRS35二级结构预测,SWISSMODEL 工具进行三级空间结构分析和模型构建。用STRING软件进行PE_PGRS35相互作用蛋白分析。
2 结果
2.1 重组表达载体pET28a⁃PE_PGRS35的鉴定PE_PGRS35基因扩增产物经1.2%琼脂糖凝胶电泳分析,可见1 677 bp 的特异性片段,大小与理论预测值相符,见图1。转化后阳性菌落经PCR 鉴定,可见1 700 bp(含载体片段170 bp)的特异性条带,见图2,表明PE_PGRS35基因已成功转化至E.coli感受态DH5α 细胞中。转化后阳性菌落测序结果与目的基因模板序列一致,表明质粒pET28a⁃PE_PGRS35构建正确。

图1 PE_PGRS35基因扩增产物电泳图Fig.1 Electrophoretic profile of amplification product of PE_PGRS35 gene
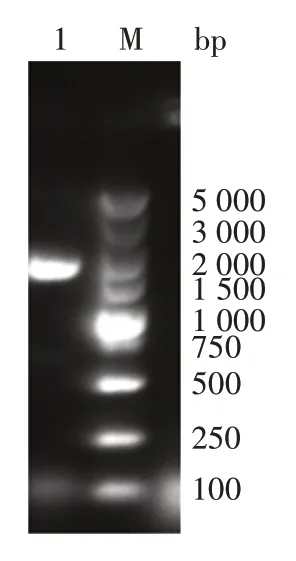
图2 PE_PGRS35基因菌落PCR产物电泳图Fig.2 Electrophoretic profile of colony PCR product of PE_PGRS35 gene
2.2 重组 PE_PGRS35 蛋白的鉴定 12%SDS⁃PAGE分析显示,在相对分子质量约53 000 处可见外源性蛋白表达条带,与预测的PE_PGRS35 蛋白理论相对分子质量(53 730)一致,主要存在于破碎后沉淀中,上清中未见PE_PGRS35蛋白,见图3。
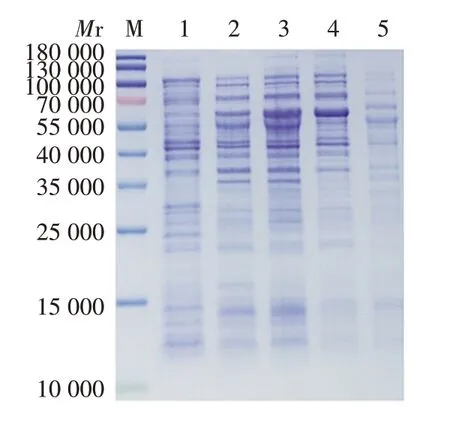
图3 表达的PE_PGRS35蛋白的SDS⁃PAGE分析Fig.3 SDS⁃PAGE analysis of expressed PE_PGRS35 protein
2.3 纯化的PE_PGRS35蛋白的鉴定 12%SDS⁃PAGE分析显示,纯化的蛋白条带单一,纯度可达90%,未见明显杂带,见图4。Western blot 分析显示,在相对分子量约53 000 处,诱导后以及诱导破碎后沉淀中可见特异性反应条带,而pET28a 空载体、诱导前以及诱导破碎后上清中未见明显条带,表明PE_PGRS35蛋白在大肠埃希菌中主要以包涵体形式存在,见图5。
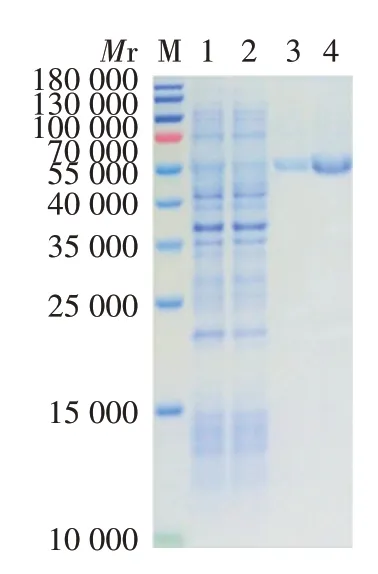
图4 纯化的PE_PGRS35蛋白的SDS⁃PAGE分析Fig.4 SDS⁃PAGE analysis of purified PE_PGRS35 protein
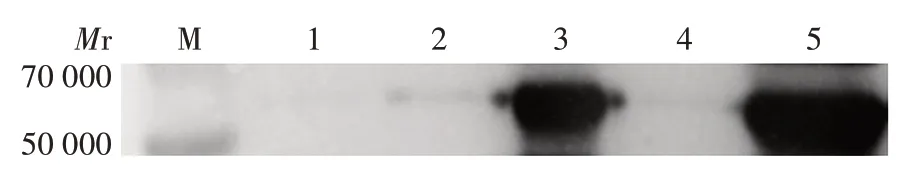
图5 纯化的PE_PGRS35蛋白的Western blot分析Fig.5 Western blotting of purified PE_PGRS35 protein
2.4 生物信息学分析
2.4.1 亲疏水性特征分析 ProParam 软件分析结果显示,PE_PGRS35 的分子式为 C4765H7855N1677O1980S520,相对分子质量约为136 989.03,理论等电点为4.89(属于酸性蛋白),不稳定性指数为48.30(属于不稳定性蛋白),脂肪系数为17.11,总平均亲水性为0.822,见图6。
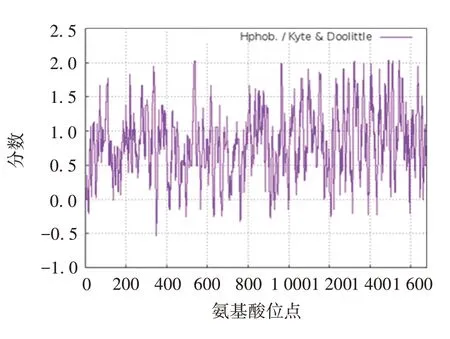
图6 PE_PGRS35蛋白亲水性分析Fig.6 Hydrophilicity analysis of PE_PGRS35 protein
2.4.2 磷酸化位点和保守域分析 NetPhos3.1 软件预测PE_PGRS35蛋白有39个磷酸化位点,其中丝氨酸位点17 个,苏氨酸位点15 个,酪氨酸位点7 个,见图7。CD⁃Search 工具分析PE_PGRS35蛋白有2个保守结构域,分别为PE 超家族结构域和PE_process_PecA超家族结构域,见图8。
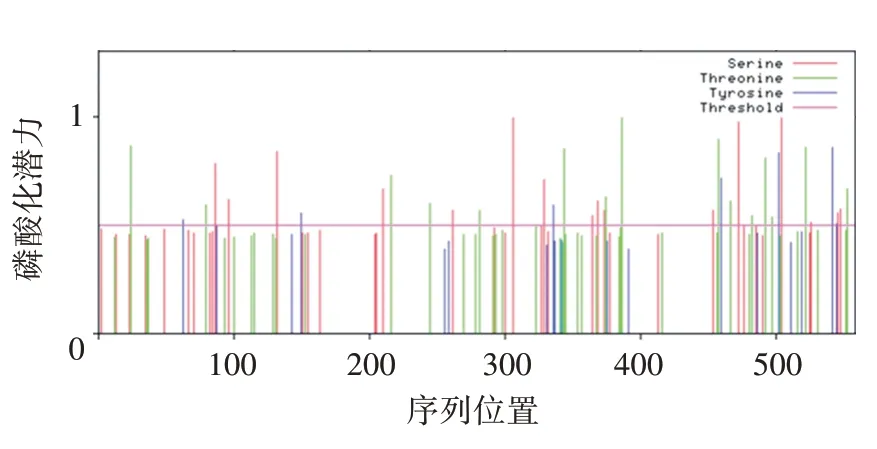
图7 PE_PGRS35蛋白磷酸化位点预测Fig.7 Prediction of phosphorylation sites of PE_PGRS35 protein

图8 PE_PGRS35蛋白保守域分析Fig.8 Analysis of conserved domains of PE_PGRS35 protein
2.4.3 跨膜区预测 TMHMM2.0 工具PE_PGRS35无跨膜区,且预测所有氨基酸位于胞质内的概率为0.006 19,推测为膜外蛋白,见图9。
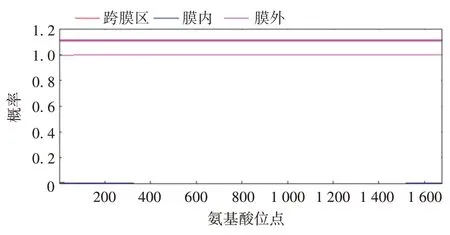
图9 PE_PGRS35蛋白跨膜区预测Fig.9 Prediction of transmembrane region of PE_PGRS35 protein
2.4.4 二级结构和三级结构预测 SOPMA 软件对PE_PGRS35 蛋白的二级结构进行预测,其中α⁃螺旋(Hh)109个,占19.53%;β⁃折叠(Ee)157个,占28.14%;β⁃转角(Tt)40 个,占7.17%;无规则卷曲(Cc)含量最高,252 个,占45.16%。因此,PE_PGRS35 的主要二级结构形式为β⁃折叠和无规则卷曲。SWISSMODEL工具对PE_PGRS35 蛋白的三级结构进行预测并构建模型,其中有GMQE和QMEAN 两个模型构建质量评估指标,GMQE的取值0~1,越靠近1,构建的模型越好;QMEAN 得分越接近0,构建的模型越成功,而分数≤-4.0,构建模型不可靠。该模型GMQE 评分为0.36,QMEAN评分为0.75。见图10。
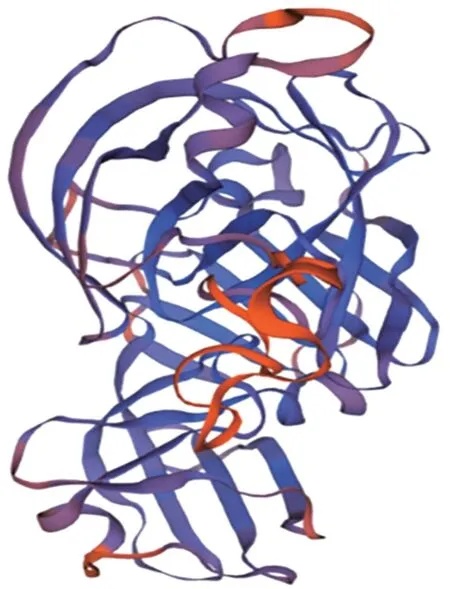
图10 PE_PGRS35蛋白三级结构Fig.10 Tertiary structure of PE_PGRS35 protein
2.4.5 相互作用蛋白预测 STRING 软件分析PE⁃PGRS35 蛋白相互作用的网络图见图11,节点数11个,Rv1769、PPE8、PPE64、PPE54、PPE24、PPE16、PPE35、PPE6、PPE28、PE2共10个蛋白与PE⁃PGRS35蛋白相互作用。
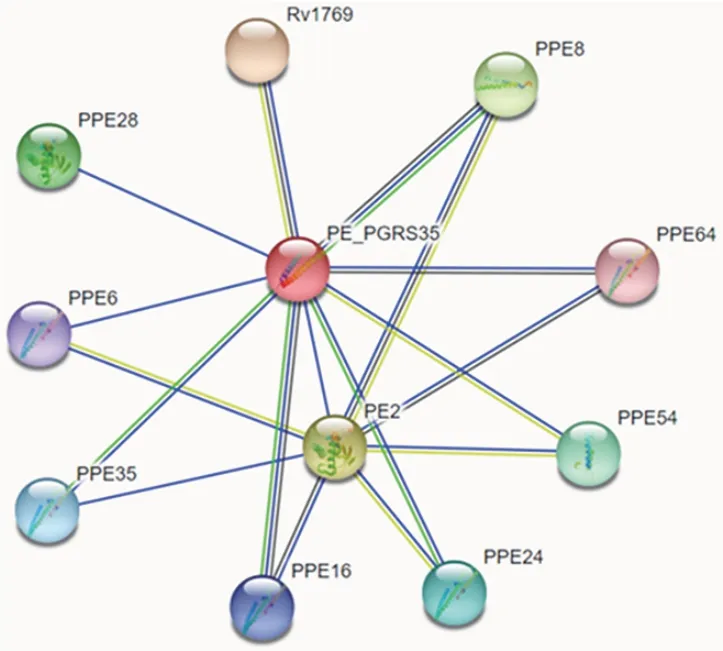
图11 PE_PGRS35蛋白相互作用蛋白分析Fig.11 Analysis of interacting proteins of PE_PGRS35 pro⁃tein
3 讨论
MTB 是人类结核病的病原体,仍然是全球范围内的主要致死病原体之一,控制结核病需要更好地了解MTB逃避免疫系统并在宿主体内持续存在的机制[7]。结核病是宿主与病原体及环境条件相关的复杂因素相互作用的结果,活动性结核病可通过长期的多药治疗方案治愈,但多重耐药结核病的出现仍然是未来结核病护理的主要障碍[8]。潜伏期是结核病感染最显著的特征之一,在该种情况下,MTB与宿主免疫系统建立了动态平衡,并伴随患者持续终生,且不会出现结核病的迹象及相关症状[9]。PE_PGRS家族成员仅在分枝杆菌基因组中被发现,因此对该家族蛋白的进一步研究将有助于了解结核病的发病机制和新的预防及治疗方法,以便寻找更有效的靶点药物和新型疫苗[10]。
PE 和PE_PGRS 蛋白家族被认为是海洋分枝杆菌中可能的毒力因子,参与分枝杆菌之间的细胞表面相互作用以及分枝杆菌与巨噬细胞的相互作用[11]。据文献报道,经MTB基因组测序发现了PE的多基因家族,占MTB 整个基因组的5%,由36 个同源PE基因和63 个分布在整个基因组中的同源PE_PGRS基因组成,位于PE_PGRS基因N⁃末端的PE结构域与38个PE基因高度同源,表明这些基因间关系密切[12⁃13]。PE_PGRS蛋白家族的表达模式因家族成员和条件的不同而存在较大差异,该家族成员参与抗原变异和免疫逃逸等相关免疫反应,有助于了解MTB 的生存和发病机制[14]。已有研究发现,PE_PGRS33(Rv1818c)在耻垢分枝杆菌的表达可增强其在巨噬细胞和宿主体内的持久性,诱导巨噬细胞凋亡和坏死[15]。PE_PGRS42(Rv2487c)被提议作为结核病诊断和疫苗的候选药物[16]。PE_PGRS39(Rv2340c)作为一种细胞外蛋白可能直接在宿主⁃病原体相互作用中发挥作用且具有引发免疫反应的潜力,有助于深入了解疫苗的开发[17]。
PE_PGRS35 蛋白由Rv1983基因编码,其氨基酸序列保守性很强,是MTB 所特有的性质。PE_PGRS35 是一种含588 个氨基酸的蛋白质,含有1 个独特的C⁃末端结构域[6]。BURGGRAAF 等[18]研究表明,PE_PGRS35 在海洋分枝杆菌中表达为异源蛋白时,其在海洋分枝杆菌中的同系物可以加工MTB 蛋白LipY(LipYtub),PE_PGRS35蛋白对来自海洋分枝杆菌和潜在MTB 的PE_PGRS 蛋白具有蛋白水解活性,被认为在免疫调节、巨噬细胞侵袭和B 细胞反应中发挥着重要作用。已有研究表明,将PE_PGRS35重组载体转染至HeLa和HEK293上皮细胞中均可被强烈表达,与PE_PGRS14、PE_PGRS24等7个基因共属于组成型表达[19]。PE_PGRS35 是在感染牛和接种BCG 的牛中被识别的一种抗原,有56%的结核病患者对PE_PGRS35 中至少一种肽有阳性反应,结核病患者会优先识别 PE_PGRS35⁃P4、P6⁃P13 和 P24 区域,已有研究数据表明,这些表位在结核病的免疫学诊断中可能具有潜在的诊断价值[20]。PE_PGRS35蛋白是RD2 区的蛋白,在MTB 毒株中保守存在。GROVER 等[2]推测,PE_PGRS 家族成员在肺泡中形成空泡的过程是通过影响肉芽组织或维持刺激肿瘤坏死因子的方式实现的。尽管如此,PE_PGRS35 蛋白如何在结核病发病中起作用,以及其功能和生物学作用尚不明确,有待进一步探讨。
本研究扩增了PE_PGRS35编码基因,并利用同源重组技术将其克隆至pET28a载体,经DNA 测序分析,测序结果与预期基因序列相一致,表明重组质粒pET28a⁃PE_PGRS35构建成功。SDS⁃PAGE 分析显示,诱导的重组菌在相对分子量约53 000 处可见明显条带,大小与预期结果相一致,并经Western blot分析,表达的PE_PGRS35 蛋白以包涵体的形式存在,且具有良好的反应原性。这与很多MTB 蛋白类似[21⁃22]。此外,本研究对包涵体蛋白进行了溶解和纯化,获得纯度较高的变性蛋白,后续也将尝试用纯化后的PE_PGRS35 蛋白制备多克隆抗体。本研究在PE_PGRS35 的性质、结构和跨膜区等方面进行了生物信息学分析。PE_PGRS35 的等电点为4.89,不稳定指数为48.30,属于酸性不稳定性蛋白。在线软件TMHMM 预测PE_PGRS35 蛋白无跨膜区,且预测所有氨基酸位于胞质内的概率为0.006 19,推测为膜外蛋白。MAWUENYEGA 等[23]分析了 MTB 中上千种蛋白的亚细胞定位,证明PE_PGRS35蛋白定位于细胞壁上,这与WOLFPSORT 软件分析结果一致,表明PE_PGRS35 蛋白可能在MTB 与宿主细胞之间发挥着相互作用。其二级结构主要为β⁃折叠和无规则卷曲,占73.3%;PE_PGRS35 含39 个磷酸化位点,无规则卷曲占45.16%,表明其易与抗体嵌合。CHEN等[24]发现,95%的 PE⁃PPE 蛋白对与ESX⁃5 分泌系统分泌的EspG5相互作用从而形成晶体结构,同时阐明了PE⁃PPE 蛋白对结合特异性的分子基础,从而有利于结核分枝杆菌发挥免疫效应。WILLIAMSON 等[25]提出来自 ESX⁃3 系统的 PE5mt⁃PPE4mt⁃EspG3mm的异三聚体的晶体结构,揭示了EspG3mm以类似于EspG5的方式专门与PPE4mt相互作用。根据对PE_PGRS35蛋白的相互作用蛋白的分析,由此可以推测PE_PGRS35 蛋白也能与其相互作用蛋白构成PE⁃PPE 结合对,从而与EspG5相互作用,发挥其对机体的免疫效应。
综上所述,本研究成功构建了pET28a⁃PE_PGRS35表达载体,经IPTG 诱导表达了PE_PGRS35 蛋白,该蛋白以包涵体形式存在,纯度较高,并利用在线软件对其进行了生物信息学分析。本研究在结核病的诊断、治疗和疫苗开发方面均具有潜在的价值,有利于控制结核病的传播及流行。

