棉籽粕和菜籽粕替代部分鱼粉对黄颡鱼肉质及肌肉发育相关基因表达的影响
邹峰余 韩亚康 罗 智 赵 涛 徐杰杰 谭肖英
(华中农业大学水产学院分子营养实验室, 武汉 430070)
鱼粉(FM)具有蛋白质含量高、氨基酸(AA)组成平衡、富含不饱和脂肪酸、抗营养因子含量低等优点, 是水产动物尤其是肉食性鱼类的最佳蛋白质来源。然而, 由于鱼粉在水产行业中的大量使用,导致其资源紧缺, 需求与价格不断上涨, 从而难以满足水产行业日益增长的生产需求, 限制了水产饲料工业与养殖业的快速、可持续发展[1]。不仅如此, 过度使用鱼粉还会导致一系列的环境问题。在这种情况下, 寻找并开发一种可靠的植物蛋白源来替代鱼粉成为当今水产行业的热点问题。棉籽粕是水产饲料中常见的植物蛋白来源。许多研究评价了棉籽粕作为鱼粉替代品在草鱼 (Ctenopharyngodon idella)[2]、虹鳟 (Oncorhynchus mykiss)[3]和大菱鲆 (Scophthalmus maximus)[4]中的作用。菜籽粕(RSM)由于蛋白质含量高, 消化率高, 被认为是鱼粉的合适替代蛋白质[5]。这两种植物蛋白源被广泛使用于替代鱼粉作为水产饲料原料。然而棉籽粕用于饲料原料受游离棉酚、环丙烯脂肪酸的存在及赖氨酸和蛋氨酸含量低的限制[6]而菜籽粕中赖氨酸、蛋氨酸和精氨酸含量较低, 并且含有各种抗营养因子, 如硫代葡萄糖苷、芥酸、植酸、单宁和芥子碱, 这些都会对生长和新陈代谢产生负面影响[7]。
肌肉是复杂的机体组织, 是鱼类躯干的主要可食部分。鱼类肌肉生长是一个动态的过程, 涉及肌纤维的增生和肥大, 是在肌源性调节因子(MRFs)和肌生长抑制素(MSTN)等一系列转录因子的控制下进行的[8]。MRFs包括Myod、Myf5、Mrf4和Myog,在成肌细胞增殖和分化中起关键作用[9]。MSTN通过抑制鱼的肌肉发生, 起到肌肉生长的负调控作用[10]。此外, 肌肉生长增加的过程还与蛋白质积累有关[11]。肌肉的蛋白质沉积是蛋白质合成与降解平衡的结果。先前的研究表明, 在大鼠(Rattus norregicus)和虹鳟中, 雷帕霉素(TOR)的靶点是PI3K/AKT通路的下游成分, 在蛋白合成中起关键作用。TOR调节其下游效应体核糖体S6激酶1(S6K1)和真核翻译起始因子4E-结合蛋白1 (4E-BP1)的磷酸化, 最终促进鱼的蛋白质合成[12]。
同时, 随着消费者健康意识的提高, 人们越来越重视肉的品质和营养成分。因此, 水产养殖业越来越关注饲养管理、饲料组成和应激反应等多种外部因素对鱼类肌肉质量的影响[13—15]。鱼肉品质受营养成分、理化和质地参数等多方面的影响。营养成分主要表现为肌肉蛋白质和脂肪含量。此外, 理化指标例如羟脯氨酸含量, 以及质地参数(硬度、弹性、内聚性、黏性、咀嚼性和回弹性)也是衡量肉质的重要指标。
以往关于植物蛋白源替代鱼粉的研究主要集中在生长性能、肠道健康、抗氧化和免疫等方面,而对肌肉生长以及肉质影响的研究较少。在草鱼中发现, 使用高比例的菜粕(27%)以及棉粕(27%)混合替代鱼粉以及豆粕后, 对草鱼的生长性能和肉质产生负面影响[16]。在草鱼饲料中添加不超过15%的苜蓿草粉时, 对其生长性能无显著影响, 且能提高其肌肉品质及血清抗氧化能力[17]。在大口黑鲈(Micropterus salmoides)中, 当用浓缩棉籽蛋白(CPC)替代日粮中70%的鱼粉, 会对其生长性能以及肉质产生负面影响[18]。
黄颡鱼(Pelteobagrus fulvidraco)是一种淡水特种经济鱼类, 广泛分布于我国各大水系中, 其肌肉蛋白高且脂肪少, 营养丰富, 肉质鲜美, 具有较高的经济价值。本试验以黄颡鱼为研究对象, 测定肌肉组织营养成分、肌纤维直径、肌肉质构、肌纤维发育相关基因和TOR通路相关基因表达以及抗氧化指标, 旨在探究菜粕和棉粕复合替代饲料中鱼粉对黄颡鱼肌肉组织发育性能及肌肉品质的影响。
1 材料与方法
1.1 试验用鱼及饲养管理
黄颡鱼幼鱼选自湖北省武汉市某渔场。在正式试验开始前, 黄颡鱼幼鱼在循环水养殖系统暂养2周, 对其进行驯化。在暂养结束后, 选择体质健康、规格均匀、平均体重为(2.38±0.10) g的黄颡鱼幼鱼450尾, 随机分成5个组, 每组3个重复, 每个重复30尾, 放入15个圆形养殖桶中。养殖采用脱氯自来水, 并且持续曝气至溶氧饱和。在试验期间, 每天人工定时投喂2次(08:30和16:30), 投喂至饱食(表1),投喂前清理缸内粪便, 持续10周。每2周称重1次,并且彻底清理鱼缸;每天记录死鱼的数量及饲料摄食量。养殖期间每周两次测定水质参数, 控制水温在28.3—29.4℃, 溶解氧浓度约为6.37—6.67 mg/L, NH4-N不超过0.1 mg/L。

表1 试验饲料配方及主要营养物质Tab.1 Ingredients and proximate compositions of the experimental diets (g/kg dry matter)
1.2 样品采集
在饲喂试验结束时, 禁食24h后对每个鱼缸中的鱼进行计数和称重。然后每个鱼缸随机选取12尾鱼, 在放有50 mg/L苯佐卡因的桶中麻醉。取其中6尾鱼的左侧肌肉样本, –20℃冷冻保存, 用于肌肉成分分析。同时, 从这6尾鱼的右侧取得肌肉样品, 测定理化指标。另外6尾鱼的左侧肌肉标本在液氮中急速冷冻过后, –80℃保存, 用于酶活性、基因表达等分析。此外, 将其中3尾鱼的右侧肌肉用模具切成1 cm×1 cm×1 cm的肌肉块, 用于纹理参数的测定。另外取2尾鱼右侧肌肉用于组织学分析。
1.3 粗成分以及羟脯氨酸含量测定
黄颡鱼肌肉进行水分、粗蛋白、粗脂肪和灰分的分析。样品在105℃烘干至恒重后求得水分含量; 粗蛋白的测定采用全自动定氮仪(N/6.2); 用索氏抽提法以乙醚为抽提剂测定粗脂肪含量; 在电炉上将样品炭化后, 于马福炉中(550℃)灼烧12h测得样品灰分。采用Periago等[19]报道的方法测定肌肉羟脯氨酸含量, 将肌肉样品酸水解后, 用分光光度法测定其中羟脯氨酸氧化产物与二甲氨基苯甲醛反应后的产物, 从而测算羟脯氨酸含量。
1.4 肌肉质构的测定
采用TA.XT PLUS 质构仪(Stable Micro Systems, 戈德尔明, 英国)进行鱼肉组织分析,以质构剖面分析法测定肌肉组织的质构特性(TPA9)[20]。每个缸选取大小相近的3尾鱼取同一位置的背部肌肉, 于室温下以8 mm圆柱形探针测定肌肉组织的硬度、咀嚼性、内聚性和弹性等指标。
1.5 组织学分析
石蜡包埋白色肌肉横断面(5 μm), 苏木精-伊红染色评价肌肉形态。在光学显微镜下观察染色切片, 利用Image J软件, 测量每尾鱼各切片约300个相邻肌纤维的数量和直径。将肌纤维分为3个直径范围(≤20 μm, 20—50 μm, 以及≥50 μm)。肌纤维频率表示为每一种直径级别肌纤维的数量占肌纤维总数的比率。
1.6 实时聚合酶链反应(RT-PCR)分析
参考文献方法[21], 黄颡鱼肌肉总RNA的提取按照说明书进行, 通过琼脂糖凝胶电泳进行检测其质量, 使用Nanodrop ND-2000(NanoDrop Technolo-gies, 美国)分光光度计测定其浓度和纯度, 根据TaKaRa(中国, 大连)的逆转录试剂盒说明书, 合成第一链cDNA, 保存于–20℃。荧光定量引物在表2中给出, 选择了6个管家基因(β-actin、b2m、rpl7、hprt、ubce、18S RNA和gadph)检测转录稳定性。使用(https://genorm.cmgg.be/)geNorm分析,rpl7和gadph的基因表达水平最为稳定。因此, 将基因表达水平标准化为rpl7和gadph的几何平均值, 通过2–∆∆Ct方法计算相对表达相对于对照的倍数变化。

表2 荧光定量引物Tab.2 Primers used for real-time PCR
1.7 抗氧化酶活和脂质过氧化分析
丙二醛(Malondialdehyde, MDA)测定试剂盒、总超氧化物歧化酶(Total superoxide dismutase, TSOD)测定试剂盒、过氧化氢酶(Catalase, CAT)测定试剂盒和总抗氧化能力(Total antioxidant capacity, T-AOC)检测试剂盒均购于南京建成生物工程研究所有限公司, 测定操作按说明书进行。
1.8 数据分析
使用SPSS 19.0软件对数据进行统计和分析, 以均值±标准误(mean±SE)表示结果。进行统计分析前, 采用Kolmogorov-Smirnov检验评估不同处理的正态性。各处理组间显著性使用单因素方差分析和Duncan多重比较检验,P<0.05被认为具有显著性差异, 采用不同字母表示不同水平替代饲喂组间差异显著性。此外, 进行了线性以及二次项回归分析。
2 结果
2.1 肌肉粗成分及羟脯氨酸含量
由表3可知, 随着饲料中的棉粕和菜粕的混合替代升高, 肌肉中的粗蛋白和粗脂肪含量下降, 其中, 对照组和RM10 组无显著差异, 而当替代水平达到20%及以上时, 粗蛋白和粗脂肪含量显著性降低, 而水分与灰分则在各组中无显著差异。此外,肌肉中的羟脯氨酸含量随着替代水平升高而下降。

表3 不同水平复合植物蛋白源替代鱼粉后黄颡鱼肌肉粗成分、羟脯氨酸含量(鲜重基础)Tab.3 The crude composition and hydroxyproline content of yellow catfish muscle after replacing fish meal with mixed plant protein sources at different levels (wet weight basis)
2.2 肌肉质构以及肌纤维直径级别分布
如图1和表4所示, 菜粕和棉粕的混合替代影响了肌肉的微观结构, 替代组的肌纤维直径小于对照组, 定量结果显示, 直径大于等于50 μm的肌纤维的数量随着替代水平升高而降低, 而直径小于20 μm的纤维数量则呈现上升趋势。RM10组与对照组中直径大于等于50 μm的肌纤维数量没有显著性差异, 其他试验组的显著降低。
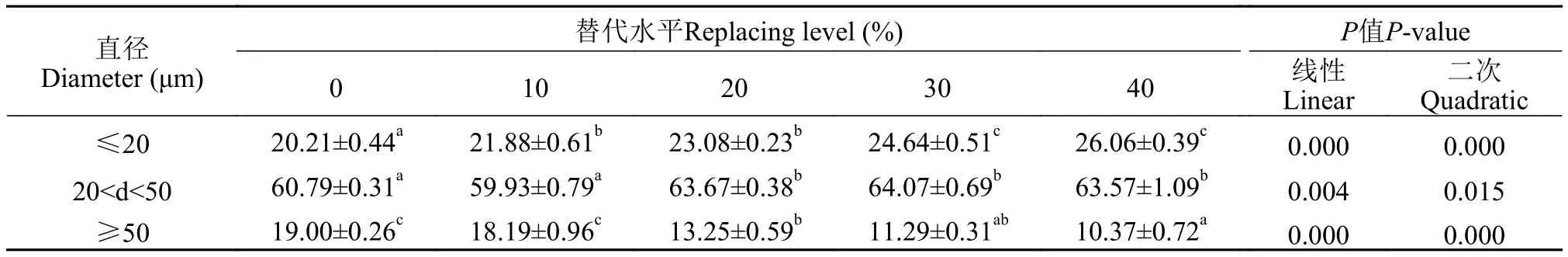
表4 黄颡鱼肌肉纤维直径频率百分比Tab.4 Muscle fibers cellularity and percentage frequency of yellow catfish

图1 不同水平混合植物蛋白源替代鱼粉对白肌横断面显微结构影响Fig.1 The effect of different levels of mixed plant protein sources in place of fish meal on the microstructure of white muscle cross-section
试验黄颡鱼肌肉硬度在各组间没有显著差异,RM40组的弹性以及咀嚼性显著高于对照组, RM10以及RM20组的内聚力以及黏性显著高于其他组,对照组以及RM30替代组的黄颡鱼肌肉回复力显著高于其他组(表5)。
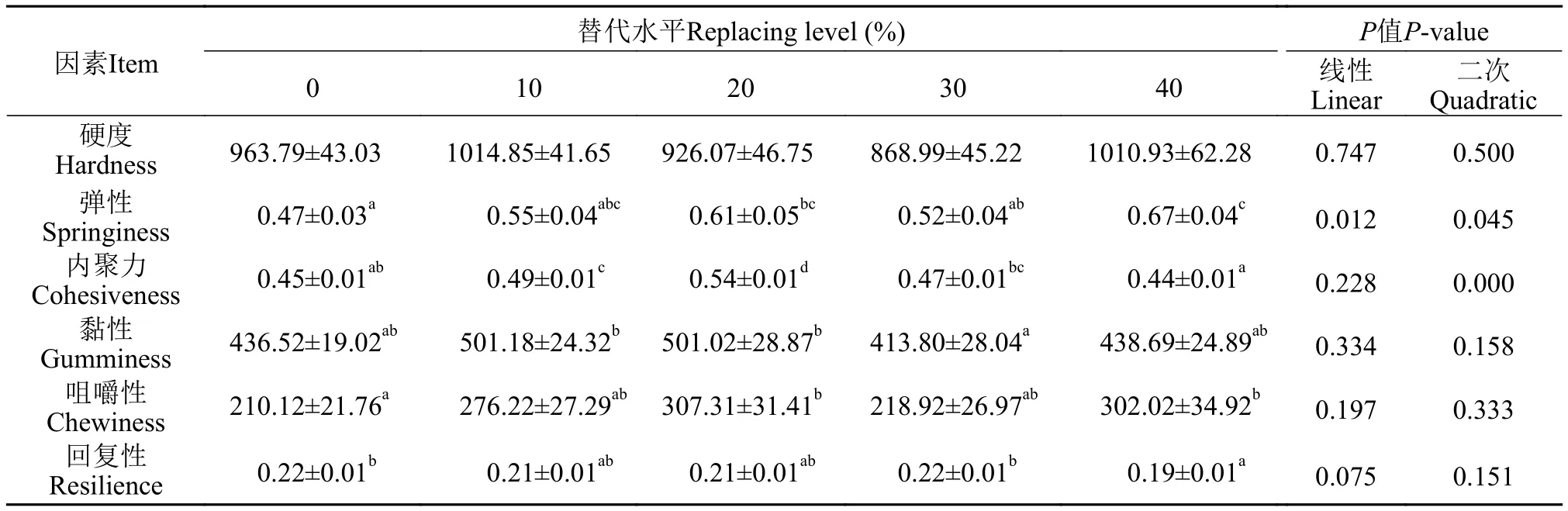
表5 不同水平混合植物蛋白源替代鱼粉对黄颡鱼肌肉质构影响Tab.5 The effect of different levels of mixed plant protein sources in place of fish meal on the muscle texture of yellow catfish
2.3 肌肉发育相关基因及蛋白代谢相关基因表达的影响
饲料中混合植物蛋白源替代鱼粉后显著降低了akt1、mtorc1和s6k1的mRNA水平, 升高了4ebp1的mRNA水平。肌肉纤维发育相关基因myod、myog和mrf4的mRNA水平随着替代水平升高逐渐升高,而myf5与mstn的基因表达在各组间无显著差异(图2)。
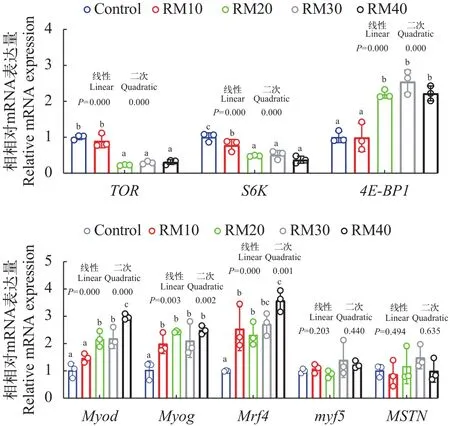
图2 饲料中混合植物蛋白源替代鱼粉对黄颡鱼肌肉中TOR通路及肌纤维发育相关基因表达的影响Fig.2 Effects of mixed plant protein sources in place of fish meal on the expression of TOR pathway and muscle fiber developmentrelated genes in the muscle of yellow catfish
2.4 肌肉组织抗氧化能力及氧化损伤
RM10组黄颡鱼肌肉中的MDA含量、CAT及T-AOC活性与对照组没有显著性差异。当菜粕和棉粕混合替代20%及以上水平鱼粉时, 黄颡鱼肌肉组织的T-SOD和CAT活性下降, 总抗氧化能力(TAOC)显著性下降, MDA含量显著性上升(表6)。

表6 黄颡鱼肌肉抗氧化能力以及MDA水平Tab.6 Antioxidant ability and MDA level of yellow catfish muscle
3 讨论
3.1 复合植物蛋白源替代对鱼类肌肉营养成分及羟脯氨酸含量的影响
鱼肉的品质一部分反映在消费者所关心的营养价值上, 蛋白质及脂肪含量代表了肉的主要营养价值, 在本研究中随着混合植物蛋白源替代鱼粉的水平达到20%及以上时, 肌肉中的粗脂肪和粗蛋白呈现下降的趋势。究其原因可能是由于菜粕及棉粕当中的氨基酸不平衡, 尤其是必需氨基酸中赖氨酸和蛋氨酸的相对缺乏, 以及抗营养因子如游离棉酚、植酸、单宁和硫代葡萄糖苷等导致鱼体对于饲料当中的营养物质吸收及利用率下降。Johnston等[22]报道, 肉的硬度一部分上可以由肌肉胶原蛋白含量所影响。羟脯氨酸是胶原蛋白中的主要氨基酸, 常用于反映组织中胶原蛋白含量, 胶原蛋白通过维持肌肉组织的完整性来影响肌肉质地, 本研究发现, 饲料中混合植物蛋白源替代后鱼粉后会导致肌肉组织中羟脯氨酸的含量下降, 间接反应肌肉中胶原蛋白含量的下降, 从而不利于肉质。
3.2 复合植物蛋白源替代对鱼类肌肉质构及肌纤维直径的影响
此外, 肌肉质地特征如硬度、弹性、黏性、内聚力、咀嚼性和回复性是评价鱼肉品质的重要指标。本研究发现, 混合植物蛋白源替代对于黄颡鱼的肌肉硬度无显著性影响, 另外, 替代增加了肉的弹性、内聚力和咀嚼性, 与草鱼中的研究结果部分相似[17], 此结果说明混合植物蛋白源替代对黄颡鱼肌肉质构有一定的影响, 这些影响可能是由于菜粕和棉粕饲料中的氨基酸不平衡及抗营养因子使肌肉组织的结构与组成发生变化所导致的[23,24]。此外, 肌肉纤维直径对肉的质地特征有很大影响[15]。肉的硬度与白肌纤维的直径呈负相关, 因为与较软的肉相比, 硬肉的肌肉纤维较小[25]。在我们的研究结果中, 植物蛋白源过度替代会导致黄颡鱼肌肉纤维中直径≥50 μm的纤维频率下降, 此结果表明了复合蛋白源的过度替代导致的氨基酸不平衡及抗营养因子的毒性作用可能会通过阻碍肌纤维肥大过程来影响鱼肉的质地并且损害肌肉的生长。
3.3 复合植物蛋白源替代对鱼类肌肉发育相关基因的影响
此外, 与对照组相比, 替代组的大部分肌肉发育相关基因的表达呈现上升趋势, 这种上升趋势反映了替代后肌肉发生再生的可能性较大, 可能提示着机体产生更多的肌肉细胞来补偿菜籽粕和棉籽粕中抗营养因子所造成的损伤。有相关研究报道,用抗营养因子更低的发酵植物蛋白源替代日粮中菜粕, 会导致草鱼肌肉中更低的MRFs的基因表达量[26]。据Alami-Durante等[27]报道, 蛋氨酸缺乏会导致虹鳟肌肉中的myf5、myod和mrf4等基因的表达显著上升。此外, 还有研究报道,MRFs基因的表达是对肌肉重量减少以及肌肉损伤的一种适应性反应[28], 同时本研究也发现, 随着替代水平上升, 肌纤维中≤20 μm的纤维数量出现上升, 这些都侧面映证菜粕与棉粕的过量替代可能会导致黄颡鱼肌肉生长性能下降及产生生理损伤。
3.4 复合植物蛋白源替代对鱼类蛋白代谢相关基因的影响
TOR是AKT/PI3K途径的下游成分, 在TOR信号通路被激活后, 可以通过抑制4E-BP1的活性、激活S6K1的活性来促进蛋白质的翻译[12]。4E-BP1是一种小分子转录抑制剂, 会抑制蛋白质的翻译启动。本研究发现植物蛋白源过度替代鱼粉会导致黄颡鱼肌肉中tor基因的相对表达量显著下降, 这与肝脏的报道结果类似[29]。此外, 植物蛋白源下调了下s6k1基因的表达, 上调4e-bp1的表达, 因此, 这可能是导致肌肉中蛋白质含量下降, 肌纤维直径减小的潜在分子机制。
3.5 复合植物蛋白源替代对鱼类肌肉抗氧化能力及氧化损伤的影响
肌肉品质与肌肉的氧化损伤程度密切相关,SOD和CAT是抗氧化防御的第一道防线, SOD催化O2–转化为H2O2, 而后CAT催化H2O2转化成H2O和O2保护细胞免受氧化损伤[30]。目前, 关于饲料中植物蛋白源对于鱼类肌肉抗氧化性能的研究较少, 相关研究表明, 植物蛋白源中的抗营养因子对鱼类的抗氧化酶以及免疫系统产生危害, 从而损害健康,抑制生长[31]。在本研究中, 随着复合植物蛋白源替代水平升高, 黄颡鱼肌肉中T-SOD及CAT活性下降,T-AOC也同样随之下降。这些指标的变化表明肌肉组织抗氧化能力下降, 并且导致MDA水平的上升, MDA是机体中不饱和脂肪酸发生过氧化反应的最终产物, 脂质过氧化的标志物, 能间接反应机体氧化损伤的程度。肌肉组织中这种抗氧化能力下降, 产生氧化损伤的原因可能要归因于菜粕及棉粕中的抗营养物质。
4 结论
本研究以黄颡鱼为研究对象, 围绕菜粕与棉粕复合替代对黄颡鱼的肌肉生长以及肌肉品质展开研究, 基于试验结果, 我们发现, 从黄颡鱼肌肉的生长与品质角度来看, 菜粕与棉粕复合替代水平在10%左右是最适宜的。而高水平替代会导致肌肉组织中的TOR通路基因表达下调, 肌纤维调控相关基因发生紊乱, 以及抗氧化能力下降引起的氧化损伤, 表现为肌肉组织中营养成分的下降, 肌纤维肥大的受阻, 从而不利于肌肉的生长及品质。

