舒张期室壁应变评估的左心室顺应性与新发心房高频事件的相关性研究
梁晓芸,郑明奇,吉立双,王 乐,魏 梅,刘 刚
(河北医科大学第一医院心脏中心,河北 石家庄 050031)
心房颤动(atrial fibrillation, AF)是成人最常见的持续性心律失常,AF的高发病率和高病死率对患者、社会健康和经济造成重大负担[1]。AF发作通常无症状且持续时间短[2],只有通过长时间连续监测才能显示[3]。心脏植入式电子装置(cardiovascular implantable electric devices,CIEDs)的使用,使心房电极有机会持续监测心房高频事件 (atrial high-rate episodes,AHREs)[4]。研究表明,AHREs不仅是心房颤动发生的先兆并且增加了缺血性卒中和死亡的风险,甚至会使植入型心律转复除颤器(implantable cardioverter defibrillator,ICD)心脏再同步除颤器(cardiac resynchronization therapy defibrillator,CRT-D)患者心室过速复发风险增加并可使室性心动过速恶化[5-10]。如何更早预测AHREs发生变得十分重要。研究证实,左心室舒张功能障碍与AF有关[11-12]。在影响左心室舒张功能的因素中,舒张期室壁应变(diastolic wall strain,DWS)可反应左心室的舒张功能障碍的亚组-心肌顺应性[13]。研究已证实了DWS评价的左心室顺应性是AF发生与发展的重要预测因素[14-15]。本研究的目的在于探讨DWS评估的左心室顺应性与CIEDs术后监测到的AHREs的关系。
1 资 料 与 方 法
1.1一般资料 回顾性收集2015年1月—2019年6月于河北医科大学第一医院置入CIEDs患者临床资料。纳入标准由于缓慢性心律失常置入CIEDs的成年患者。排除标准:①置入单腔起搏器(VVI和AAI起搏器)或DDD起搏模式更改为AAI及VVI起搏模式;②病历资料记录置入前有房性快速性心律失常(包括房性心动过速、心房扑动、心房颤动)的相关记录;③CIEDs置入术后30 d内监测到AHREs;④左心房内径>65 mm;⑤严重肝肾功能障碍、甲状腺功能障碍患者;⑥既往心脏外科手术史、内科介入性心脏瓣膜成形术或瓣膜置换术、先天性心脏病病史;⑦年龄<18岁;⑧随访时间不足24个月;⑨病历及随访资料不全的患者。最终纳入置入双腔CIEDs患者201例,男性82例,女性119例,进行至少24个月的随访。
本研究通过医院医学伦理委员会审批。所有患者均知情同意且签署知情同意书。
1.2方法
1.2.1一般资料的收集 收集患者的年龄、性别、体重指数(body mass index,BMI)、置入CIEDs原因、高血压史、卒中或短暂性脑缺血发作史、冠心病史、心力衰竭史、糖尿病史、饮酒史、吸烟史、用药史、术前1周血生化(尿酸、肌酐、三酰甘油、胆固醇、低密度脂蛋白、高密度脂蛋白等)实验室检查结果。
1.2.2心电图以及超声心动图的收集 所有患者均于CIEDs植入前24 h内行12导联心电图检查,评估心率、QRS时限和QRS形态(左束支阻滞/右束支阻滞)。所有患者均于CIEDs植入术前1个月内行经胸超声心动图检查,评估左心房横径、左心房前后径、室间隔厚度、左心室后壁厚度、A波、E波、E/A比值、左心室舒张末期内径、左心室收缩末期内径、左心室短轴缩短率,即(左心室舒张末期内径—左心室收缩末期内径)/左心室舒张末期内径×100%、左心室射血分数、DWS。DWS由M型超声心动图于胸骨旁左心室长轴切面测量左心室收缩末期后壁厚度(posterior wall thickness at end-systole,PWs)和左心室舒张末期后壁厚度(posterior wall thickness at end-diastole,PWd)后计算得出,即DWS=(PWs-PWd)/PWs[13]。见图1(本例患者测得PWs 为14.39 mm,PWd为8.77 mm,DWS为0.39)。
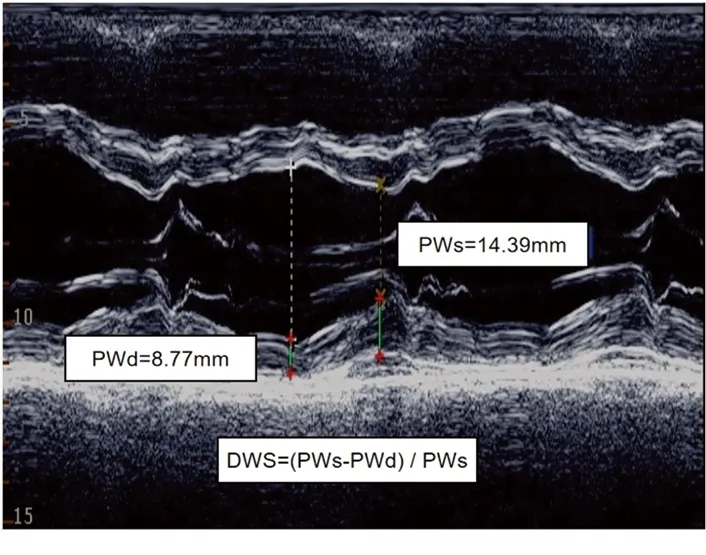
图1 DWS的测量与计算
1.2.3手术及术后随访资料的收集 所有患者的CIEDs植入均符合目前指南的适应证。按照最新指南术者根据患者的病情以及起搏器的型号:心房电极放置在右心耳或者房间隔;心室电极放置在右室心尖部或者室间隔(流出道);左心室电极放置在冠状窦内。特殊的心外膜电极是缝合在心外膜上(极少数情况会使用);本研究中201例患者心房电极放置于右心耳以及房间隔;心室电极放置于右心尖和室间隔部位。患者均于术后1个月、3个月、6个月、12个月到医院定期检查作为随访,之后每年定期随访并记录相关资料,主要为标准十二导心电图、CIEDs 程控报告(乐普公司、美国公司的Medtronic、ST.Jude的程控仪分别对其各自CIEDs进行程控分析)、心脏超声心动图等。
1.3判定标准 依据指南AHREs定义为心房率≥175 次/min并且持续时间≥5 min[1]。所有患者均未使用抑制AF的起搏算法。其中AHREs 诊断至少由2名经验丰富的人员审查(通过查看CIEDs提供的腔内心电图以及十二导心电图)。
1.4统计学方法 应用SPSS 23.0统计软件分析数据。计量资料比较采用独立样本t检验和 Mann-Whitney U检验;计数资料比较采用χ2检验或Fisher确切概率法;发生AHREs的独立危险因素用Cox回归模型进行多因素回归分析;相关性分析采用Pearman相关法;用 ROC 曲线描述DWS对AHREs的预测价值并找出最佳临界值;根据DWS最佳临界值,绘制 DWS二分类变量对应随访中出现 AHREs的COX回归生存曲线。P<0.05为差异有统计学意义。
2 结 果
2.1一般资料 符合纳入以及排除条件的患者共201例,所有患者中位年龄为70.00岁,平均随访(37.17±11.81)个月。所有患者CIEDs均为双腔起搏器或者埋藏式心律转复除颤器,无单纯心电监测设备,且均随访24个月以上。在术后 12 个月内出现 AHREs 26例,在术后2年中出现AHREs共有64例。AHREs组与无AHREs组在左心房前后径、左心房横径、DWS比较差异有统计学意义(P<0.05),见表1。

表1 一般资料比较Table 1 Comparison of general data

表1 (续)
2.2DWS与AHREs的相关性多因素分析 使用COX逐步回归方法剔除无统计学意义的自变量,以生存结局(术后发生AHREs)和生存时间(术后确诊为AHREs的时间)为因变量,以糖尿病史(无=0,有=1)、饮酒史(无=0,有=1)、左心房前后径(连续变量)、左心房横径(连续变量)、DWS(连续变量)、生存时间(连续变量)、生存结局(无AHREs=0,有AHREs=1)自变量,多因素COX逐步回归结果:DWS每降低0.1单位与左心房横径被保留入回归方程,DWS值下降与左心房横径增加为CIEDs患者术后新发AHREs事件的独立危险因素(P<0.05),见表2。

表2 CIEDs术后新发AHREs的独立危险因素Table 2 Independent risk factors of new AHREs after CIEDs
2.3相关性分析 Pearman相关性分析显示DWS与左心房横径呈负相关(r=-0.255,P<0.001)。
2.4ROC曲线分析 以无AHREs患者为阴性,以AHREs患者为阳性,建立ROC曲线分析模型。术后24个月内,当最佳临界值为0.35时,DWS的AUC面积为0.872(95%CI:0.820~0.925,P<0.001),敏感度为81%,特异度为82%,见图2。

图2 CIEDs术前患者DWS预测术后新发AHREs事件的ROC曲线
2.5生存曲线分析 COX多元回归生存曲线评估DWS降低与否对CIEDs术后新发AHREs的影响,见图3。根据DWS的最佳临界值将所有患者分为2组(DWS降低组:DWS<0.35,DWS不降低组:DWS≥0.35)纳入多因素COX回归模型生存分析(校正因素为表1单因素分析中P<0.10的指标)。在随访期间,DWS降低组相对于DWS不降低组术后新发AHREs发生率较高(52/78例,67%vs.12/123例,10%,P<0.001),DWS<0.35组(HR:9.88;95%CI:5.25~18.57,P<0.001)相对于DWS≥0.35组术后AHREs发生的风险明显升高。

图3 COX 多元回归生存曲线评估DWS在随访中AHREs 发生的影响
3 讨 论
测量患者置入CIEDs术前的DWS和置入CIEDs术后监测记录的AHREs,显示由DWS评估的左心室顺应性与术后新发AHREs具有相关性,DWS降低是植入术新发AHREs的独立危险因素。此外,左心房横径增加也是置入术后新发AHREs的独立危险因素,且DWS与左心房横径呈负相关。本研究结果提示CIEDs术前监测DWS利于房性快速性心律失常的早期预测和诊治,从而改善患者预后以及减少并发症。左心室舒张功能障碍在成年人群中并不少见,不仅使心力衰竭的发生率及病死率增高,并且促进AF发生与进展[16-17]。左心室舒张功能障碍对心房结构和功能有明显的病理生理影响,其中许多为促心房心律失常的因素[11,18]。左心室舒张功能障碍增加左心室的舒张末期充盈压力使左心房壁的应力升高,最终导致心房重构。
目前超声心动图是唯一可以诊断左心室舒张功能障碍的无创影像学技术。左心室舒张功能主要由舒张早期左心室的主动舒张特性和顺应性共同决定的[11]。研究表明AF的发生率与经胸超声心动图评价的左心室舒张功能障碍有关[19]。但是常规超声心动图左心室舒张功能指标,例如E/A、E/e′以及三尖瓣反流峰值速度[17],主要表示左心室主动舒张特性并且易受负荷影响[20]。而DWS是一种与负荷无关可直接测量舒张期心室顺应性的超声指标[13]。其基于线弹性理论,即与施加“可压缩”心肌上的力相比,施加在舒张期僵硬心肌上的扩张力产生更少的舒张变形(壁变薄)和更大的平移(心外膜)壁运动。DWS与动物模型中有创测量的舒张期心室僵硬系数具有很好的相关性,并且急性容量负荷引起的适度充盈压力变化对DWS没有影响[13]。因此理论上,DWS降低与左心室顺应下降有关而与主动舒张因素无关。
相对于其他评估左心室舒张功能的检测指标,能够反应左心室舒张功能的早期阶段。Kang等[21]研究表明,左心室舒张功能正常的患者超声心动图显示,DWS较低的患者其左心室收缩末期容积和左心室质量指数增加,其认为DWS有助于显示左心室舒张功能正常的患者轻微的舒张功能障碍,而这种改变从左心室解剖重构开始并且在功能改变之前。Uetake等[14]对328例心脏结构正常(阵发性AF164例与非AF164例) 患者中研究DWS与AF的关系显示,调整AF的危险因素后,仅高血压史、血浆脑型利钠肽和DWS与AF患病率独立相关,而BMI、左心室质量指数、左心房容积指数和反应左心室舒张功能状态常见的超声心动图的指标均不相关,提出DWS相对于表示左心室舒张功能的常规超声心动图指标检测左心室舒张功能障碍敏感度更高。近年研究表明[14-15,22],DWS不仅是舒张性心力衰竭不良临床结局的独立预测因子,也是AF发生与进展的独立预测因子。
本研究首次在中国人群中研究DWS与CIEDs术后发生AHREs的相关性及预测性。ASSERT研究指出CIEDs术后3个月内出现AHRE的发生率为10%,在随后2年AHREs发生率增加24.5%[23]。因此本研究进行了2年的随访,研究显示1年内AHREs发生率为12.9%(26/201),2年内其发生率为31.8%(64/201)。在本研究中,无AHREs组DWS均值为0.41,而AHRE组DWS均值为0.30,这与之前研究结果类似[14-15]。
另外经多因素COX逐步回归分析,本研究显示CIEDs植入前DWS降低以及左心房横径增加是起搏器植入术后新发 AHREs的独立危险风险。通过相关性分析显示,DWS与左心房横径具有负相关性,但是相关性一般。可能是左心房扩大是左心室充盈压缓慢增加的标志,仅单一的左心房横径不能代表左心房的大小,既往研究也指出测量左心房体积相关参数对于预测AF及心血管预后的预测结果优于左心房直径[24]。ROC曲线分析DWS对双腔起搏器植入术后发生AHREs的预测价值,其AUC较大,其值为0.873.最佳临界值为0.35。根据最佳临界值绘制DWS对应AHREs的COX回归生存曲线显示,相比DWS≥0.35,DWS<0.35组其在CIEDs术后2年内发生AHREs的风险更高。这些结果支持我们认为DWS减小可以代表左心室顺应性下降。左心室顺应性下降使左心室舒张末期压力和心房壁应力增加,最终导致心房重构,促进双腔起搏器植入术后新发房性心律失常的发生。
本研究有一定的不足与局限性。①本研究为回顾性研究,我们没有机会测量其他超声心动图检测指标例如e′速度、平均室间隔-侧壁E/e′比值、三尖瓣反流速度峰值速度、左心房容积指数等,但研究已证实DWS对于预测AF发生的预测性优于左心室质量指数、左心房容积指数以及常规超声心动图舒张功能的检测指标。②本研究中的患者术前未严格采用长程心电监测进行排除房性心律失常,但是对于临床资料记录房性心律失常以及对于CIEDs术后30 d监测到AHREs的患者均不纳入。③DWS会随起搏器植入后发生变化,一次测量不能反映该参数的实际趋势,应该定期测量。接下来我们将规范流程,进一步完善超声心动图检测指标,更加全面准确研究舒张期室壁应变评估的左心室顺应性对新发心房高频事件的影响 。
综上所述,DWS作为反应左心室舒张功能之顺应性超声心动图检测指标,是CIEDs术后新发AHREs的独立危险因素。DWS值减小增加了CIEDs术后发生AHREs的风险。超声心动图中舒张功能指标DWS数值减少可提示舒张功能障碍。

