布托啡诺联合氟比洛芬酯预处理通过ANG(1-7)对小鼠肢体缺血再灌注诱发肾损伤的保护作用及机制
李海英,张玉平,张 青,张立民
(1.河北省张家口市第二医院麻醉科,河北 张家口 075000;2.河北北方学院基础医学院病理生理学教研室,河北 张家口 075000;3.河北省张家口市第二医院手术室,河北 张家口 075000)
缺血再灌注肾损伤是由于多种原因导致肾脏缺血和血液灌注恢复后引起肾脏功能短期内急剧下降或者丧失的临床综合征[1-2],临床常导致代谢废物堆积,缺血再灌注肾损伤在住院患者中发病率达21%[3-4]。研究表明,氟比洛芬酯可以发挥肾脏保护作用[5-6],氟比洛芬酯复合舒芬太尼可以降低手术后的疼痛,降低组织损伤[7-8],但是布托啡诺联合氟比洛芬酯是否具有肾保护作用尚不清晰。TNF超家族成员14配体(TNF superfamily member 14 ligand,LIGHT)/ TNF超家族成员14(TNF superfamily member 14,HVEM)是一种肿瘤坏死因子超家族成员,通过疱疹病毒进入介质(Herpes virus entry medium,HVEM)实现信号转导,可受到血管紧张素(1-7)[angiotensin (1-7),ANG(1-7)]调控,肾脏损伤中发挥重要调控作用[9-10],但在缺血再灌注引发肾脏损伤中的作用尚不清晰。因此本研究通过小鼠体内实验探讨布托啡诺联合氟比洛芬酯预处理通过ANG(1-7)对肢体缺血再灌注诱发肾损伤的保护作用及对LIGHT/HVEM信号通路的干预作用,为临床治疗缺血再灌注肾损伤提供理论基础。
1 材 料 与 方 法
1.1实验动物 45只8~10周龄雄性SPF级BABL/c小鼠,体重(20±2)g,购于北京智飞绿竹生物制药有限公司(SYXK(京)2021-0070)。小鼠饲养条件:温度18~22 ℃,相对湿度40%~60%,噪音85分贝以下,氨浓度15 mg/m3以下,通风换气8 次/h。
1.2药品与试剂 氟比洛芬酯注射液(国药准字H20041508) 购于北京泰德制药有限公司;布托啡诺注射液(国药准字H20020454)购于江苏恒瑞医药股份有限公司;戊巴比妥钠,≥98%购于北实纵横科学公司。伊红染色液购于北京威斯腾生物有限公司,苏木素染色液购于武汉赛维尔公司,DAB显色液购于英国Abcam公司,实时荧光定量PCR试剂盒购于日本Takara生物公司,Trizol裂解液购于日本 Takara 生物公司。蛋白上样缓冲液(5X) 购于上海碧云天生物有限公司,小鼠ANG(1-7)酶联免疫吸附测定试剂盒(E-EL-M2681c)购于武汉Elabscience公司。
1.3仪器设备 超低温冰箱购于Thermo Scientific 公司,实时定量PCR荧光扩增仪购于美国 Bio-rad 公司,低速摇床购于湖南平凡仪器有限公司,石蜡切片机购于德国Leica公司,摊片烤片机购于湖北泰维科技有限公司,电动组织匀浆机购于上海静信实业有限公司,Western blot电泳仪购于美国Bio-rad公司,光学显微镜购于德国Leica 公司,凝胶成像系统购于法国Vilber 公司。
1.4方法
1.4.1小鼠肢体缺血再灌注肾损伤模型的建立 小鼠随机分为对照组、模型组和试验组,每组15只。试验组小鼠实验前12 h采用腹腔注射氟比洛芬酯(50 mg/kg)和布托啡诺(1 mg/kg),对照组和模型组注射等量生理盐水。造模时小鼠腹腔注射5%戊巴比妥钠麻醉,模型组和试验组小鼠双后肢根部行橡皮套结扎术,缺血2 h后用手术剪剪断橡皮圈,双手按摩双侧后肢血流进行血流灌注4 h。对照组小鼠不进行结扎手术,其他操作一致,48 h后各组小鼠用于各项实验检测。
1.4.2HE染色及病理评分 将小鼠左侧肾组织浸泡于10%甲醛中,常规病理组织切片制备,对各组大鼠血管内皮进行固定包埋后切片,脱蜡覆水,苏木精染色5 min,5%乙酸1 min,伊红染色1 min,脱水:70%、80%、90%、100%酒精各10 s,二甲苯1 min,通风处自然晾干再封片,于显微镜下进行检查,根据肾小管间质半定量评分法对肾炎症细胞浸润、肾间质水肿和肾小管损伤分别进行半定量分析的标准评分,肾小管上皮细胞扁平化的存在(1分),小管刷状缘消失(1分),细胞膜泡出现(1分或2分),间质水肿(1分),胞浆空泡化(1分),细胞坏死(1分或2分),管腔梗阻出现管型或碎片(1或2分),正常肾小管为0分。
1.4.3小鼠肾功能指标检测 各组小鼠眼眶采血0.8~1.0 mL,1 000 r/min 10 min离心,分离血清,将血清置于全自动生化分析仪中检测小鼠血清中血清肌酐(serum creatinine,Scr)和尿素氮(urea nitrogen,BUN)水平。
1.4.4酶联免疫吸附测定检测小鼠血清和肾脏组织ANG(1-7)表达水平 分离小鼠血清以及右侧肾脏组织匀浆上清液后,严格按照小鼠ANG(1-7)酶联免疫吸附测定试剂盒说明进行,对应板孔中加入50 μL标准品工作液或样本后,立即每孔加入50 μL生物素化抗体工作液,37 ℃孵育45 min,弃掉板内液体,洗板3次,每孔加入100 μL HRP酶结合物工作液,37 ℃孵育30 min,弃掉板内液体,洗板5次,每孔加入90 μL底物溶液,37 ℃孵育15 min,每孔加入50 μL终止液,立即在450 nm波长下读数,处理数据。
1.4.5qPCR检测各组小鼠肾脏组织LIGHT和HVEM mRNA表达水平 将肾脏组织研磨后,无酶条件下加入1 mL TRIZOL提取总RNA,后反转录合成cDNA后,进行PCR扩增。95 ℃预变性10 min,95 ℃变性30 s, 60 ℃退火30 s,72 ℃延伸60 s,共38个循环。引物序列见表1。每个样品重复3次检测,利用2-△△ct相对定量法计算各个指标的相对表达量,采用内参GAPDH对其标准化处理。

表1 qPCR检测LIGHT和HVEM mRNA表达引物序列Table 1 Primer sequences of LIGHT and HVEM mRNA expression detected by qPCR
1.4.6Western blot 检测各组小鼠肾脏组织LIGHT和HVEM mRNA表达水平 将各组小鼠肾脏组织置于组织匀浆器内匀浆后,用1 mL RIPA蛋白裂解液在冰上提取总蛋白,采用BCA法对蛋白浓度进行测定。加入5×SDS的蛋白上样缓冲液煮沸后分装于EP管,储存于-80 ℃备用。聚丙烯酰胺凝胶电泳条件为:浓缩胶电压80 V 15 min,分离胶电压120 V 2 h,后转至PVDF膜,用5%脱脂牛奶封闭。加入特异性一抗LIGHT(1∶1 000,ab271185,abcam,英国)、jagged1(1∶1 000,ab109536,abcam,英国)、Notch1(1∶2 000,ab52627,abcam,英国)和β-actin (1∶5 000,ab6276,abcam,英国)于4 ℃冰箱过夜。TBST洗膜3次,每次5 min,加入特异性的羊抗兔二抗(1∶2 000),孵育1 h。TBST洗膜3次,每次5 min,采用ECL化学发光液曝光显影,使用Photoshop图像分析软件系统进行半定量分析。
1.5统计学方法 应用SPSS 26.0统计软件分析数据。计量资料比较采用单因素方差分析和SNK-q检验。P<0.05为差异有统计学意义。
2 结 果
2.1各组小鼠肾组织HE染色比较病理损伤情况 通过HE染色确认各组大鼠肾脏病理情况,对照组小鼠肾小球和肾小管结构正常,不存在炎症细胞浸润;与对照组比较,模型组小鼠肾组织损伤严重,肾小球毛细血管扩张充血,管腔明显扩张,出现上皮细胞水肿和脱落,部分肾小管上皮细胞空泡变性、坏死,肾间质存在大量炎性细胞浸润,管腔见大量上皮细胞碎片和红细胞管型;与模型组比较,试验组小鼠肾小球毛细血管扩张充血减轻,少见肾小管管腔扩张、肾间质少量炎性细胞浸润和肾小管上皮细胞碎片等损伤表现(图1)。
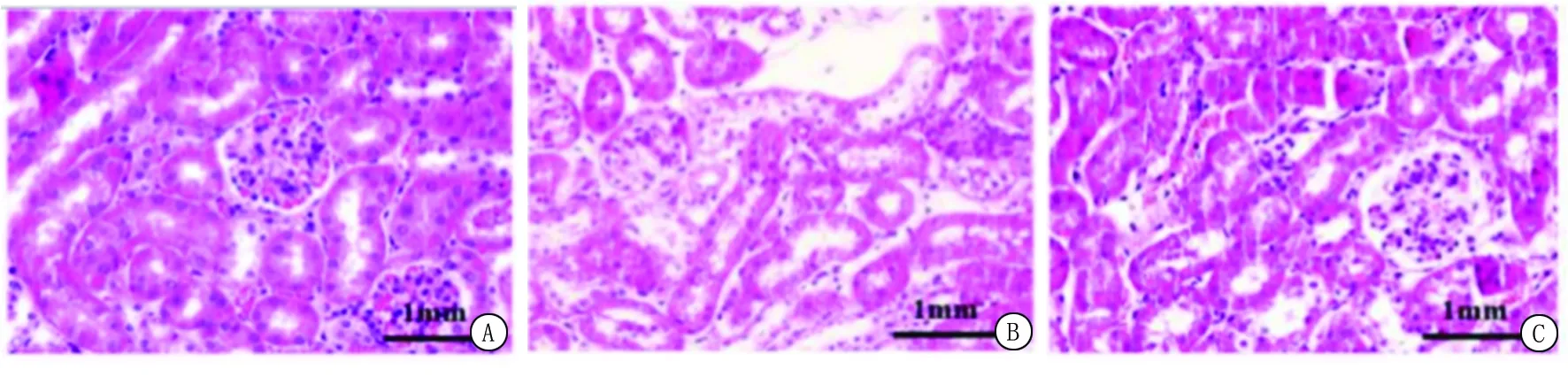
图1 各组小鼠肾组织HE染色比较病理损伤情况(HE ×400)
2.2各组小鼠肾功能指标比较和病理损伤评分比较 通过大生化确认各组小鼠肾脏肾功能指标水平,与对照组比较,模型组小鼠Scr和BUN水平、病理损伤评分显著升高;与模型组比较,试验组小鼠Scr和BUN水平、病理损伤评分显著降低,差异有统计学意义(P<0.05)。见表2。

表2 各组小鼠肾功能指标比较和病理损伤评分比较Table 2 Comparison of renal function indexes and pathological damage scores of mice in each group
2.3各组小鼠外周血和肾脏组织ANG(1-7)表达水平比较 通过酶联免疫吸附测定检测各组小鼠外周血和肾脏组织ANG(1-7)表达水平,与对照组比较,模型组小鼠血清和肾脏组织ANG(1-7)表达水平降低;与模型组比较,试验组小鼠血清和肾脏组织ANG(1-7)表达水平显著升高,差异有统计学意义(P<0.05)。见表3。

表3 各组小鼠外周血和肾脏组织ANG(1-7)表达水平比较Table 3 Comparison of ANG (1-7) expression levels in peripheral blood and kidney tissues of mice in each group
2.4各组小鼠肾脏组织LIGHT-HVEM mRNA表达水平比较 通过qPCR检测各组小鼠肾脏组织LIGHT-HVEM mRNA表达水平,与对照组比较,模型组肾脏组织LIGHT-HVEM mRNA表达水平显著升高;与模型组比较,试验组肾脏组织LIGHT-HVEM mRNA表达水平显著降低,差异有统计学意义(P<0.01)。见表4。

表4 各组小鼠肾脏组织LIGHT-HVEM mRNA表达水平比较Table 4 Expression level of LIGHT-HVEM mRNA in kidney tissue of mice in each group
2.5各组小鼠肾脏组织LIGHT-HVEM 蛋白表达水平比较 通过Western blot检测各组小鼠肾脏组织LIGHT-HVEM蛋白表达水平,与对照组比较,模型组肾脏组织LIGHT-HVEM 蛋白表达水平显著升高;与模型组比较,试验组肾脏组织LIGHT-HVEM蛋白表达水平显著降低,差异有统计学意义(P<0.01)。见表5。

表5 各组小鼠肾脏组织LIGHT-HVEM 蛋白表达水平比较Table 5 Expression level of LIGHT-HVEM protein in kidney tissue of mice in each group
3 讨 论
肾缺血再灌注损伤是由各种原因导致的肾脏灌注不足所致,伴随着一系列连贯的细胞事件发生,包括活性氧释放、凋亡、坏死、炎症细胞的浸润和活性介质的释放,常导致严重的组织损伤,临床常见于各种类型休克、急性肾动脉阻断或肾脏移植等临床治疗过程[11-12]。组织损伤后会引发肌酐急速升高、尿少或无尿等症状,若得到积极治疗并病情得到控制,一般临床肾功能恢复较好[13-14]。
布托啡诺为阿片受体部分激动剂,主要激动κ1受体,临床主要用于中度至重度疼痛(如肾或胆绞痛等)的止痛,或者术后、外伤、癌症止痛[12]。通过大数据Meta分析证实,布托啡诺对依托咪酯所致肌阵挛的预防作用[13],也研究表明,布托啡诺联合右美托咪定可有效治疗成人烧伤患者的疼痛,但是布托啡诺联合氟吡洛芬脂的临床作用尚不清晰[15]。氟吡洛芬脂是一种非甾体抗炎药,主要通过抑制前列腺素合成酶起作用,具有镇痛、抗炎及解热作用,对多组织器官具有抗炎保护作用[16]。氟比洛芬酯与复方双氯芬酸钠分别联合间苯三酚可以有效治疗肾绞痛[17],氟比洛芬酯联合“复元方”缩短患者住院时间,减少患者术后并发症、提高器官功能、减轻手术应激、改善肿瘤患者预后及延长患者的生存时间,但是氟比洛芬酯联合布托啡诺是否能够发挥肾脏保护作用尚不清晰,因此本研究通过构建小鼠肢体缺血再灌注模型,确定了缺血再灌注后小鼠出现了典型的肾损伤病理结果,氟比洛芬酯联合布托啡诺预处理可以显著降低小鼠肾脏组织损伤,降低炎性细胞浸润,维持组织结构完整,通过大生化分析Scr和BUN进一步证实了这种肾脏保护作用及肾功能提升作用;同时氟比洛芬酯联合布托啡诺预处理显著提升了外周血和肾脏组织ANG(1-7)表达水平。ANG(1-7)具有舒张血管,调节血压的作用,是肾素-血管紧张素系统中的一种内源性七肽,在组织细胞中的抗炎和抗纤维化活性而具有组织保护作用[16],对肾脏损伤具有积极作用,由此提示氟比洛芬酯联合布托啡诺可能通过提升ANG(1-7)水平,降低了组织缺氧,降低组织氧化损伤,同时降低炎症反应,降低组织炎性损伤,进而发挥肾组织的保护作用。
Light/HEVM信号通路编码的蛋白质在激活炎症和抑制性T细胞免疫反应的信号转导途径中发挥作用[18],Light/HEVM可以受到ANG(1-7)调控参与先兆子痫小鼠模型的病理生理学的炎症过程,但是否参与到缺血再灌注肾损伤中尚不清晰。本研究通过qPCR和Western blot证实氟比洛芬酯联合布托啡诺使用会抑制小鼠Light和HEVM信号通路蛋白表达,提示出对Light/HEVM信号通路的抑制作用,降低炎性通路的炎性反应,可以抑制炎性细胞的浸润,降低病理损伤,提示氟比洛芬酯联合布托啡诺可能通过ANG(1-7)提高组织抗炎性损伤,抑制炎性通路Light/HEVM的激活,降低了炎症反应中淋巴细胞和树突状细胞从外周向组织引流,进而降低组织纤维化和组织炎性损伤,维持肾脏组织的正常组织和结构功能,发挥肾保护作用。
综上所述,氟比洛芬酯联合布托啡诺可能通过ANG(1-7)提高组织抗炎性损伤,其机制可能与抑制炎性通路Light/HEVM的激活有关。可以进一步通过体外细胞学实验探究氟比洛芬酯联合布托啡诺对炎症因子的调控作用,为临床治疗提供分子依据。

