脉冲标记下甘蔗13C富集及氮磷钾含量变化
桂意云 李海碧, 韦金菊 周 会 祝 开 赵培方 刘昔辉, 区惠平,
(1中国农业科学院甘蔗研究中心∕广西农业科学院甘蔗研究所∕农业农村部广西甘蔗生物技术与遗传改良重点实验室∕广西甘蔗遗传改良重点实验室,广西 南宁 530007;2广西南亚热带农业科学研究所,广西 崇左 532400;3云南省农业科学院甘蔗研究所,云南 开远 661699)
稳定性同位素13C脉冲标记技术是研究植物光合作用及其光合碳在植物-土壤-大气系统中周转规律的科学高效方法之一[1-3]。借助稳定性同位素13C脉冲标记技术,可了解植物各生育时期光合碳的分配信息[4],也可科学区分不同碳源,从而更好地揭示土壤有机碳及其组分的分解程度和周转速率,以及示踪碳的迁移转化过程[5-6]。目前,科研用13C标记材料主要通过脉冲标记获取。国内外许多学者标记的材料主要涉及小麦[1-3]、水稻[7-8]、玉米[9-11]、大豆和湿地植物[12]等。霍莉莉等[12]研究表明,每次标记通入丰度99%、纯度99.999%的13CO2气体10 L 4 h,共标记4次,所获得的湿地植物根、茎和叶的Atom%13C是未标记植物的1.03、1.78和0.91倍,大豆根、茎和叶的Atom%13C是未标记的1.20、2.19和2.99倍,大豆标记效果优于湿地植物。由此可知,不同作物的标记效果存在差异。
甘蔗(Saccharumspp.)是全球重要的能源作物和糖料作物。甘蔗光合CO2补偿点低(1~10 mg·m-3),光合作用最适温度高(30~45 ℃),CO2固定效率和同化率高,因此,甘蔗被认为是碳中和背景下优选的C4作物[13]。利用稳定性同位素13C脉冲标记技术研究甘蔗光合作用、光合碳去向以及碳周转是当前应对全球气候变化影响的研究热点之一。然而,利用稳定性同位素13C脉冲标记技术探讨甘蔗13C富集的研究较少,亟需开发一种简单易行、低量高效、经济实用的标记方法。因此,本研究以甘蔗品种桂糖58号为试验材料,探索苗期甘蔗13C脉冲标记方法及标记效率,同时分析脉冲标记期间甘蔗营养元素的变化,旨在为甘蔗同位素的高效标记以及标记期间甘蔗的养分管理提供参考依据,并为进一步研究甘蔗秸秆碳在大气-植物-土壤中的周转提供科学材料。
1 材料与方法
1.1 试验材料
供试土壤采自广西农业科学院院本部甘蔗试验地,采样深度0~15 cm。土壤取回后自然风干,去除植物残体,粉碎、研磨过2 mm筛备用。土壤理化性质为:pH(H2O,土∶水=1∶2.5)值6.18,有机质含量17.1 g·kg-1,碱解氮含量48.3 mg·kg-1,速效磷含量0.3 mg·kg-1,速效钾含量75.6 mg·kg-1。供试甘蔗品种为桂糖58号(GT58),由广西农业科学院甘蔗研究所提供。
1.2 桶栽试验
试验在广西农业科学院甘蔗研究所智能温室大棚采用桶栽进行。试验用桶直径25 cm,高35 cm,每桶装过2 mm筛的风干土15 kg。每桶施用尿素30 g,钙镁磷肥37 g,硫酸钾20 g。2020年3月18日进行甘蔗催芽,3月25日选取长势一致的蔗苗移栽至试验桶内,每桶4株,共种植42桶。
1.3 13C脉冲标记试验
试验于2020年5月11日开始,设置0、0.32、0.64和1.28 g·m-3Na213CO34个用量水平,分别记为CK、T1、T2和T3。CK摆放在单独的温室大棚内,避免污染。标记在自制全密闭标记室进行。标记室由聚乙烯膜和直径20 mm的聚氯乙烯(polyvinyl chloride,PVC)塑管支架制成,其长×宽×高分别为1.25 m×1 m×1.25 m。内置1台外控小风扇、温度计、2个装13C丰度为99%的Na213CO3的烧杯(对角放),外置2个装盐酸的输液瓶。标记每隔7 d进行1次,共标记6次。标记时间为10:00—16:00。标记步骤如下:标记前,将栽植甘蔗的试验桶放进标记室,每处理放置9桶;用透明胶带粘贴密封出入口;开启标记室内顶端中间的风扇;5 min后,迅速通过外置输液瓶向标记室内装有Na213CO3的烧杯中一次性注入100 mL 2 mol·L-1的HCl(确保室内的Na213CO3完全反应,释放13CO2);标记结束后,关闭风扇,将甘蔗移出标记室,放置于温室大棚,常规管理。
1.4 样品采集与制备
分别在第2、第4和第6次标记结束后的第7天随机选择标记和未标记的甘蔗各3桶进行破坏性采样。从基部剪断蔗叶(标记时甘蔗处于苗期,以蔗叶为主),同时将全部土壤倒出平铺于干净的农膜上,挑出根系,先用自来水冲洗根系上黏附的土壤,再用蒸馏水洗净、沥干后,将蔗叶与根系分别置于105 ℃烘箱中杀青15 min,65 ℃恒温烘干至恒重,粉碎过100目筛待测。同时,在第6次标记开始时(注酸后2 min)及结束后均用注射器采集标记室内的气体用于CO2浓度和δ13C-CO2分析。
1.5 分析方法
蔗叶及根系的N含量采用凯氏定氮法测定,P含量采用钼蓝比色法测定,K含量采用火焰光度法测定[14]。蔗叶全碳含量以及δ13C值采用元素分析仪-同位素质谱仪(德国Elementar公司)测定,CO2浓度和δ13C-CO2采用高精度碳同位素分析仪(美国Picarro公司)测定。
1.6 数据处理[12, 15]
未标记作物的自然丰度用δ13C值表示,其计算公式如下:
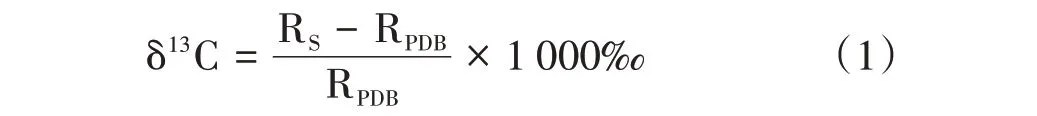
式中,RS为样品的13C∕12C值;PDB为标准物质,RPDB为标准物质的13C∕12C值,为0.011 237 2。
标记作物的同位素丰度用F(%)来表示,F(%)与δ13C(‰)的转化公式如下:
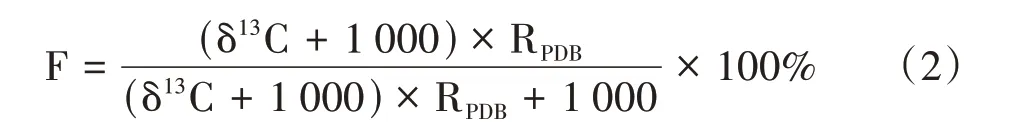
蔗叶、根系固定的13C量计算公式如下:
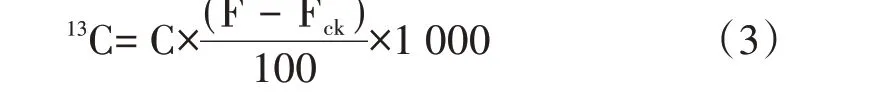
式中,13C为蔗叶的13C量(mg);C为蔗叶全C含量(g);F为标记组13C丰度;Fck为未标记组13C丰度。蔗叶、根系标记效率Em计算公式如下:
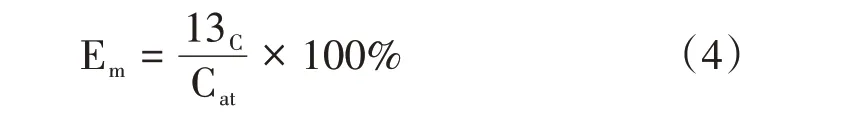
式中,Cat为添加到标记室的13C总量,其中1 g纯度为99%的Na2
13CO3中含13C量为0.12 g。采用Excel 2007和Origin 8.0软件作图,DPS统计软件进行数据统计,最小显著差异法(least significant difference, LSD)进行多重比较。
“动物行为的生理基础”是苏教版初中《生物学》教材八年级上册第18章“动物的行为”第2节内容,包含“动物行为的获得途径”和“动物行为的生理基础”两部分。
2 结果与分析
2.1 标记室CO2和δ13C-CO2浓度变化
由表1可知,标记开始时各处理的标记室内CO2浓度约为960.0 mg·m-3,各处理间差异不显著;标记6 h后,CO2浓度降至551.7~750.5 mg·m-3之间,各处理间差异显著,同时该浓度较标记开始时下降21.7%~42.3%,以T2处理降幅最大,高达42.3%,T3处理次之(40.1%),T1和CK处理较低,约为22%,与T2和T3差异显著。
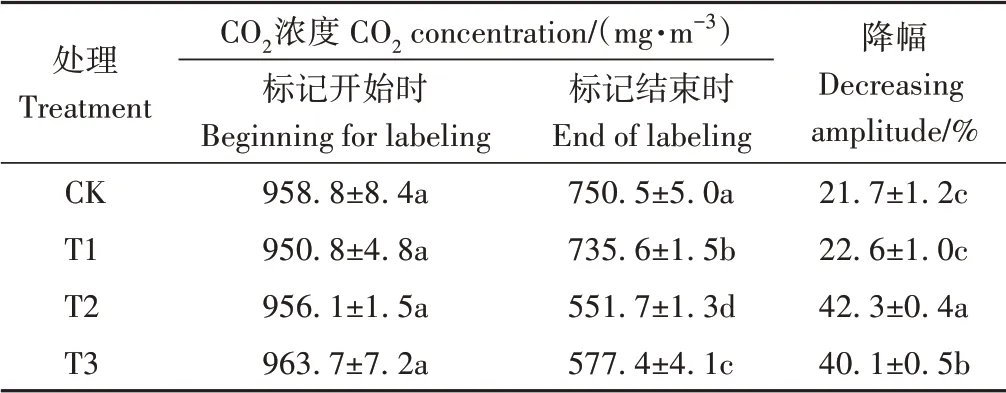
表1 标记室内CO2浓度变化Table 1 The change of CO2 concentration in close chamber
由表2和图1可知,标记开始时,每增加1个Na2
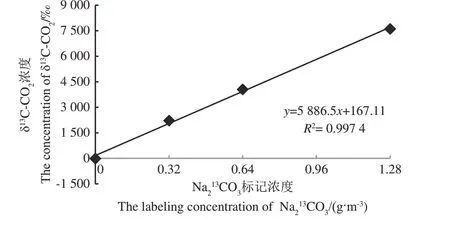
图1 标记开始时标记室内δ13C-CO2特征Fig.1 The dynamic change of δ13C-CO2
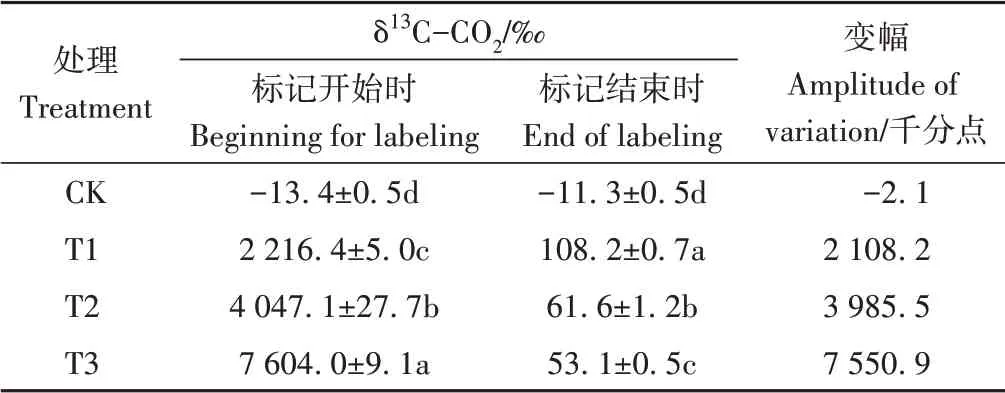
表2 标记室内δ13C-CO2变化Table 2 The change of δ13C-CO2 in close chamber
13CO3标记浓度梯度,标记室内的δ13C-CO2以5 886.5‰的速率线性增加,标记结束后,δ13C-CO2整体呈下降趋势,降幅为2 108.2~7 550.9个千分点,并随Na213CO3标记浓度的增加而增加。
2.2 蔗叶和根系δ13C和F值动态特征
由图2可知,蔗叶中的δ13C值高于根系。未标记的蔗叶和根系的δ13C值无明显变化,分别为-0.80‰和-13.04‰。而标记的蔗叶和根系δ13C值随着标记次数的增加而明显富集,且蔗叶δ13C值增加速率随着Na213CO3标记浓度的增加而增加,以T3处理的增加速率最高,每标记1次,蔗叶δ13C值增加85.841‰。根系δ13C值在T1处理下随着标记次数的增加呈线性增加,每标记1次,根系δ13C值增加4.094‰。在T2和T3处理下,根系δ13C值与标记次数呈一元二次关系。
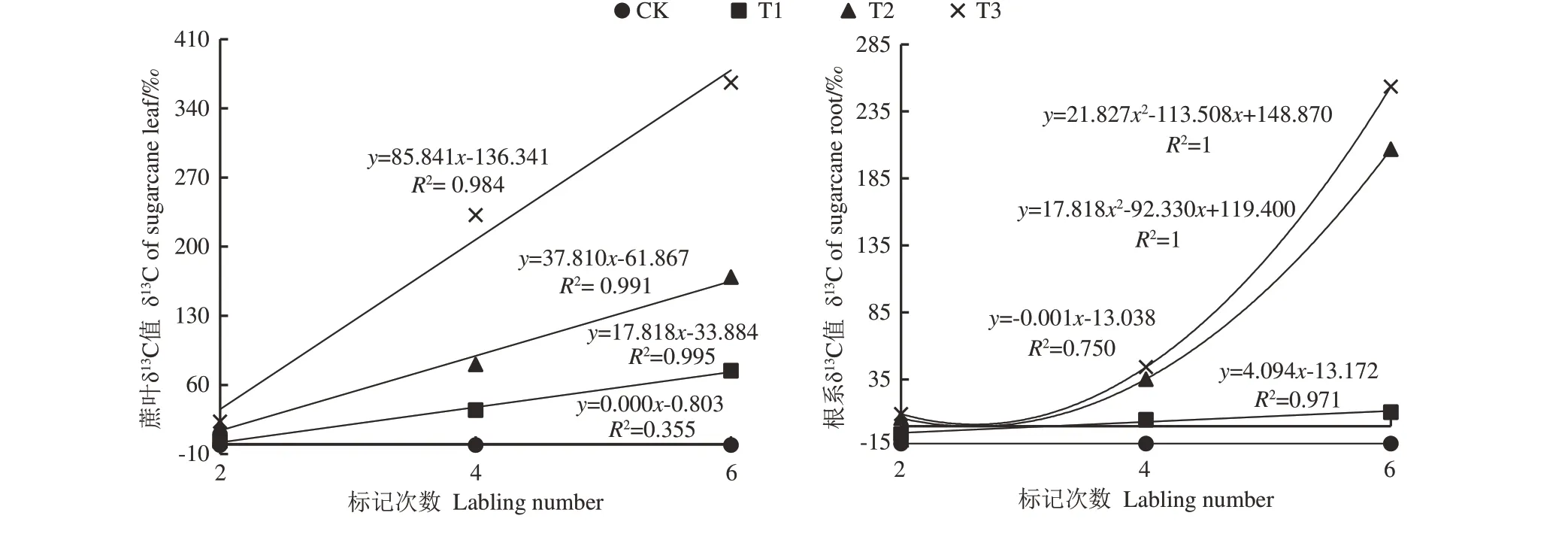
图2 不同处理下蔗叶与根系的δ13C动态变化Fig.2 The dynamic change of δ13C in sugarcane leaves and roots among different treatments
由图3可知,蔗叶和根系F值表现出与δ13C值同样的变化趋势。未标记的甘蔗蔗叶和根系的F值随着标记次数的增加无明显变化,其他Na213CO3标记浓度的甘蔗蔗叶F值随着标记次数的增加呈线性增加,且蔗叶F值增加速率随着Na213CO3标记浓度的增加而成倍增加,以T3处理增加速率最高,每标记1次,蔗叶F值平均约增加0.094%。根系F值在T1处理下随着标记次数的增加呈线性增加,每标记1次,根系F值平均约增加0.004%。在T2和T3处理下,根系F值与标记次数呈一元二次关系。标记6次后,蔗叶F值较CK增加了0.08~0.40个百分点,根系F值较CK增加了0.03~0.29个百分点。
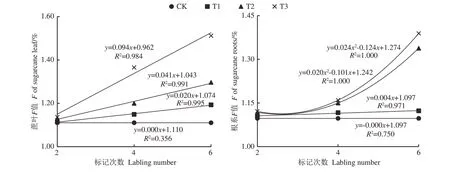
图3 不同处理下蔗叶与根系的F值动态变化Fig.3 The dynamic change of F in sugarcane leaves and roots among different treatments
2.3 不同13CO2浓度脉冲标记次数下的标记效率
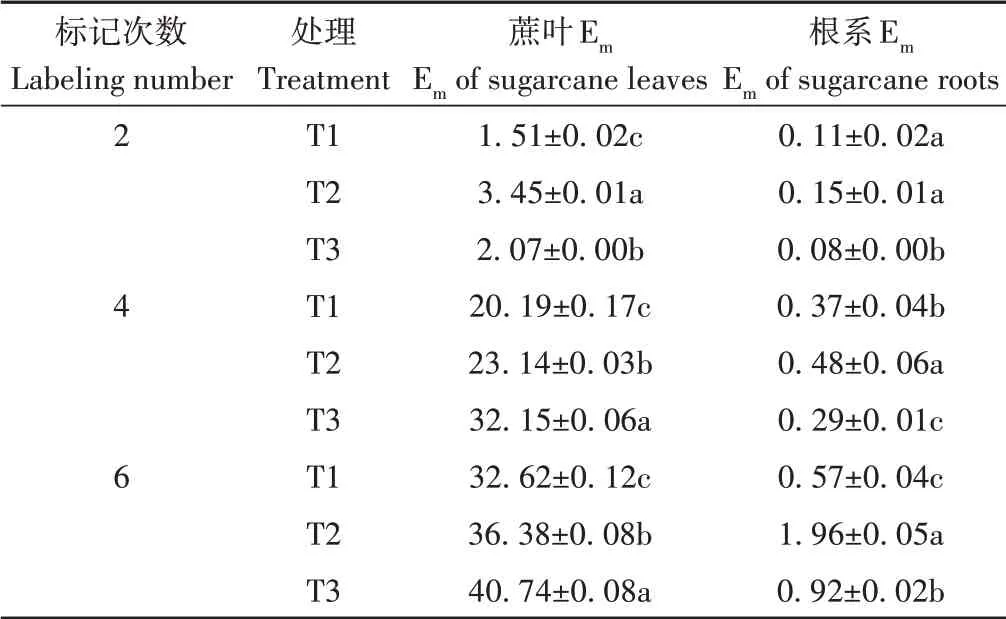
表3 不同13CO2脉冲标记次数下的标记效率Table 3 Labeling efficiency at different 13CO2 pulse labeling numbers /%
2.4 不同13CO2脉冲标记下蔗叶、根系中N、P、K含量变化
对蔗叶、根系中的N、P、K含量进行分析,有助于提升对13CO2脉冲标记下养分管理的认识。图4表明,13C标记蔗叶的N含量整体显著高于或相当于未标记蔗叶。P含量在标记4次后表现为T1和T2处理显著高于CK处理,而T3处理显著低于CK处理。13C标记蔗叶的K含量均显著高于未标记蔗叶,增幅为6.0%~31.8%。标记6次后,T1和T2处理蔗叶N、P、K含量无显著差异,但均显著高于T3处理。
图4还表明,标记4次后,除了T1处理的根系P含量显著高于CK处理外,标记根系的N、P、K含量均整体显著低于CK处理,其中N含量降幅为7.9%~32.9%,P含量降幅为0.9%~20.7%,K含量降幅为21.9%~47.9%。
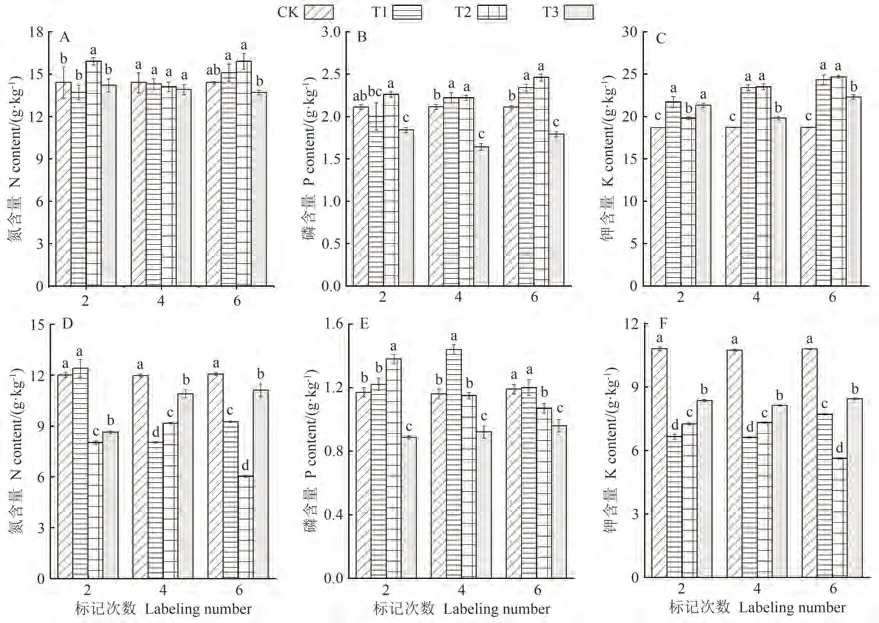
图4 不同处理下蔗叶与根系N、P、K含量变化Fig.4 The dynamic change of N, P and K in sugarcane leaves and roots among different treatments
将蔗叶N、P、K含量与根系N、P、K含量进行线性拟合(表4),结果表明,除了第4次标记的N含量外,蔗叶N、K含量与根系N、K含量均呈显著(P<0.05)或极显著(P<0.01)负相关,蔗叶P含量与根系P含量均呈显著(P<0.05)或极显著(P<0.01)正相关。
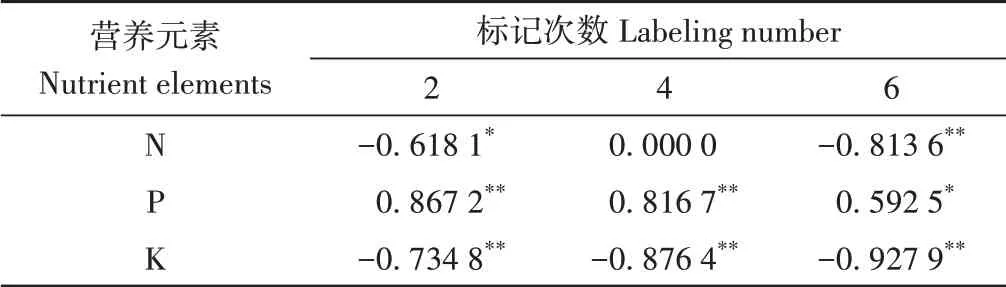
表4 蔗叶N、P、K含量与根系N、P、K含量的关系Table 4 Relationship between N, P and K content in sugarcane leaves and roots
3 讨论
3.1 甘蔗不同器官13C富集情况
前人研究发现,不同13CO2标记植物的13C富集存在较大差异,有的δ13C值处于较高水平,如安婷婷等[10]研 究 发 现13CO2标 记 后 玉 米 茎 和 叶δ13C值 达1 500‰,尹云锋等[8]研究发现13CO2标记后水稻叶片δ13C值达1 400‰,但杉木[15]、小麦与豌豆[16]、互花米草[17]等植物根、茎、叶的δ13C值在13CO2标记后仍较低,变化幅度在100.00‰~721.77‰之间,这可能是不同植物之间的差异造成的。前人研究还发现,叶部δ13C值大于根部[17-19],这可能与叶片作为光合器官,更易富集13C有关。本研究中,甘蔗经过6次13CO2脉冲标记后,蔗叶和根系δ13C值分别达到74.5‰~366.2‰和10.6‰~253.6‰,且蔗叶δ13C值大于根部δ13C值,这与前人研究结果一致[17-19]。
3.2 Na213CO3标记浓度、次数与甘蔗13C富集的关系
前人研究表明,CO2是作物光合作用的原料,作物13C富集量在很大程度上依赖于该作物生长期间的大气13C-CO2[20],Na213CO3标记浓度显著影响标记室内12CO2和13CO2的比例,进而影响作物13C的富集。本研究发现,随着Na213CO3标记浓度的增加,标记室内Na213CO3与HCl反应生产的δ13C-CO2呈线性增加,标记结束后,标记室内δ13C-CO2下降(表2),同时蔗叶和根系δ13C值均较未标记蔗叶和根系明显提高,且随Na213CO3标记浓度的增加而增加(图2),这表明,随着Na213CO3用量的逐渐增加,13C-CO2浓度的升高促进了甘蔗光合同化大气13CO2的比例,这与前人研究结果[20]一致。
本研究还发现,脉冲标记结束后的室内CO2浓度虽然下降至551.7~750.5 mg·m-3(表1),但甘蔗光合作用仍正常进行,随着标记次数的增加,T1、T2和T3处理蔗叶δ13C值分别以17.82‰∕次,37.81‰∕次和85.84‰∕次 的 速 率 增 加,F值 分 别 以0.02%∕次、0.041%∕次和0.094%∕次的速率增加。造成该结果的原因可能是甘蔗属于C4作物,具有较低的CO2补偿点(10 mg·m-3)[21],因此甘蔗在标记结束后仍具有较强的光合能力,且随着标记次数和Na213CO3标记浓度的增加,蔗叶δ13C值和F值的增加速率均相应增加。
3.3 Na213CO3标记浓度、次数与甘蔗标记效率的关系
前人对不同作物在不同13CO2脉冲标记时间下的标记效率已有较多研究,结果均表明随着标记时间的不断增加,作物13C标记效率呈先上升后下降的变化规律。如孙海岩等[22]在玉米苗期利用13C标记1 h后,玉米-土壤系统13C同化率达到76.8%,标记结束30 d后降至34.2%;Bai等[23]利用13CO2脉冲标记杨树的结果也表明,标记6 h后13C回收率为90%,21 d后降低至40%。本研究发现,每隔7 d进行1次标记,蔗叶和根系13C的标记效率均随Na213CO3标记次数的增加而增加(表3),其中蔗叶在标记14 d(2次)、28 d(4次)和42 d(6次)下的13C标记效率分别为1.51%~3.45%、20.19%~32.15%和32.62%~40.74%,这与上述研究结果相近。但甘蔗标记效率在多长标记时间后开始下降还需进一步研究。此外,杨树标记21 d[23]、园林植物标记21 d[24]和牧地植物标记30 d[25]后,13C标记效率处于下降水平,而本研究中甘蔗标记效率在42 d(6次)仍处于上升趋势,这可能是由于甘蔗是C4作物,具有较高的光合作用水平。
出于成本和标记效率考虑,Na213CO3的标记浓度和标记次数均应在满足作物13C丰度需求的前提下减少。沈其荣等[26]指出植物δ13C值相差一倍左右即可作为天然材料示踪天然碳周转动态。Weng等[5]利用δ13C值为16.6‰以上的蔗叶和蔗叶生物炭阐明了蔗叶和蔗叶生物炭还田下植物N吸收的来源,说明δ13C值为16‰以上的蔗叶材料即可满足研究的需求。本研究中,对比T1、T2和T3处理下蔗叶δ13C值的增加速率,在T1处理标记4次、Na213CO3总用量最少时即可满足蔗叶δ13C需求,但该处理下的蔗叶13C标记效率(20.19%)较低,因此,如何保证甘蔗低成本投入和13C标记高效率产出还需继续深入研究和探索。
3.4 13C标记与作物N、P、K含量变化的关系
N、P、K通过参与碳水化合物的代谢,直接或间接影响光合作用[20]。而大气CO2浓度升高带来的光合作用增强,或植物光合同化CO2过程中发生的同位素分馏也可能改变植物的生理代谢过程,进而影响植物体内的养分吸收与分配模式[27-28]。前人关于13C标记与作物N、P、K含量变化的关系还存在一定的争议。有研究表明植株δ13C值随叶片N、P、K含量的增加而升高[29]。但也有研究表明,13C标记前后植物N含量无明显变化[16]。本研究结果表明,13C标记蔗叶的N、K含量显著高于或相当于未标记蔗叶,标记4次后,P含量在T1和T2处理显著高于CK处理,这与洪凯等[30]在杉木上的研究结果一致。原因主要是标记引发的CO2短期加富提高了作物叶片净光合速率和光能利用效率,从而增强了植物对养分的吸收能力[30]。标记前后CO2以及13C-CO2的变化也进一步印证了13C标记增强了甘蔗的光合作用这一结果。标记4次后,除T1处理根系的P含量外,标记根系的N、P、K含量均整体显著低于未标记根系,N、P、K含量降幅分别为7.9%~32.9%、0.9%~20.7%、21.9%~47.9%。蔗叶与根系N、P、K含量关系进一步表明,除了第4次标记的N含量,蔗叶N、K含量与根系N、K含量均呈显著或极显著负相关,蔗叶P含量与根系P含量均呈显著或极显著正相关,说明13C标记促进了甘蔗根系N、K向蔗叶迁移。
4 结论
在密闭标记时间内,外源释放的13CO295%以上被甘蔗光合作用所利用。蔗叶δ13C值和F值随标记次数和Na213CO3标记浓度的增加而明显增加。总体来说,在甘蔗苗期,每隔7 d标记一次,每次采用0.32 g·m-3Na213CO3与HCl反应生成13CO2标记6 h,共标记4次即可获得经济适用的13C富集蔗叶。13C脉冲标记影响了甘蔗体内N、P、K的吸收与分配,促进了根系N、K向蔗叶迁移。

