番茄SlJAZ11的表达分析及互作蛋白的筛选与验证
高苗苗 郭鑫 朱寿松 黄思源 李建君 庞春娜 陈银华 , 于晓惠 ,
(1海南大学,海南省热带生物资源可持续利用重点实验室,海南 海口 570228;2海南大学热带作物学院,海南 海口 570228;3中国热带农业科学院热带生物技术研究所,海南 海口 571101)
茉莉酸(jasmonate acid,JA)参与植物信号传递,影响种子萌发、根系生长、向重力性、毛状体形成、胚胎发育、幼苗发育、块茎形成、叶片运动、果实成熟和叶片衰老等,还影响酚类化合物的积累[1]。此外,茉莉酸能与其他植物激素共同调节植物的生理过程,包括水杨酸(salicylic acid,SA)、赤霉素(gibberellin,GA)等[2]。茉莉酸除可调节植物生长发育外,还可改善和提高植物对胁迫环境的耐受性[3-4]。SA和JA信号之间的相互作用可以进一步调控植物防御反应,形成针对多种病原体的强大植物免疫系统[5]。
在茉莉酸途径中有3个重要的组分,分别是受体、抑制子和下游的转录因子。含ZIM 结构域的茉莉酸(jasmonate ZIM-domain,JAZ)是JA途径的抑制子,是下游转录因子MYC2的抑制剂和SCFCOI1(Skp1-Cul1-F-box proteinCORONATINEINSENSITIVE1)复合体的靶点[6]。JAZs是仅存在于植物中的TIFY超家族中的一个亚家族[7],含有3个保守结构域,分别为ZIM(Zinc-inflorescence meristem)、NT和JAS结构域[8-10]。已有研究表明,JAZ在番茄中有26个家族成员,拟南芥有13个、水稻有15个[11]、玉米有23个[12]。JAZ主要通过与下游不同的转录因子互作来实现不同的生理作用。当植物体内茉莉酸含量较低时,JAZ蛋白和其他共抑制子如转录共抑制因子(groucho∕tup1-type co-repressor,TPL)结合为组成型蛋白,与转录因子MYC2结合从而抑制早期茉莉酸应答基因的表达[13-15]。当植物受到外界胁迫时,体内茉莉酸含量上升,在JAR1酶的催化下与异亮氨酸(Ile)形成复合物茉莉酸-异亮氨酸(3R,7S-jasmonoic acid-isoleucine,JA-Ile),其 与 茉 莉 酸 的 受 体COI1(CORONATINE INSENSITIVE 1)结合后在复合物SCFCOI1作用下使JAZ蛋白泛素化,释放出MYC2,从而开始早期茉莉酸应答基因的转录过程。
番茄(Solanum lycopersicum)是我国重要的栽培蔬菜之一。随着番茄种植产业的不断发展与扩大,番茄种植过程中出现的问题越来越突出,特别是各种传染性病害已成为制约番茄产业发展的重要原因之一。据调查,在我国危害番茄的病害约有40多种,如烟草花叶病毒、青枯病、细菌性斑点病、白粉病等[16]。细菌性斑点病也称叶斑病,主要危害叶片,该病的致病病原菌为丁香假单胞菌番茄致病变种(Pseudomonas syringaepv.tomatoDC3000,PstDC3000)。PstDC3000常被用于研究病原菌与植物的互作[17],为揭示番茄和细菌之间的相互作用原理提供了便利。
在番茄中,目前已知有26个JAZ成员[11],其中SlJAZ11的功能研究相对较少,仅在衰老、非生物胁迫方面有相关报道[18]。现有研究表明,SIJAZs在不同程度上参与对PstDC3000侵染的早期响应,其中SlJAZ9∕10∕11在诱导后1 h表达量有显著性上调[19],说明SlJAZ11受到病原菌的强烈诱导。进一步探究SlJAZ11响应抗病相关激素以及病原菌胁迫的调控机制,对培育番茄抗病品种具有十分重要的意义。鉴于此,本研究以SlJAZ11为对象,探索其在抗病相关激素和PstDC3000诱导下的表达特征,并对SlJAZ11的互作蛋白进行筛选及验证,以期为阐明SlJAZ11的功能与作用机制奠定良好的分子基础。
1 材料与方法
1.1 试验材料
1.1.1 植物材料 本研究所用的野生型番茄品种AC(Solanum lycopersicMill.cv Ailsa Craig,AC)由海南省热带生物资源可持续利用重点实验室提供,种植于温室中,光照∕黑暗条件为16 h∕8 h,26 ℃。烟草为本氏烟由海南省热带生物资源可持续利用重点实验室提供,空气湿度70%,光照∕黑暗条件为14 h∕10 h,25 ℃。
1.1.2 菌株与载体 丁香假单胞菌番茄致病变种PstDC3000、酵母菌株AH109(NRR00030,Clontech,上海)、Y2H(MF2351,Clontech,上海)、大肠杆菌DH5α(DL1001S,唯地生物,上海),农杆菌GV3101(pSoupp19)(AC1001S,唯地生物,上海)。
酵母双 杂 交质粒pGADT7、pGBKT7、pGADT7-largeT、pGBKT7-p53、pGBKT7-laminC、pNC-BiFCENC、pNC-BiFC-ECC[20]和pCAMBIA1300-35S-GFP均由海南大学热带生物资源可持续利用生物重点实验室提供。
1.1.3 试剂与药品 主要药品与试剂:多糖多酚植物总RNA提取试剂盒(TIANGEN,北京),TRIzol试剂、限制性内切酶、反转录试剂盒(Thermo Fisher,美国),T4 DNA连接酶(EL0011,Invitrogen,上海),质粒小提试剂盒、琼脂糖凝胶纯化回收试剂盒、PCR产物回收试剂盒、2×A9 PCR MasteMix(艾德莱,北京),同源重组试剂盒(新赛美,苏州),引物由北京擎科生物科技有限公司合成(表1)。100 mg·L-1氨苄青霉素、100 mg·L-1庆大霉素、50 mg·L-1卡那抗生素、25 mg·L-1利福平均由学校平台莱博科技购入并保存。
所用溶液及培养基:酵母选择营养缺陷型培养基(minimal synthetical defined medium,SD)∕-Trp筛选培养基;SD∕-Leu∕-Trp固体和液体筛选培养基;SD∕-Trp+X-α-Gal(5-Bromo-4-chloro-3-indoxyl-α-D-galactopyranoside)(20 mg·L-1)+金担子素(aureobasidin A, AbA)固体筛选培养基;SD∕-Trp+X-α-Gal(20 mg·L-1)固体筛选培养基;硅酸盐细菌液体培养基(yeast peptone dextrose adenine medium,YPDA)液体和固体培养基;SD∕-Trp-Leu-His-Ade固体培养基;2×YPDA培养液;0.5×YPDA培养液;LB液体培养基;X-α-Gal(北京泛基诺科技公司)。
1.2 试验方法
1.2.1 SlJAZ11蛋白生物信息学分析 运用PSIPRED(http:∕∕bioinf.cs.ucl.ac.uk∕psipred)网站分析SlJAZ11蛋 白 的 二 级 结 构;通 过SWISS-MODEL(https:∕∕swissmodel.expasy.org∕interactive)网站预测其蛋白三级结构;应用NetPhos 3.1 Server 和 NetNGlyc 1.0 Server分别预测蛋白的磷酸化和糖基化位点;利用SignalP3.0 Server(http:∕∕www.cbs.dtu.dk∕services∕Signal P)在线工具预测信号肽;利用HMM方法(http:∕∕www.cbs.dtu.dk∕services∕TMHMM∕)对SlJAZ11的蛋白质跨膜区域进行预测。
1.2.2 SlJAZ11的亚细胞定位 构建植物表达载体pCAMBIA-35s-SlJAZ11-GFP,与空载pCAMBIA1300-35S-GFP分别转入农杆菌感受态GV3101中。挑选生长周期为30 d左右的烟草,将菌液(OD600值0.8)注射于适龄烟草叶片背面[21],注射过的植株于21 ℃左右培养48 h,在TCS SP8激光共聚焦显微镜(Lecia,德国)下观察注射过的区域有无荧光。
1.2.3 植物材料处理 选取生长期约为30 d且生长状态一致的约野生型番茄植株幼苗,采用2 mmol·L-1SA、100 µmol·L-1茉莉酸甲酯(methyl jasmonate,MeJA)以及OD600值0.2的PstDC3000喷施法处理番茄叶片背部,分别摘取0、0.25、0.5、1、2、4、6、12、24、48和72 h的番茄叶片,放置在-80 ℃条件下备用。
1.2.4 RNA的提取 经过处理后取下的番茄叶片经液氮速冻后用多糖多酚植物总RNA提取试剂盒提取其RNA,并反转录为cDNA。每个样品、每个时间点均设置3个生物学重复。
1.2.5 实时荧光定量PCR(quantitative real-time PCR,qRT-PCR) qRT-PCR程序按SYBR Premix Ex Taq TM(TaKaRa,北京)说明操作。Sltublin(Solyc10g086760)作为内参基因,通过2‒∆∆CT法[22]计算,结果利用GraphPad 6.02[23]软件绘图。
1.2.6 酵母双杂交载体构建 根据基因编码区(coding sequence,CDS)序列设计引物(表1),以野生型番茄AC的cDNA为模板,用高保真酶A9进行目的基因CDS序列的扩增。根据所选酶切位点,使用NEB公司限制性核酸内切酶,37 ℃、6 h条件下对载体和片段分别进行双酶切。纯化回收载体和目的片段,用T4连接酶连接,并转化大肠杆菌DH5α。37 ℃过夜培养后,挑取单菌落进行菌落PCR检测,阳性克隆送广州华大基因公司测序,获得目标载体。

表1 本研究所用引物Table 1 Primers used in this study
1.2.7 自激活检测 将pGBKT7-SlJAZ11、pGBKT7-SlENT质粒分别与pGADT7共转入酵母Y2H或AH109菌株,并涂布于SD∕-Trp∕-Leu缺陷培养基平板上,28 ℃恒温培养3~5 d;挑取SD∕-Trp∕-Leu平板上生长较好的酵母单菌落,28 ℃、240 r·min-1条件下过夜培养。阳性对照为pGBKT7-53+pGADT7-T,阴性对照为pGBKT7-Lam+pGADT7-T。分别将菌液稀释10×、100×、1 000×,滴在SD∕-Trp∕-Leu+X-a-Gal、SD∕-Trp、SD∕-Trp+X-a-Gal、SD∕-Trp+X-a-Gal+AbA或SD∕-Trp∕ -Leu、SD∕-Trp∕-Leu∕-His∕-Ade和SD∕-Trp∕-Leu∕-His∕ -Ade+X-a-Gal固体筛选培养基上,28 ℃条件下培养2~3 d,观察其是否有自激活。
1.2.8 cDNA文库筛选互作蛋白 用4~5 mL含有pGBKT7-SlJAZ11诱饵载体的酵母菌液和1 mL AD文库菌液混合,低转速培养出现三叶草形状结合子后,均匀涂于SD∕-Trp∕-Leu∕-His+ABA的缺陷型平板上,30 ℃培养7 d,将SD∕-Trp∕-Leu∕-His+AbA板上长势较好的单菌落 转 移 到筛 选 度 更强 的SD∕-Trp∕-Leu∕-His∕-Ade∕ +X-a-Gal平板上进一步筛选,随后将蓝色单克隆进行进一步的测序分析和点对点验证。挑取阳性酵母单菌落为模板,pGADT7通用引物进行PCR扩增,琼脂糖凝胶电泳检测。PCR产物送广州华大基因公司测序。测序结果在Phytozome(https:∕∕phytozome-next.jgi.doe.gov∕)进行BLAST序列比对,进一步明确这些基因的功能。
1.2.9 酵母双杂交验证 将候选蛋白构建至诱饵载体pGBKT7,按照上述方式验证其是否具有自激活活性,将pGBKT7-SlENT和pGBKT7-SlOOLG分 别 与pGADT7-SlJAZ11共转至酵母菌株AH109,涂布在SD∕-Trp∕-Leu平板上,30 ℃培养4 d后观察其生长情况。挑取平板上生长较好的酵母单菌落,28 ℃、240 r·min-1条件下过夜培养。阳性对照为pGBKT7-53+pGADT7-T,阴性对照为pGBKT7-Lam+pGADT7-T。分别将菌液稀释10×、100×、1 000×,滴在SD∕-Trp∕-Leu、SD∕-Trp∕ -Leu∕-His∕-Ade、SD∕-Trp∕-Leu∕-His∕-Ade+X-a-Gal固体培养基上,验证互作关系。
1.2.10 双分子荧光互补实验验证互作关系 采用你行(Nimble Cloning,NC)[22]克隆方法构建双分子荧光互补试验(bimolecular fluorescence complementation experiment,BiFC)载体(pNC-BiFC-ENC-SlJAZ11、pNCBiFC-ECC-SlENT),设计引物时采用Nimble Cloning通用引物设计原则,目标基因两端加上通用接头(上游接头5´-agtggtctctgtccagtcct-3´,5´-ggtctcagcagaccacaagt-3´)。使用高保真酶A9进行目的片段的扩增,将获得的PCR产物按照同源重组试剂盒说明书要求进行连接(50 ℃、30 min),取5 µL反应产物转化DH5α感受态细胞。37 ℃过夜培养后挑选单克隆进行菌落PCR验证,阳性克隆送广州华大基因公司测序验证。将含有目的基因的载体与空载分别转入农杆菌GV3101(pSoup-p19)中,挑取阳性单克隆至含有相应抗生素的LB培养基中28 ℃、200 r·min-1条件下摇菌至OD600为0.8,用侵染液[MgCl2+吗啉乙磺酸(MES monohydrate,MES)+乙酰丁香酮(acetosyringone,As)]清洗并悬浮农杆菌菌体。等体积混合两种含有不同质粒的菌液,室温静置2 h,将菌液注射于适龄(30 d)烟草叶片背面,注射过的植株于21 ℃左右培养48 h,在confocal显微镜下检测荧光信号。
2 结果与分析
2.1 SlJAZ11蛋白理化性质分析
利用PSIPRED和SWISS-MODEL在线网站分别对蛋白二级和三级结构进行分析,结果表明,SlJAZ11有5处螺旋结构,其中23.62% α-螺旋(Helix)、3.15% β-折叠(Sheet)、58.27%无规则卷曲(Coil)(图1-A、B);利用TMHMM在线软件预测SlJAZ11蛋白跨膜结构,结果表明SlJAZ11蛋白不存在跨膜结构域,是非分泌蛋白(图1-C);Signal IP网站预测结果显示该蛋白没有信号肽,不具备信号识别功能(图1-D);利用NetPhos在线网站预测SlJAZ11蛋白有14个磷酸化位点(丝氨酸13个、苏氨酸0个、酪氨酸1个)(图1-E);有3个糖基化位点(图1-F)。
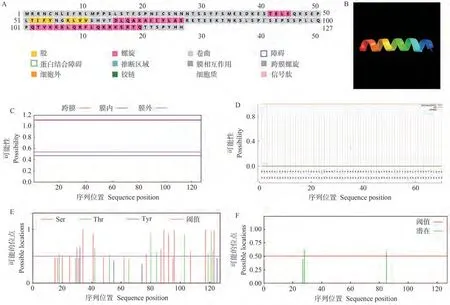
图1 SlJAZ11蛋白的生物信息学分析Fig.1 Bioinformatics analysis of SlJAZ11 protein
2.2 SlJAZ11的亚细胞定位
将重组质粒pCAMBIA1300-35S-SlJAZ11-GFP和空载质粒pCAMBIA1300-35S-GFP分别注射于烟草叶片背部,培养48 h后在激光共聚焦显微镜下观察荧光信号(图2)。红色荧光为细胞核定位荧光标记,绿色荧光为SlJAZ11-GFP融合蛋白发出的荧光。结果表明,转入空载质粒的对照组烟草表皮细胞中均分布较强的绿色荧光信号;而融合蛋白的荧光信号分布于细胞核和细胞膜中,并且红色荧光与绿色荧光基本重合,呈现出黄色和绿色的光,由此可知SlJAZ11蛋白定位于细胞核和细胞膜。
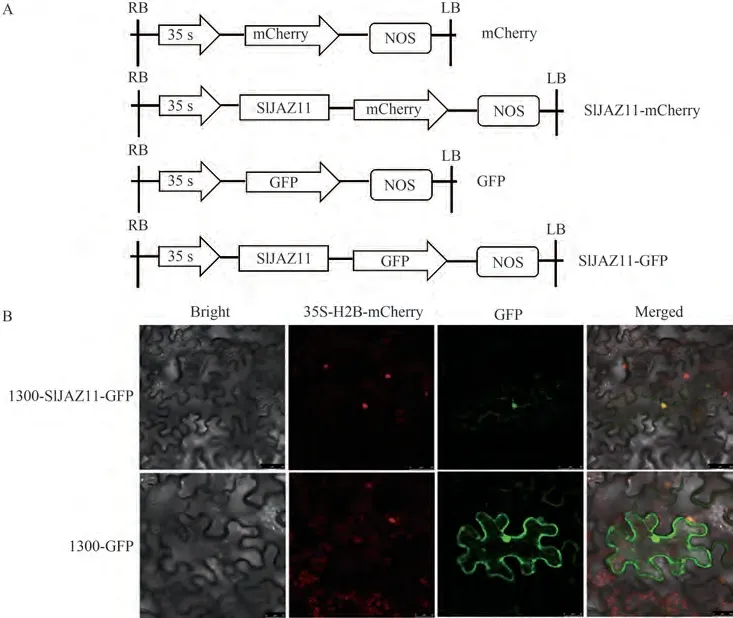
图2 SlJAZ11亚细胞定位分析Fig.2 SlJAZ11 subcellular localization analysis
2.3 JA、SA和DC3000诱导下的SlJAZ11表达量分析
茉莉酸(JA)、水杨酸(SA)、丁香假单胞菌(PstDC3000)等激素和病原菌、环境在植物应对各种胁迫过程中发挥着重要的调节作用。利用MeJA、SA、PstDC3000处理番茄叶片,通过qRT-PCR技术分析SlJAZ11基因的表达水平变化,结果如图3所示。在MeJA、SA、PstDC3000处理下,0.5 h后SlJAZ11基因的表达量均有显著上调,为0 h表达量的200倍左右。在PstDC3000侵染的不同时间点的叶片中,SlJAZ11基因的转录水平呈先上升后下降再上升的变化趋势。MeJA和SA诱导后SlJAZ11基因的表达趋势基本一致,SA处理后6 h后表达量有明显的上调,约为0 h表达量的400倍。初步说明SlJAZ11能响应MeJA、SA和PstDC3000诱导的途径,能够被抗病相关激素(MeJA、SA)、病原菌(PstDC3000)所诱导。
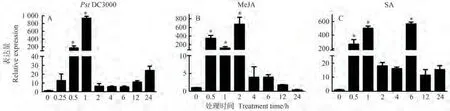
图3 JA、SA和DC3000诱导下SlJAZ11表达分析Fig.3 Expression analysis of SlJAZ11 induced by JA, SA and DC3000
2.4 SlJAZ11酵母双杂交载体构建
本研究采用酵母双杂交技术筛选与SlJAZ11互作的蛋白。以野生型番茄AC的cDNA为模板,根据番茄SlJAZ11基因编码区引物扩增得到一条384 bp的目的片段,随后进行酶切、连接和菌落PCR。由图4可知,电泳特异性强,与预期结果一致。菌落PCR检测的阳性克隆送广州华大基因公司测序,获得载体pGBKT7-SlJAZ11和pGADT7-SlJAZ11。
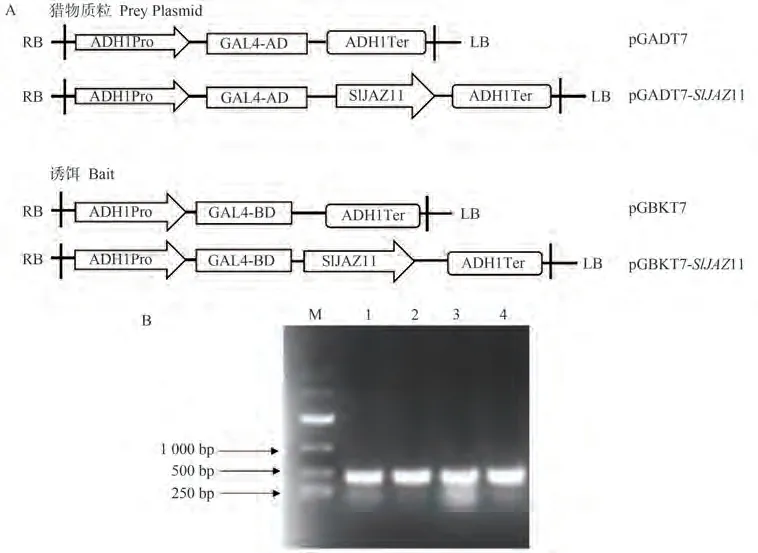
图4 SlJAZ11酵母双杂交载体构建Fig.4 SlJAZ11 yeast two-hybrid vector construction
2.5 SlJAZ11自激活检测
将测序成功的载体pGBKT7-SlJAZ11与pGADT7空载共转入酵母菌株Y2H中,然后涂布于SD∕-Trp∕ -Leu平板上,28 ℃倒置培养2~3 d后挑取单克隆摇菌点板,结果如图5所示。阳性对照(pGBKT7-53+pGADT7-T),阴性对照(pGBKT7-Lam+pGADT7-T)在SD∕-Trp∕ -Leu+X-a-Gal平板上均存在克隆(阳性对照为蓝色克隆,阴性对照为白色克隆),BD-空载(pGBKT7)和pGBKT7-SlJAZ11在SD∕-Trp,SD∕-Trp+X-a-Gal,SD∕ -Trp+X-a-Gal+AbA存在克隆,且克隆颜色为白色。说明SlJAZ11不存在自激活现象,可进行后续筛选试验。
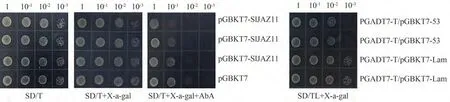
图5 SlJAZ11自激活检测Fig.5 SlJAZ11 self-activation detection
2.6 cDNA文库筛选互作蛋白
利用番茄cDNA文库筛选与SlJAZ11互作的蛋白,通过计算1 000×DDO平板的单克隆数得出AD文库转化效 率>2×107cell·mL,共有100个 单菌 落可 在SD∕ -Trp∕-Leu∕-His+AbA上长出,将长势较好的单菌落转移到筛选度更强的SD∕-Trp∕-Leu∕-His∕-Ade+X-a-Gal平板上,共有40个单菌落变蓝。测序结果共得到14个可能与SlJAZ11相互作用的蛋白(表2),其中包括与温度相关的热休克蛋白(heat shock protein,HSP)[1],与活性氧产生相关的胚芽素样蛋白亚家族3成员(oxalate oxidase-like germin 171,OOLG),调控HSP40的分子伴侣蛋白(chaperone protein dnaJ,CPD)[24],与植物免疫相关的含有EMSY-N终端结构域的蛋白(EMSY N TERMINUS,ENT)[25]等,涉及多种生化过程。说明SlJAZ11可能参与调控多个复杂的通路。选择SlOOLG和SlENT来探究SlJAZ11在抗病过程中可能的调控通路,构建酵母双杂交载体,并对其与SlJAZ11的互作关系进行进一步研究。
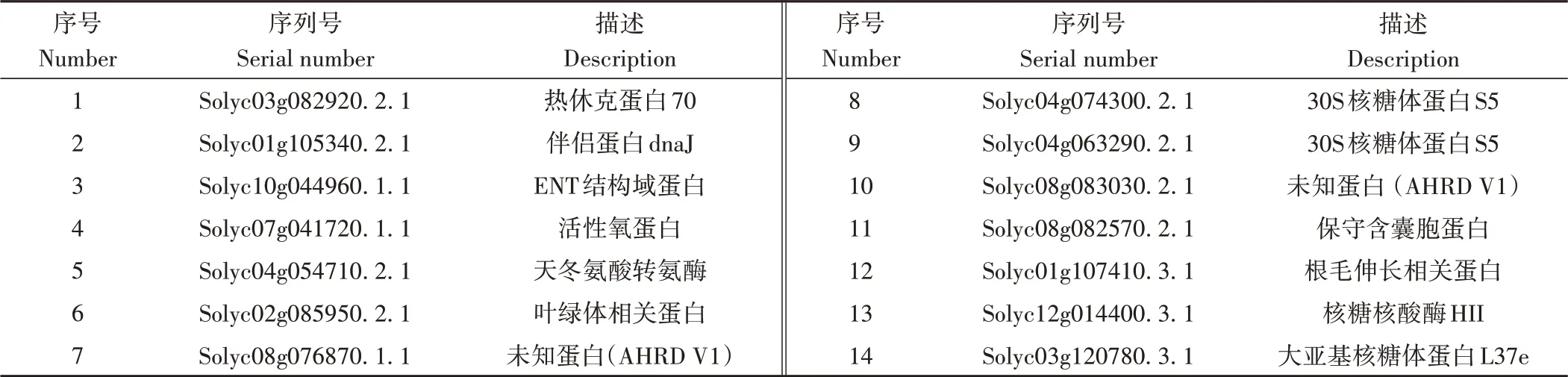
表2 酵母双杂交文库筛选出与SlJAZ11互作的蛋白Table 2 Yeast two-hybrid cDNA library screening for possible interactiong proteins of SlJAZ11
2.7 酵母双杂交点对点验证
分别将SlENT和SlOOLG进行自激活和点对点验证来进一步确认SlJAZ11与SlENT和SlOOLG之间的互作关系。
2.7.1 自激活检测 将测序成功的载体pGBKT7-SlENT和pGBKT7-SlOOLG与pGADT7空载共转入酵母菌株AH109中,检测SlENT和SlOOLG是否具有自激活活性,结果如图6所示。阳性对照(pGBKT7-53+pGADT7-T)和阴性对照(pGBKT7-Lam+pGADT7-T)在SD∕-Trp∕-Leu平 板 上 均 有 白 色 克 隆,在SD∕-Trp∕ -Leu∕-His∕-Ade,SD∕-Trp∕-Leu∕-His∕-Ade∕+X-a-Gal固体培养基只有阳性对照存在克隆且变蓝,而试验组(pGBKT7-SlENT和pGBKT7-SlOOLG)只 有 在SD∕ -Trp∕-Leu上有 克 隆,SD∕-Trp∕-Leu∕-His∕-Ade,SD∕-Trp∕ -Leu∕-His∕-Ade∕+X-a-Gal未存在克隆,说明SlENT和SlOOLG不具有自激活活性,可以进行后续的酵母双杂交试验。

图6 SlENT和SlOOLG自激活检测Fig.6 SlENT and SlOOLG self-activation assay
2.7.2 SlENT与SlJAZ11点对点验证 利用酵母双杂交技术对候选蛋白与SlJAZ11进行互作验证,结果如图所示(图7)。阳性对照(pGBKT7-53+pGADT7-T)和阴性对照(pGBKT7-Lam+pGADT7-T)在SD∕-Trp∕-Leu上均有白色克隆,且在SD∕-Trp∕-Leu∕-His∕-Ade,SD∕ -Trp∕-Leu∕-His∕-Ade∕+X-a-Gal固体培养基上只有阳性对照存在克隆且变蓝。而试验组(AD-SlJAZ11∕ BD-SlOOLG和AD-SlOOLG∕BD-SlJAZ11)只 有 在SD∕-Trp∕ -Leu上有白色克隆,在SD∕-Trp∕-Leu∕-His∕-Ade,SD∕-Trp∕-Leu∕-His∕-Ade∕+X-a-Gal固体培养基上与阴性对照一致。试验组(AD-SlJAZ11∕BD-SlENT)在SD∕-Trp∕-Leu,SD∕-Trp∕-Leu∕-His∕-Ade,SD∕-Trp∕-Leu∕-His∕-Ade∕+X-a-Gal上均存在克隆且在SD∕-Trp∕-Leu∕-His∕ -Ade∕+X-a-Gal固体培养基上变蓝。试验结果初步说明SlENT与SlJAZ11存在互作关系。
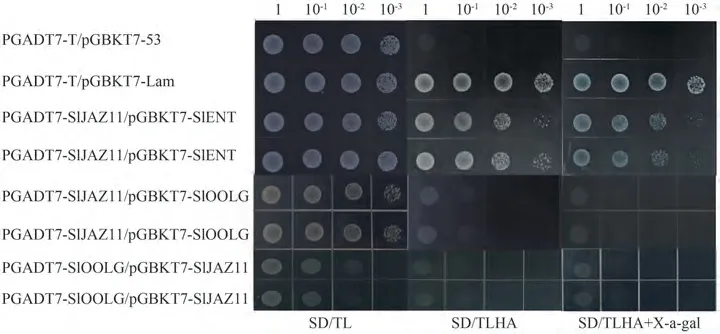
图7 SlJAZ11与SlENT或SlOOLG点对点验证互作Fig.7 Identification of the interaction between SlJAZ11 and SlENT or SlOOLG by point-to-point assay
2.8 SlENT与SlJAZ11双分子荧光互补(bimolecular fluorescene complementation, BIFC)验证
酵母双杂交存在一定的假阳性可能,因此进一步通过BIFC验证SlENT与SlJAZ11的互作关系,利用Nimble Cloning构 建BIFC载 体pNC-ENC-SlJAZ11和pNC-ECC-SlENT,分别转化农杆菌GV3101(pSoupp19),将含有两个载体的菌液1∶1混匀后,注射到适龄的烟草中,48 h后显微观察(图8)。由结果可知,阴性对照(cEYFP+nEYFP∕SlJAZ11-nEYFP+cEYFP)没有检测到荧光信号,试验组(SlJAZ11-nEYFP+SlENT-cEYFP)可以看到黄色荧光信号,并且荧光信号存在于细胞核中,证明SlJAZ11和SlENT存在互作关系。
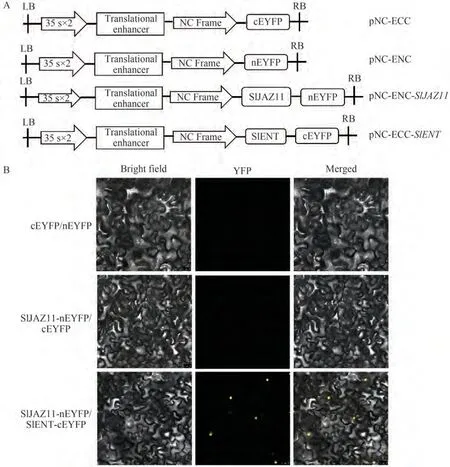
图8 BiFC验证SlJAZ11和 SlENT互作关系Fig.8 BiFC assays for identifying the interaction between SlJAZ11 and SlENT
2.9 SlENT蛋白的生物信息学分析
利用PSIPRED和SWISS-MODEL在线网站分别对蛋白二级和三级结构进行分析,结果表明,三级结构以1utu.1.B为 原 型SlENT有17处 螺 旋 结 构,其 中26.85% α-螺旋(Helix)、4.63% β-折叠(Sheet)、65.65%无规则卷曲(Coil)(图9-A、B);利用TMHMM在线软件预测SlENT蛋白跨膜结构,结果表明SlENT蛋白不存在跨膜结构域,是非分泌蛋白(图9-C);Signal IP 网站预测结果显示该蛋白没有信号肽,不具备信号识别功能(图9-D);利用NetPhos在线网站预测SlENT蛋白有37个磷酸化位点(丝氨酸28个、苏氨酸7个、酪氨酸2个)(图9-E);有1个糖基化位点(图9-F)。
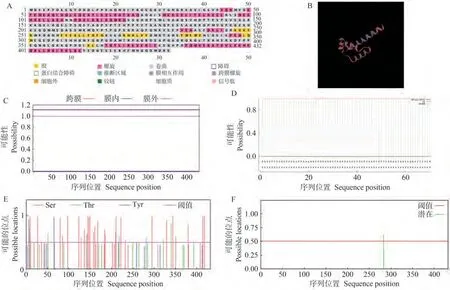
图9 SlENT蛋白的生物信息学分析Fig.9 Bioinformatics analysis of SlENT protein
2.1 0 JA、SA和DC3000诱导下SlENT表达分析
前人研究表明,ENT参与了植物的免疫[25],本试验对其在PstDC3000、MeJA、SA处理下的表达情况进行分析,初步探究SlENT的生物学功能,发现除2 h,SlENT被PstDC3000显著诱导下调表达,且在0.25 h和4 h下调最为明显;SlENT被JA诱导上调表达,且在6 h时上调最为显著;而在SA处理后,SlENT的表达变化不明显,仅在1 h时显著下调表达。初步证明SlENT基因响应MeJA的诱导,能被SA和PstDC3000显著抑制(图10)。
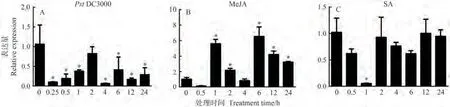
图10 JA、SA和DC3000诱导下SlENT表达量分析Fig.10 Expression analysis of SlENT under biotic and abiotic stresses
3 讨论
JAZ属于茉莉酸信号途径的抑制子,因其ZIM结构域中的保守序列TIFYXG而被命名[26]。茉莉酸ZIM结构域(JAZ)抑制子通过负调节茉莉酸盐的信号转导,从而调节植物发育和免疫力。在植物的生长发育过程中,JAZ主要通过与不同的转录因子互作来实现不同的生理作用,JAZ1和JAZ4可以与ICE1互作,可以调控植物的抗寒性[27]。研究表明,JAZ和DELLA的互作可以解除对MYC2和PIF5的抑制,从而激活下游基因的表达,促进植物下胚轴的生长,同时还能增强根对茉莉酸的耐受性,提高植物的抗性[21]。还有研究表明,拟南芥中存在1个ENT基因家族AtEML(AtEML1、AtEML2、AtEML3和AtEML4)。AtEML1和AtEML2和AtEML4有 助 于RPP7介 导 的 植 物 免 疫[25]。目 前SlJAZ11在衰老和非生物胁迫中的研究较多[18],但目前鲜有关于SlJAZ11抗病的报道。本研究结果显示,SlJAZ11和SlENT存在互作关系,通过蛋白序列比对发现,SlENT与AtENT两者同源性较高,推测SlJAZ11可能通过与SlENT互作来调节植物免疫。
JA和SA是植物防御和发育所必需的激素[28],PstDC3000携带大量潜在毒力因子,其结构类似于植物激素茉莉酸[29]。Du等[30]和Pauwels等[31]研究发现外源喷施JA后能够促进JAZ1、JAZ2、JAZ3、JAZ5、JAZ6基因的表达,认为JA激素能够诱导JAZs基因的表达。Ryan等[32]根据JA反应的表达时间,将相关的防御基因分为“早期”基因和“晚期”基因。本试验结果表明,MeJA喷施后SlJAZ11和SlENT表达水平在早期呈显著上调趋势,与上述前人研究结果一致,说明SlJAZ11和SlENT基因响应JA的早期调控。SlJAZ11和SlENT在MeJA的作用下表达水平均上调,因此猜测SlJAZ11和SlENT基因可能在JA信号调控的植物免疫反应中发挥作用。
本研究结果表明,SA喷施后SlJAZ11基因的表达量呈先上升后下降再上升的趋势,从整体表达水平上看,SlJAZ11的表达量升高,表明该基因的表达受到SA的诱导;也发现在PstDC3000处理后,SlJAZ11表达水平呈显著上调趋势;在PstDC3000和SA处理后SlENT表达量被抑制。一般情况下,SA和JA信号通路出现相互拮抗的作用[33],在本研究中SA、JA处理后SlJAZ11相对表达水平变化趋势相反证实了SA与JA间的拮抗关系,SlENT验证了SA与JA间的拮抗关系。SlJAZ11对PstDC3000敏感,而SlENT对PstDC3000不敏感,说明SlJAZ11和SlENT影响Pst DC3000侵染的信号途径有差异。目前尚不明确SlJAZ11能否与其互作蛋白SlENT共同调控植物的免疫性,后续工作可以利用免疫共沉淀技术进一步阐明SlJAZ11和SlENT之间的互作关系,以明确SlJAZ11和SlENT在植物免疫过程中的功能,为进一步阐明SlJAZ11功能研究奠定基础。
4 结论
本研究通过烟草亚细胞定位分析发现,SlJAZ11在细胞膜和细胞核中均有表达,说明SlJAZ11能在细胞膜和细胞核中发挥功能。对野生型番茄植株进行抗病相关激素(MeJA、SA)和病原菌(Pst DC3000)处理后,发现SlJAZ11能响应MeJA、SA和Pst DC3000的诱导,且其互作蛋白SlENT也能响应MeJA的诱导。通过酵母双杂交技术,筛选到14个可能与SlJAZ11互作的候选蛋白,点对点验证SlJAZ11与SlENT之间存在互作。进一步通过双分子荧光互补技术,证明SlJAZ11和SlENT存在互作关系。

