陆地棉小GTP结合蛋白基因GhROP6的克隆及表达初步分析
胡子曜 雷建峰 程贯富 刘 超 代培红 孙博洋 马海洋 李 月,
(1新疆农业大学生命科学学院,新疆 乌鲁木齐 830052;2新疆农业大学农学院∕教育部棉花工程研究中心∕农业生物技术重点实验室,新疆 乌鲁木齐 830052)
小G蛋白是一类与异源三聚体G蛋白的α亚基偶联的单体鸟苷酸结合蛋白,其分子量在21~30 kDa之间,属于Ras超家族,通过自身独特的调节方式,在细胞信号转导过程中发挥着关键作用[1]。根据其结构与功能的差异性可分为5个家族:Rho、Ras、Arf∕Sar、Ran及Rab,这5个家族在调控细胞生命活动中发挥着不同的功能[2]。植物特异的Rho GTP酶(Rho-related GTPase of plants,ROP)蛋白是植物所特有的一种Rho类小G蛋白,又称植物Rac蛋白,通过与三磷酸鸟苷(guanosine triphosphate,GTP)结合(激活态)和与二磷酸鸟苷(guanosine diphosphate,GDP)结合(非激活态)过程中构象的变化,以“分子开关”的形式参与细胞内多项生命活动的调节[3]。在结构上,ROP蛋白含有5个GTP∕GDP结合位点(G1~G5),其中G1~G3具有GTP酶活性,是GTP水解区域,同时也是磷酸化和Mg2+结合区域;G4和G5是由9~11个氨基酸组成的Rho结构域,可能与下游信号传导有关,是GTP结合区域;此外还含有1个Rho插入序列和1个C末端多变区[4]。Winge等[5]根据拟南芥ROP蛋白的同源性及C末端多变区的差异将其分为Ⅰ型和Ⅱ型,Ⅰ型包含AtROP1~AtROP8,Ⅱ型包含AtROP9~AtROP11。
1993年Yang等[6]从豌豆中克隆出第一个ROP基因,此后越来越多的ROP基因在植物中被发掘、鉴定,目前已在玉米(Zea mays)、番茄(Solanum lycopersicum)、拟南芥(Arabidopsis thaliana)、葡萄(Vitis vinifera)、水稻(Oryza sativa)、烟草(Nicotiana tabacum)、沉香(Aquilariae Lignum Resinatum)、辣椒(Capsicum annuum)、大麦(Hordeum vulgare)、大豆(Glycine max)等多种植物中克隆出ROP基因[7]。功能研究发现,ROP基因参与植物细胞的形态结构、生长和分裂、亚细胞定位、mRNA转运、蛋白质翻译及生长素(3-indoleacetic acid,IAA)和脱落酸(abscisic acid,ABA)激素应答反应等多种生命活动的调控[7];此外,ROP基因同样参与植物对逆境胁迫的应激反应:马铃薯(Solanum tuberosum)ROP基因通过介导过氧化氢(H2O2)的积累正向调控对疫霉病菌的抗性[8];小麦(Triticum aestivumL.)TaROP10蛋白通过与TaTrxh9蛋白互作,负调控小麦抗条锈病反应[9];干涉MtROP9基因表达可增强苜蓿(Medicago falcata)对根瘤菌的敏感性[10];枇杷(Eriobotrya japonica)ROP基因的转录本受低温诱导,可能参与耐寒反应[11];低温同样诱导苹果(Malus pumila)ROP基因表达,导致其果实中活性氧(reactive oxygen species,ROS)和乙烯(ethylene,ET)含量显著降低[12];香蕉(Musa paradisiaca)MaROP5g基因的过表达通过上调耐盐相关基因(SOS1、SOS2和SOS3)及钙信号通路蛋白基因(CBL、CIPK和CDPK)的表达,增强了植株的耐盐性[13];拟南芥(Arabidopsis thaliana)AtROP11基因介导ABA调控气孔开闭及干旱胁迫反应[14];茶树(Camellia sinensis)ROP基因CsRAC1的超表达减弱了转基因拟南芥对盐胁迫及苗期对干旱胁迫的抗性,但增强了成株拟南芥的耐旱性,表明ROP基因对植物抵御不同非生物胁迫反应的调控方式存在一定的差异[15]。
棉花(Gossypiumhirsutum)是我国重要的经济作物,同时也是重要的农产品和战略物资,在国民经济中占有重要地位。但作为固着生物,棉花在生长过程中会遭受多种逆境胁迫,其中干旱、高盐和极端温度等非生物胁迫日渐成为影响棉花生长、制约棉花产量及纤维品质的重要因素[16]。目前关于ROP基因在棉花抗逆反应中的功能研究相对较少。因此,本研究利用同源克隆的方法获得1个棉花ROP基因GhROP6,利用实时荧光定量(quantification real-time PCR,qRT-PCR)技术探究其在棉花不同组织及不同非生物逆境和外源激素处理下的表达模式,同时构建该基因的病毒介导的基因沉默(virus-induced gene silencing,VIGS)载体并获得沉默植株,以期为进一步探究该基因的生物学功能提供材料。
1 材料与方法
1.1 试验材料
陆地棉(Gossypium hirsutum)新陆早26的种子及农杆菌菌株GV3101均由新疆农业大学生命科学学院农业生物技术重点实验室保存;VIGS载体TRV∶ RNA1、TRV∶RNA2、TRV∶GhCLA1均由新疆农业科学院核技术生物技术研究所黄全生教授馈赠。
Trans-T1大肠杆菌感受态细胞、高保真DNA聚合酶、T4 DNA连接酶、克隆载体pEASY Blunt-Zero、DNA Marker均购于北京全式金公司;琼脂糖凝胶回收试剂盒、RNase A及质粒小提试剂盒均购于南京诺维赞公司;植物多糖多酚总RNA提取试剂盒购于杭州博日公司;qRT-PCR及反转录试剂盒购于加拿大爱必梦公司;抗生素及脱落酸(ABA)、生长素(IAA)、2-吗啉乙磺酸(2-morpholinoethanesulfonicacid,MES)、乙酰丁香酮(acetosyringone,AS)等均购于北京索莱宝公司;XbaⅠ和KpnⅠ限制性内切酶购于美国赛默飞公司;PCR所用引物的合成及DNA测序均由上海杰李公司完成。
1.2 试验方法
1.2.1 棉花种植及胁迫处理 选取颗粒饱满、大小一致的新陆早26种子,经浓硫酸脱绒后,参照Zhao等[17]的方法进行种植、培育及胁迫处理。待其长至第二片真叶完全展开时,挑取生长状态一致的棉苗,将其根部土壤用清水洗净后,进行干旱(15% PEG 6000)、高盐(200 mmol·L-1NaCl)、低温(4 ℃)及高温(37 ℃)胁迫处理,干旱和高盐的对照组均为水处理,高低温的对照组均为室温(25 ℃)处理;取处理前(0 h)及胁迫处理后和相应对照组1、3、6、12和24 h等时间段的棉花真叶组织,用于不同胁迫处理下的表达模式分析;参照Ni等[18]和Yu等[19]的方法进行外源激素(100 µmol·L-1的ABA和IAA)处理,对照组为加入微量无水乙醇的水溶液,分别于处理前(0 h)及处理后3、6、9和12 h对棉株真叶进行取样,用于不同激素处理下的表达模式分析;同时对未处理棉花幼苗的根部、茎部、真叶和子叶等组织进行取样,用于不同组织表达模式分析。上述取样均取3组不同重复,每组取3株样本,用于后续试验。
1.2.2GhROP6基因的克隆 根据拟南芥AtROP1(AT2G17800)基因序列,在棉花基因组数据库(http:∕∕www.phytozome.net)中进行blast比对,获得1个棉花ROP基因,将其命名为GhROP6,并在基因文库(gene bank)中为其申请检索号;根据该基因的CDS(coding sequence)序列设计相应克隆引物(表2),以新陆早26的叶片cDNA为模板,参照胡子曜等[20]的方法,利用PCR技术进行特异性扩增,回收目的片段进行克隆及测序。
1.2.3GhROP6基因生物信息学分析 在线生物信息学分析工具参见表1;利用DNAMAN软件进行多重序列比对,同时选取拟南芥AtROP1(NP_190698.1)、AtROP3(NP_179371.1)、AtROP6(NP_195228.1)、AtROP9(NP_194624.1)、AtROP10(NP_566897.1)和AtROP11(NP_201093.1),烟草NtROP9(CAA10815.2),水稻OsRac1(XP_015621645.1),玉米ZmROP1(XP_008644256.1),大 麦HvRac1(CAD57743.1),香 蕉MaROP1(ABQ15204.1),辣椒CaROP1(ABB71820.1)及枇杷EjROP1(ACM68949.1),利用MEGA7软件采用邻接法进行系统进化树分析,采用Bootstrap检验各分支的可靠性。
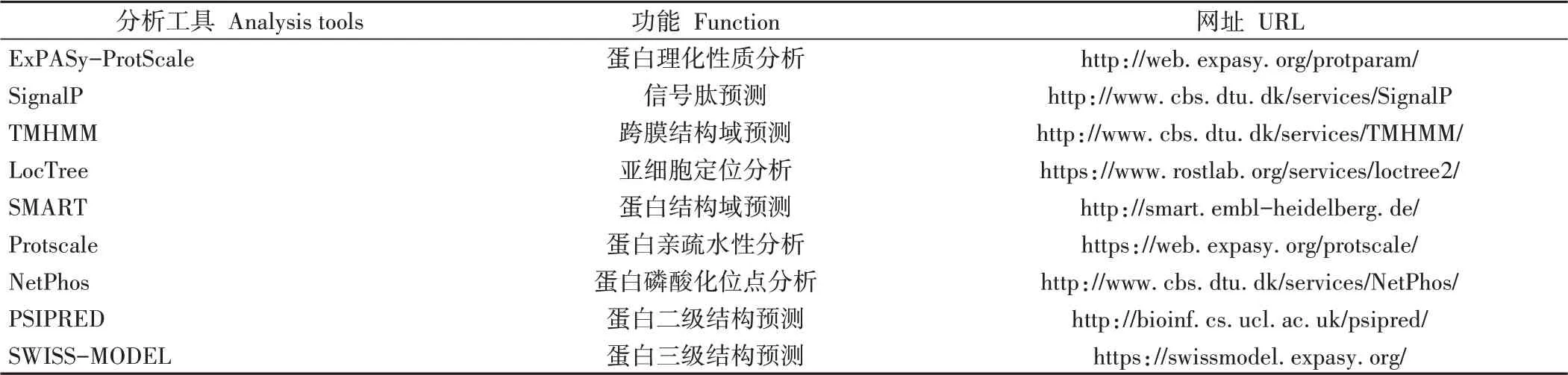
表1 生物信息学分析工具Table 1 Bioinformatics analysis tools and corresponding functions
1.2.4GhROP6基因的表达模式分析 将1.2.1所取样品用液氮研磨成白色粉末状态,利用植物多糖多酚总RNA提取试剂盒进行RNA提取;使用反转录试剂盒进行cDNA合成。以cDNA为模板,选取棉花多聚泛素酶基因GhUBQ7为内参,参照胡子曜等[20]的反应体系及程序进行qRT-PCR,每个样本均设3组技术重复。反应结束后根据基因的Ct值,使用2-ΔΔCt方法计算其表达量。相关引物见表2。
1.2.5GhROP6基因的VIGS载体构建 根据GhROP6基因的CDS序列,利用在线软件SGN-VIGS(https:∕∕vigs.solgenomics.net∕)设计特异性沉默靶序列,设计合适的特异性引物并在其上、下游5´端分别加入XbaⅠ和KpnⅠ的酶切位点(表2),以陆地棉新陆早26真叶的cDNA为模板,克隆目的片段,方法同1.2.3;将测序正确的重组质粒及VIGS载体TRV2用XbaⅠ和KpnⅠ进行酶切回收,T4连接酶连接4~5 h后转化大肠杆菌Trans-T1感受态细胞并进行双酶切鉴定,取10~15 µL重组质粒转化农杆菌GV3101感受态细胞,用于后续试验。
1.2.6 VIGS侵染及沉默效率检测 选取叶绿素合成相关基因GhCLA1作为阳性对照,检验TRV-VIGS技术体系。将TRV∶RNA1、TRV∶RNA2、TRV∶GhCLA1和TRV∶GhROP6等载体转化农杆菌后,参照Li等[21]的方法进行菌液的活化、重悬及侵染棉花。待棉花幼苗生长至两片子叶完全展开且真叶刚露尖时,利用注射法进行侵染。将包含TRV∶GhROP6和TRV∶RNA1、TRV∶GhCLA1和TRV∶RNA1、TRV∶RNA2和TRV∶RNA1的重悬菌液所侵染的棉株分别作为试验组TRV∷GhROP6、阳性对照TRV∷GhCLA1和阴性对照TRV∷00。侵染大约16 d,当阳性对照TRV∷GhCLA1出现叶绿素缺失的白化表型时,对TRV∷00、TRV∷GhCLA1和TRV∷GhROP6植株第二片真叶及根部进行取样并进行RNA提取及cDNA合成,利用qRT-PCR技术检测相关基因的沉默效率,体系、程序同1.2.4。每个样本均取3个技术重复。相关引物见表2。

表2 引物及用途Table 2 Primer and application
2 结果与分析
2.1 GhROP6基因的克隆及生物信息学分析
利用PCR技术进行扩增,得到产物大小为597 bp,符合预期(图1-A),测序结果与目标序列完全相符,表明已成功克隆出GhROP6基因的CDS序列;在基因文库为其申请检索号:MK955932。生物信息学分析结果显示,GhROP6基因的开放阅读框(open reading frame,ORF)为597 bp,编码198个氨基酸,分子式为C988H1575N263O284S6,相对分子质量为21.87 kDa。理化性质分析显示(表3),GhROP6蛋白均定位于细胞膜,无信号肽,属于碱性、亲水性、非跨膜蛋白;蛋白结构域预测显示该蛋白含有一个RHO结构域(图1-B)。磷酸化位点分析结果显示,该蛋白分别含有14个丝氨酸(Ser)、12个苏氨酸(Thr)和7个酪氨酸(Tyr)的磷酸化位点(图2)。二级结构预测结果显示该蛋白含有5个α螺旋和8个β折叠,三级结构预测结果完全符合二级结构特征(图3-A、B)。多序列比对结果显示,该蛋白含有5个GTP∕GDP结合位点、1个Rho插入序列和1个C末端多变区等结构域,符合ROP蛋白结构特征(图4)。进化树聚类分析结果显示,GhROP6蛋白与拟南芥AtROP6蛋白同源性最高,属于Ⅰ类ROP蛋白(图5)。
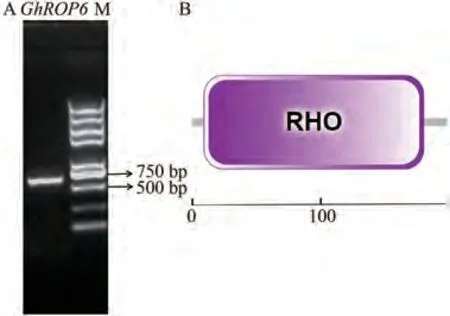
图1 GhROP6基因的克隆与蛋白结构域预测Fig.1 Cloning and protein domain prediction of GhROP6 gene
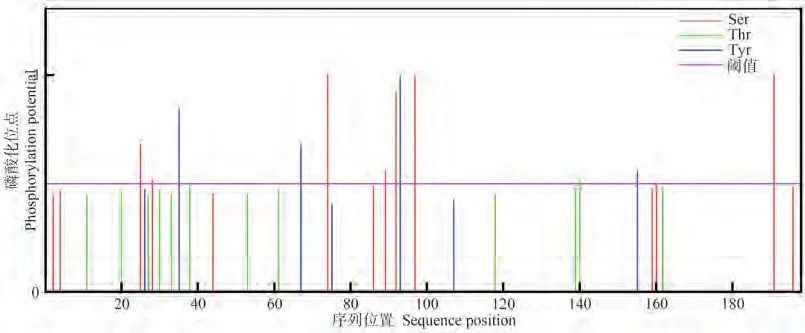
图2 GhROP6蛋白的磷酸化位点预测Fig.2 The prediction of potential phosphorylation site of GhROP6 protein
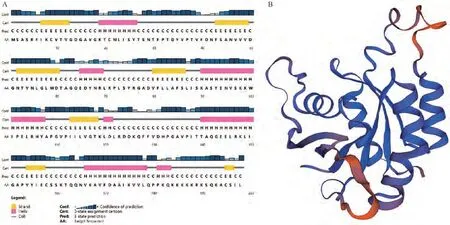
图3 GhROP6蛋白的二、三级结构预测Fig.3 The prediction secondary and tertiary structure of of GhROP6 protein
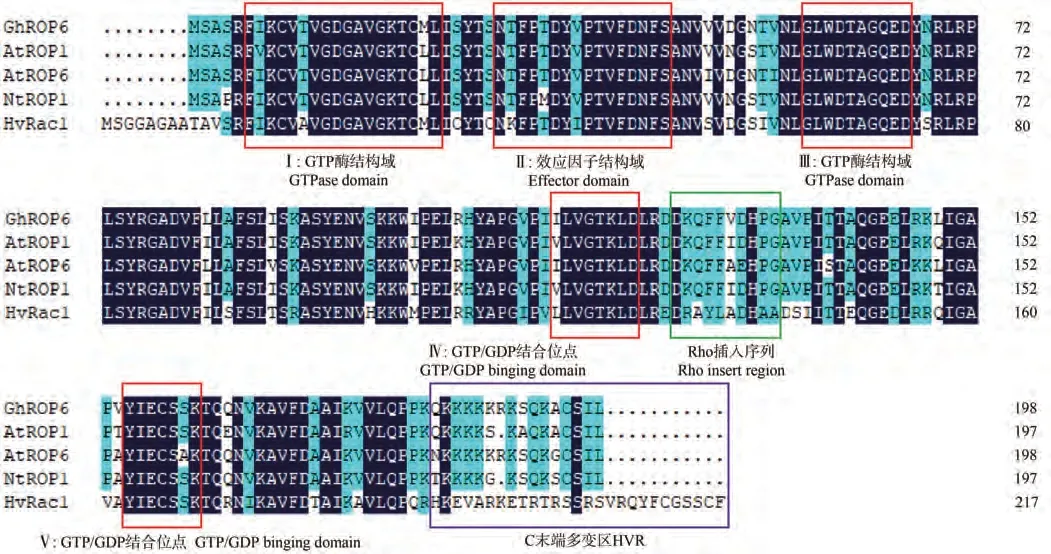
图4 多重序列比对Fig.4 Multiple sequence alignment
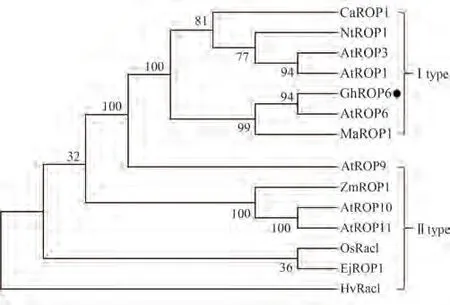
图5 系统进化树分析Fig.5 Phylogenetic tree analysis

表3 GhROP6基因的生物信息学分析Table 3 Bioinformatics analysis of GhROP6 gene
2.2 GhROP6基因的表达模式分析
利用qRT-PCR技术检测GhROP6基因的表达模式,结果显示,GhROP6基因在不同组织中均表达且存在一定的组织特异性,在真叶中的表达量最高,显著高于其余部位,约为根部和茎部的2倍,表达量第二高为子叶(图6-A);GhROP6基因的转录本在干旱处理1和3 h相比于对照显著上调,6和24 h显著下调,12 h无显著差异(图6-B);高盐处理1 h其表达量显著上调,6、12和24 h显著下调,3 h无显著差异(图6-C);低温处理1、3和24 h其表达量均显著下调,6和12 h无显著差异(图6-D);高温处理3 h其表达量显著上调,24 h显著下调,其余处理无显著差异(图6-E);外源ABA处理3和12 h其表达量均显著下调,24 h显著上调,6 h无显著差异(图6-F);外源IAA处理3、12和24 h时 表 达 量 均 显 著 上 调,6 h无 显 著 差 异(图6-G)。
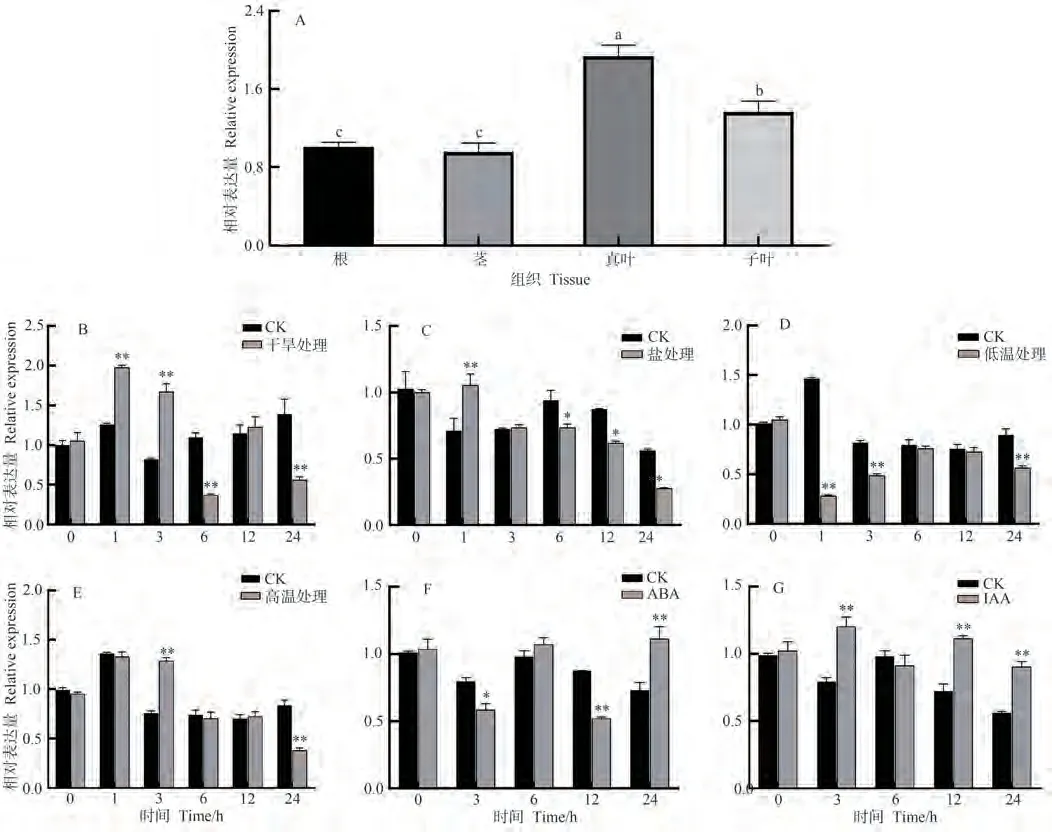
图6 GhROP6基因的表达模式分析Fig.6 Expression pattern analysis of GhROP6 gene
2.3 GhROP6基因的VIGS载体构建
载体构建示意图如图7-A所示,利用PCR技术扩增抑制GhROP6基因表达的靶序列,产物为314 bp,其大小符合预期(图7-B);回收目标产物进行克隆并测序,结果与目标序列一致,未发生错配现象。测序正确的阳性质粒经XbaⅠ和KpnⅠ酶切与TRV2连接载体并进行双酶切鉴定,结果呈现为一条大于8 000 bp的载体条带和一条大小在250~500 bp之间的目标条带(图7-C),其大小均符合预期,表明GhROP6基因的VIGS载体构建成功。
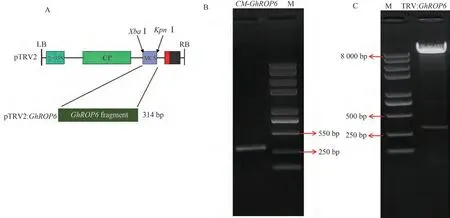
图7 GhROP6基因VIGS载体构建Fig.7 Construction of GhROP6 gene VIGS vector
2.4 GhROP6基因沉默效率检测
将TRV∶GhROP6、TRV∶GhCLA1和TRV∶RNA2分别与TRV∶RNA1混合后分别侵染棉花子叶,约16 d后,阳性对照TRV∶GhCLA1的叶片及茎部出现明显的白化现象(图8-A)。利用qRT-PCR技术检测GhCLA1和GhROP6在根部及真叶中的表达量,结果显示,与阴性对照相比,GhCLA1和GhROP6基因的表达均显著降低(图8-B、C),表明本研究所用TRV-VIGS系统可以在植株体内正常工作,同时成功沉默GhROP6基因。
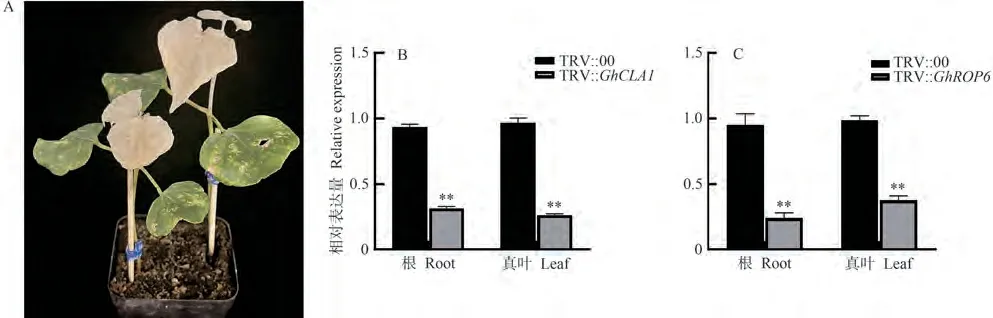
图8 GhROP6基因沉默效率检测Fig.8 Silencing efficiency test result of GhROP6 gene
3 讨论
棉花在推动我国经济发展及社会稳定方面扮演着重要角色,然而近年来全球环境的恶化及异常气候的增多,导致棉花在生长过程中所遭受的各种逆境胁迫加剧,干旱、高盐和极端温度等非生物胁迫越来越成为影响棉花生长、制约棉花产量及纤维品质的重要因素[16],因此挖掘、鉴定棉花相关抗逆基因尤为重要。作为植物特有的一种Rho类小G蛋白,ROP蛋白以“信号转导分子开关”的形式参与细胞各项生命活动调控[3]。近年来对ROP基因的功能研究已成为基因功能鉴定的热点问题,但目前关于棉花ROP基因的功能研究主要集中在棉花纤维发育的调控:李先碧等[22]克隆了2个陆地棉ROP基因GhRacA和GhRacB,其在纤维起始和伸长时期表达显著上调,可能参与棉花纤维早期发育的调控;Delmer等[23]克隆出2个在棉花纤维初生和次生壁合成时期优势表达的基因GhRac9和GhRac13,可能介导棉花次生壁的合成;Kim等[24]从棉籽中克隆获得1个在棉花纤维伸长时期优势表达的GhRAC1基因,该基因通过介导细胞骨架的组装,调控棉花纤维的伸长;Zhang等[25]发现IAA可诱导GhRAC13基因的表达,促进棉纤维中次生细胞壁沉积。对于ROP基因参与棉花抗逆反应调控的相关研究较少:Yang等[26]在棉蚜诱导叶片的抑制差减杂交文库中筛选出了1个GhRac6基因,超表达该基因后增强了棉株的抗蚜性,表明ROP基因参与棉花抵御生物胁迫反应,但对其介导非生物胁迫应激反应的相关研究报道较少。本研究根据拟南芥AtROP1基因的氨基酸序列在棉花基因组数据库进行blast比对,同源克隆获得1个棉花ROP基因,命名为GhROP6,将该基因所编码蛋白序列与上述基因的蛋白序列比对,结果显示均存在一定的差异性,相似性在70%~85%之间,表明该基因是未报道的新棉花ROP基因。多序列比对结果显示该蛋白含有5个GTP∕GDP结合位点、1个Rho插入序列和1个C末端多变区等结构域,与已报道的ROP蛋白结构相同,符合植物ROP蛋白基本结构特征(图4)。进化树分析结果表明GhROP6蛋白与拟南芥AtROP6蛋白具有较高的同源性,聚类分析结果显示其属于Ⅰ类ROP蛋白(图5)。Ⅰ类ROP蛋白主要参与调控植物的生长发育及抗逆反应:如AtROP6蛋白通过参与SA信号通路的调控介导拟南芥抵御白粉病菌反应,同时通过介导ROS爆发参与缺铁应激反应[27-28];MaROP1蛋白正向调节植株的抗旱及耐盐性[29];AtROP1基因是调控植株耐旱反应的重要基因,其在保卫细胞中优势表达,ABA通过灭活AtROP1蛋白,诱导气孔关闭[30];AtROP3蛋白参与调控花粉管伸长及胚芽和根部发育[31];NtROP1基因响应高盐胁迫,在植株耐盐反应中扮演负调控因子的角色[32];CaROP1蛋白作为信号分子开关,通过参与茉莉酸(JA)∕ET信号通路介导辣椒抵御病原菌侵染反应[33]。GhROP6蛋白与上述蛋白同属Ⅰ类,与其序列同源性在89%~94%之间,推测GhROP6蛋白可能在介导棉花抗逆反应中具有重要功能。
以往的研究表明,基因的表达模式通常是其功能的指标[34]。本研究利用qRT-PCR技术探究了GhROP6基因在不同组织及干旱等4种非生物胁迫下的表达模式,结果显示GhROP6基因在不同组织中的均有表达且存在一定的组织特异性(图6-A),推测其在不同组织中所发挥的调控功能有所差异;GhROP6基因的转录本受干旱、高盐、低温和高温处理影响,且在不同胁迫下的表达模式存在差异(图6-B~E),推测GhROP6基因可能在植物应对非生物胁迫适应过程中作为连接多个信号网络的调控因子,该基因响应干旱和高盐胁迫程度更强,因此后续研究应更多关注GhROP6基因在棉花耐旱及抗盐反应的中的功能。作为近年来兴起的一种反向遗传学技术,VIGS因具有快速、高效等优势,已广泛应用于植物靶基因的功能鉴定[35]。TRV载体因具有广泛的寄主、效果持久且毒性轻等优势,已成为应用最多的VIGS载体之一,TRV-VIGS系统现已普遍用于植物抗逆相关基因功能的探究[36]。本研究选用TRV-VIGS系统,成功构建了GhROP6基因的VIGS载体并转化棉花,定量检测结果显示已成功抑制GhROP6基因表达(图8-C),为后续进一步探究GhROP6基因的分子生物学功能及棉花抗逆相关基因的挖掘奠定了基础。
植物在生命周期中会不可避免地遭受各种逆境胁迫的影响,因此自身进化出了多种调控机制以适应各种逆境,激素调节是重要途径之一[37],即植物通过调控自身内源激素含量的变化(降低IAA浓度、提高ABA浓度等),达到对逆境的适应[37]。前人研究发现,ROP基因是ABA信号途径的负调节因子,同时也是IAA信号通路的正调节因子[38]。本研究利用qRT-PCR技术探究了GhROP6基因在外源ABA和IAA处理下的表达模式,结果显示GhROP6基因响应ABA和IAA处理(图6-F、G),可知GhROP6基因可能参与ABA和IAA信号通路,介导棉花抗逆反应。本研究为后续进一步深入研究GhROP6基因的生物学及相关调控机制提供了重要的理论研究,也首次揭示了棉花ROP基因通过参与ABA和IAA等激素信号通路介导棉花抗逆反应。
4 结论
本研究克隆获得了1个陆地棉小GTP结合蛋白基因GhROP6,其开放阅读框为597 bp,编码198个氨基酸,相对分子质量为21.87 kDa,定位于细胞膜,为碱性、亲水性、非跨膜蛋白;含有5个GTP∕GDP结合位点、1个Rho插入序列和1个C末端多变区,与拟南芥AtROP6蛋白同源性最高,属于Ⅰ类ROP蛋白。GhROP6基因在棉花根、茎、真叶和子叶中均有表达且在真叶中表达量最高;该基因响应干旱、高盐、低温和高温等逆境胁迫及外源ABA和IAA处理。本试验还构建了GhROP6基因的VIGS载体并转化至棉花,获得了沉默植株。

