比利时杜鹃花花青素合成酶基因(RhANS)克隆及其功能分析
蒋宝鑫 杨国霞 吕思佳 贾永红 谢晓鸿 吴月燕,
(1浙江万里学院生物与环境学院,浙江 宁波 315100; 2浙江万里学院设计艺术与建筑学院,浙江 宁波 315100)
杜鹃花(Rhododendron simsiiPlanch.)是双子叶植物纲杜鹃花科杜鹃属常绿落叶灌木,也是木本观赏性植物[1]。花色作为观赏植物的重要观赏性状之一,具有很高的园艺学研究价值,因此植物花色的研究对杜鹃花育种具有重要意义[2]。
在植物体内花色素多且复杂,主要分为三大类:类黄酮(flavonoid)、类胡萝卜素(carotenoid)以及生物碱(alkaloid),其中类黄酮是主要色素[3]。花色主要依赖于花青素和类胡萝卜素[4],花青素作为类黄酮衍生物在植物生物学和人类健康中起着至关重要的作用[5],主要存在于花朵、叶子、果实、种子等组织的细胞液泡内[6]。一些研究发现,杜鹃花花瓣的色素主要包括花青素和黄酮醇,其中花青素主要成分为矢车菊素、矮牵牛素、天竺葵素、飞燕草素、芍药花素和锦葵素花青素糖苷化合物。大部分花青素成分是花青素-3-O-糖苷(葡萄糖苷、芦丁苷、半乳糖苷和二糖苷)化合物[2]。
目前杜鹃花杂交育种改良花色尚不清晰,因此通过研究其花青素形成机制,对于利用基因工程技术进行花色改良尤为重要。在花青素的合成途径中,花青素合成酶(anthocyanidin synthase,ANS)是合成途径中最后一个关键酶,在植物体内ANS基因表达量会影响花青素的积累[7]。植物体内的ANS基因可以将无色的原花色素转化为有色的花色苷元,其酶活性影响花色苷的合成[8]。ANS作为一种2-氧戊二酸和Fe(Ⅱ)依赖性加氧酶,与黄烷酮3-羟化酶(F3H)是同一加氧酶家族,能催化相同的底物[9]。首次报道由Saito[10]从红色和绿色紫苏(Perilla frutescens)中分离编码ANS的CDNA序列。近年来,已经对一些植物中花色化合物及合成机制进行探究,已从紫娟茶(Camellia sinensisvar.assamica)[7]、华丽龙胆(Gentiana sino-ornata)[11]、郁金香(Tulipa gesnerianaL.)[12]、紫薇(Lagerstroemia indica)[13]、花生(Arachis hypogaeaLinn.)[14]、黄芩(Scutellaria baicalensisGeorgi)[15]、鸢尾花(Iris halophilaPall.)[16]及其他植物[17-18]中克隆出花青素合成酶(ANS)基因,发现ANS基因可以将无色花青素转化为有色花青素,是花青素合成途径的关键基因。但目前关于杜鹃花花色的分子机制的研究报道较少,杜鹃花花瓣色素沉着的调节因素仍有待研究[19]。前人研究表明,洋葱(Allium cepa)鳞片中ANS基因发生点突变,使巴西黄洋葱和美国红洋葱鳞片颜色发生改变[20]。Yan等[21]研究表明,ANS的功能缺陷或缺失会影响植物颜色的形成,导致无色或白色器官,表明了其在植物颜色形成中的重要性。Nakatsuka等[22]在夏堇(Torenia hybrida)中利用RNAi技术抑制体内ANS基因的表达,抑制后夏堇产生稳定的白花。此外,ANS基因的表达水平以及基因突变对于花色苷的积累有着重要的影响,但杜鹃花ANS基因的相关研究仍鲜有报道,对其功能的验证、酶学性质等尚不清晰。Ye等[23]研究表明,桃[Prunus persica(L.) Batsch]中重组PpANS蛋白可以催化无色花青素形成花青素。Pang等[24]在蒺藜苜蓿(Medicago truncatula)中重组MtANS蛋白可以将无色花青素转化为花青素。基于以上研究,推测ANS基因可能是比利时杜鹃花合成花青素含量的关键酶基因。
为了验证上述推测,本研究以红色比利时杜鹃花(Rhododendron hybridumHort.)4个时期(花苞期、初开期、盛开期和衰亡期)花瓣和盛开期根、茎、叶为试验材料,测定4个时期花瓣花青素的含量,克隆杜鹃花ANS基因的开放阅读框(open reading frame,ORF)全长,并进行生物信息学分析;对杜鹃花4个时期花瓣和盛开期不同器官ANS基因表达量进行测定,并探究比利时杜鹃花不同发育时期花瓣ANS基因表达量与花青素含量的关系;构建原核表达载体pET-28-RhANS,制备重组蛋白,利用高效液相色谱仪(high performance liquid chromatography,HPLC)检测RhANS体外酶活性,对RhANS进行功能分析,鉴定重组蛋白的功能,旨在为了解植物观赏价值和杜鹃花花色素形成的分子机理提供理论基础。
1 材料与方法
1.1 试验材料
试验材料于2022年3月在中国宁波北仑柴桥万景杜鹃良种园(121°27´40″~122°10´22″E,29°41´44″~29°58´48″N)中采集,选择生长良好的红色比利时杜鹃花花苞期(S1)、初开期(S2)、盛开期(S3)、衰亡期(S4)和盛开期根、茎和叶为试验材料(图1-A、B)。采后立即置于液氮中,然后放入-80 ℃条件下储存备用。每个样品均设3次生物学重复。

图1 比利时杜鹃花不同花期花瓣形态(A)和盛开期器官(B)Fig.1 Petal at different flowering stages (A) and tissues and organs at full opening stages (B) of Rhododendron hybridum Hort.
1.2 试验方法
1.2.1 花青素含量测定分析 参考黄玲等[12]和赵伟等[25]的方法进行花青素测定:将4个发育时期的花瓣样品经液氮研磨成粉末,称取100 mg花瓣粉末加入1.0 mL 1%盐酸-甲醇中,4 ℃黑暗条件下静置12 h,期间涡旋3次。12 000 r·min-1离心10 min,吸取上清,使用0.22 µm微孔滤膜过滤样品,保存于进样瓶中备用。利用UPLC-Qtof超高效液相色谱仪(Waters,美国)对4个发育时期的花瓣样品色素提取液进行分析。标准品为矢车菊素-3-O-葡萄糖(Cy3G)(上海源叶生物科技有限公司)。
1.2.2 总RNA的提取及cDNA合成 取-80 ℃条件下保存的比利时杜鹃花样品,用液氮研磨,使用RNAprep Pure多糖多酚植物总RNA提取试剂盒[天根生化科技(北京)有限公司]提取花瓣总RNA。通过1.5%琼脂糖凝胶电泳仪(北京六一生物科技有限公司)和SpectraMax 190全波长酶标仪(北京龙跃生物科技发展有限公司)测定总RNA的质量和浓度。按照NovoScript®Plus All-in-one 1st Strand cDNA Synthesis SuperMix (gDNA Purge)反转录试剂盒(上海近岸科技有限公司)说明书逆转录合成cDNA。使用SMARTer®RACE 5´∕3´ Kit RACE试剂盒[宝日医生物技术(北京)有限公司]说明书逆转录合成3´∕5´cDNA[26]。
1.2.3RhANS基因的克隆 从美国国家生物技术信息 中 心(National Center for Biotechnology Information,NCBI)数据库中下载与杜鹃花属植物亲缘关系较近植物的ANS基因序列。使用Primer 6.0软件进行简并引物ANS-R1和ANS-F1设计(表1)。以杜鹃花cDNA为模板,按照2×EasyTaq®PCR Super Mix酶(北京全式金生物技术股份有限公司)说明书进行PCR扩增。保守区域扩增产物经1.5%琼脂糖凝胶电泳检测,回收目的片段产物,将回收产物与pEASY®-BluntCloningKit(北京全式金生物技术股份有限公司)载体连接并转化到大肠杆菌DH5α中。将感受态细胞均匀涂布于具有卡那霉素(kanamycin,Kan, 100 mg·mL-1)抗性的LB固体培养基上,将平板倒置于37 ℃恒温培养箱过夜培养。挑取培养后的单一菌落,利用M13F和M13R通用引物进行菌液PCR,筛选阳性克隆菌,进行序列测定(北京擎科生物科技有限公司),从而获得目的基因的保守序列。使用Primer 6.0软件设计RACEANS-5´∕3´引物(表1)。按照2×FastPfuMasterMix酶(上海近岸科技有限公司)说明书进行PCR扩增。后续试验过程与保守区域克隆相同,从而获得ANS-5´和ANS-3´基因的核苷酸序列。使用DNAMAN 8软件进行序列拼接,根据拼接结果使用Primer 6.0软件设计全长引物ANS-R2和ANS-F2(表1),在起始密码子前和终止密码子后设计引物,按照2×FastPfuMasterMix酶说明书进行PCR扩增。后续试验过程与保守区域克隆相同。
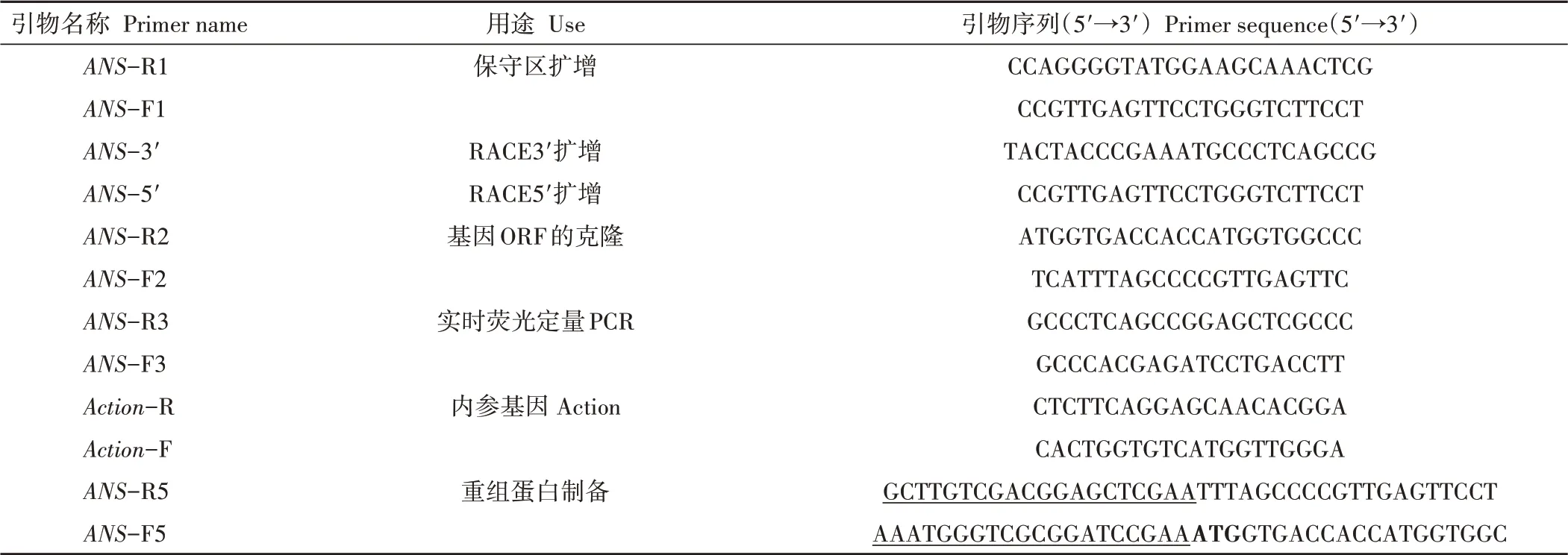
表1 本研究所用的引物序列Table 1 Primers sequence used in this study
1.2.4 生物学信息分析 采用DNAMAN 8.0软件进行同源蛋白质序列比对;采用MEGA 6.0软件构建系统进 化 树;采 用ProtParam网 站(http:∕∕web.expasy.org∕protparam)对RhANS蛋白进行理化特性分析;采用ProtScale网站(http:∕∕web.expasy.org∕protscale)对RhANS蛋白进行疏水性分析;采用SOPMA 网站(https:∕∕npsaprabi.ibcp.fr∕)对RhANS蛋白进行二级结构预测;采用Swiss Model网站(https:∕∕www.swissmodel.expasy.org∕)对RhANS蛋白质进行三级结构预测;采用CDD网站(https:∕∕www.ncbi.nlm.nih.gov∕cdd∕)对RhANS蛋白进行功能结构域分析;采用NetPhos 网站(http:∕∕www.cbs.dtu.dk∕services∕NetPhos∕)对RhANS蛋白进行磷酸化位点分析。
1.2.5RhANS实时荧光定量PCR(quantitative realtime PCR,qRT-PCR)分析 参考刘小飞等[27]的方法进行qRT-PCR内参基因筛选及验证,选择Actin-R和Actin-F作为内参基因。利用Primer 6.0软件设计qRT-PCR引物ANS-R3和ANS-F3(表1)。选择4个发育阶段比利时杜鹃花品种花瓣和不同组织作为试验材料,使用RNAprep Pure多糖多酚植物总RNA提取试剂盒(天根生化科技有限公司,北京)提取总RNA。根据
NovoScript®Plus All-in-one 1st Strand cDNA Synthesis SuperMix (gDNA Purge)试剂盒(上海近岸科技有限公司)合成荧光cDNA。使用2×NovoStart®SYBR qPCR SuperMix Plus试剂盒(上海近岸科技有限公司)进行qRT-PCR分析。反应程序:95 ℃预变性5 min;95 ℃变性1 min;95℃退火20 s,60℃延伸1 min,30个循环。采用2-ΔΔCT法[28]计算基因相对表达量。
1.2.6RhANS基因的原核表达 使用Primer 6.0软件设计带有酶切位点的上下游引物ANS-R5和ANS-F5(表1)。以杜鹃花cDNA为模版,利用2×EasyTaq®PCR Super Mix酶(北京全式金生物技术股份有限公司)进行PCR扩增,后续试验过程与保守区域克隆相同,获得带有酶切位点的ANS基因全部核苷酸序列。
用EcoRI-HF酶[纽英伦生物技术(北京)有限公司]将pET-28a质粒(武汉淼灵生物科技有限公司)进行单酶切,酶切产物经1.5%琼脂糖凝胶电泳检测,并进行割胶回收纯化。使用NovoRec®plus One step PCR Cloning Kit连接酶试剂盒(上海近岸科技有限公司),将纯化产物按载体片段和插入片段摩尔比1∶2连接,再将连接后的pET-28a-RhANS载体轻轻混匀加入大肠杆菌DH5α感受态细胞中。将菌液均匀涂布在含Kan的抗生素平板上,37 ℃倒置过夜培养。挑取重组的单一菌落进行菌液PCR鉴定,将质粒送至杭州擎科生物有限公司测序。
1.2.7 RhANS重组蛋白制备与纯化 将重组质粒pET-28a-RhANS和空载质粒pET-28a,加入大肠杆菌BL21(DE3,pLysS chemically competent cell)感受态细胞中轻轻混匀。将转化后的感受态细胞加到含Kan抗性的固体培养基中,37 ℃倒置过夜培养。挑取重组的单一菌落进行菌液PCR鉴定。将重组质粒pET-28a-RhANS和空载质粒pET-28a阳性菌落预培养于10 mL含有Kan抗性的LB液体培养基中,37 ℃、200 r·min-1过夜。当菌液吸光度A600nm达到0.5~0.8时,加入238 µL 0.5 mmol·L-1IPTG溶液,在37 ℃条件下诱导重组蛋白8 h[29]。诱导结束后于4 ℃、8 000 r·min-1条件离心10 min收菌,用2 mL 0.1%磷酸盐缓冲液(phosphate buffer solution,PBS)悬浮沉淀,对沉淀进行超声处理,4 ℃、13 000 r·min-1离 心10 min后 吸 取 上 清 液,用2 mL 0.1% PBS悬浮沉淀。分别收集上清和沉淀,然后取20 µL蛋白样品加入20 µL二硫苏糖醇(dithiothreitol,DTT)混匀,100 ℃水浴加热5~10 min,使蛋白变性,冷却至室温后,进行十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(10% SDS polyacrylamide gel electrophoresis,10% SDS-PAGE)可溶性重组蛋白验证。使用His60镍超流树脂和重力柱[宝日医生物技术(北京)有限公司]对可溶性重组蛋白进行纯化,收集洗脱液,将洗脱液中进行10% SDS-PAGE分析。
1.2.8 RhANS蛋白体外酶活检测 将纯化的重组蛋白pET-28a-RhANS(100 µL)和pET-28a空载体蛋白(100 µL)溶解于8 mmol·L-1抗坏血酸钠(C6H7O6Na)、400 mmol·L-1氯化钠(NaCl)、2 mmol·L-12-氧化戊二酸(C5H6O5)、20 mmol·L-1麦芽糖(C12H22O11·H2O)、10 mmol·L-1二 硫 苏 糖 醇(DTT)、1 mmol·L-1FeSO4、1 µmol·L-13,4-顺式花青素和40 mmol·L-1KPi缓冲液(pH值7.5)体系中,反应总体积为500 µL。在30 ℃,孵育1 h后,加入8 µL 18% 盐酸(HCl)和40 µL甲醇终止反应。样品于12 000 r·min-1离心5 min,将样品中上清液通过0.22 µm孔径滤膜过滤。采用Waters超高效液相色谱仪(美国沃特世公司),Acquuity uplc beh C18色谱柱(1.7 µm,2.1×100 µm,美国沃特世公司)对样品上清液进行分析。在530 nm处检测蛋白样品,采用二元流动相方法检测,流动相A为1% 磷酸,流动相B为含50% 甲酸的乙腈,流速为1 mL·min-1。以空载pET-28a的BL21为对照[9,23]。
1.3 数据分析
利 用Origin 2018、DNAMAN 8.0、Primer 5.0、MEGA 6.0、SPSS 17.0和Excel 2007软件对数据进行处理分析;所有数据均设3组生物学重复,采用单因素方差分析(P<0.05)。
2 结果与分析
2.1 比利时杜鹃花发育过程中色素含量分析
利用Waters UPLC-Qtof超高效液相色谱仪对1% 盐酸-甲醇稀释的Cy3G标准品和不同发育阶段花瓣进行峰面积测定,获得标准曲线方程(y=36.52x-59.18)和相关系数(R²=0.998)。将不同发育阶段花瓣的峰面积带入标准曲线,结果如图2所示。在比利时杜鹃花不同发育阶段的花瓣中,花青素含量呈逐渐上升的变化趋势且存在显著差异,在S4时期含量最高,是S1时期的3.18倍;花青素含量在S1和S2时期积累量较少,在S3和S4时期积累量较多。
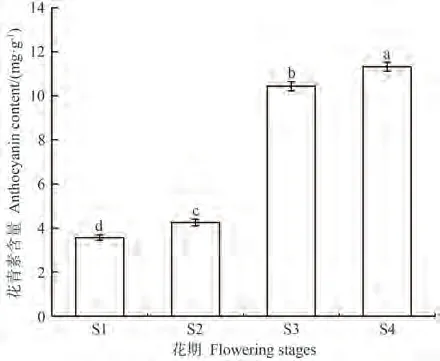
图2 比利时杜鹃花花瓣不同发育阶段花青素苷含量Fig.2 Anthocyanin content of Rhododendron hybridum Hort. petals at different developmental stages
2.2 RhANS基因的克隆及生物学信息分析
以比利时杜鹃花cDNA为模板,利用简并引物进行PCR扩增,获得687 bp保守区序列(图3-A);根据保守区序列进行RACE扩增,分别获得897 bp的5´序列(图3-B)和693 bp的3´序列(图3-C)。利用DNAMAN 8.0软件将保守区、5´区和3´区序列进行比对拼接,得到ANS基因全长为1 350 bp,其中包含1 074 bp的完整ORF序列(图3-D),编码357个氨基酸。
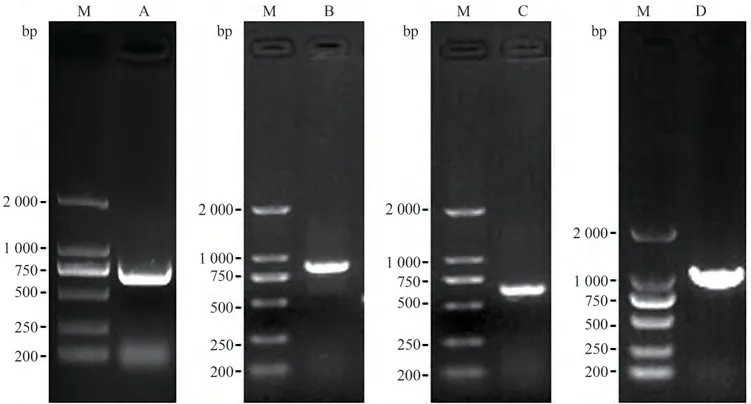
图3 比利时杜鹃花ANS基因PCR扩增Fig.3 PCR amplification of Rhododendron hybridum Hort. ANS gene
使用DNAMAN 8.0软件将RhANS氨基酸序列与其他物种的氨基酸序列进行比对(图4)。结果显示,杜鹃花ANS与其他植物ANS氨基酸序列相比较具有较高的同源性,RhANS蛋白是一个典型的2OG-Fe(Ⅱ)加氧酶结构域,该保守域为ANS的特征结构域。RhANS蛋白包含由His236、Asp238和His292组成的铁离子结合位点(HxDxnH),以及由Arg302和Ser304构成的2-酮戊二酸的结合位点(RxS)。
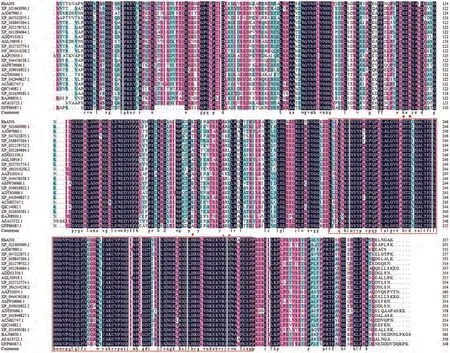
图4 比利时杜鹃花与其他植物ANS氨基酸序列的多重比较Fig.4 Multiple comparison of amino acid sequences of Rhododendron hybridum Hort. with ANS of other plants
使用MEGA 6.0软件对杜鹃花与21种植物ANS氨基酸序列构建进化树(图5)。结果显示,杜鹃花ANS氨基酸序列与其他物种ANS蛋白有较高的保守性,其中比利时杜鹃花ANS蛋白与越橘(AFA53722.1)亲缘关系最近。

图5 比利时杜鹃花ANS与其他物种ANS蛋白质的系统进化树Fig.5 Phylogenetic tree of ANS of Rhododendron hybridum Hort. with ANS proteins of other species
2.3 RhANS蛋白质的生物信息学分析
2.3.1 RhANS蛋白质保守结构域分析 采用CDD对RhANS蛋白进行功能结构域分析(图6)。结果表明,比利时杜鹃花ANS蛋白属于2-氧戊二酸(2OG)和 Fe(Ⅱ)依赖性加氧酶超家族。
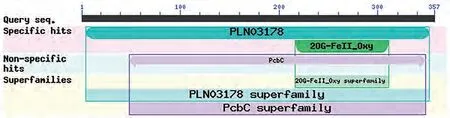
图6 比利时杜鹃花ANS基因编码蛋白的保守结构域Fig.6 Conservative domains of ANS encoding protein in Rhododendron hybridum Hort
2.3.2 RhANS蛋白质理化特性分析 利用ProtParam分析,得到RhANS蛋白的分子式为C1809H2843N483O537S13,相对分子质量为40 367.17 Da、理论等电点为5.83,总负电荷残基(Asp+Glu)为53,总正电荷残基(Arg + Lys)为43,不稳定指数(Ⅱ)为48.58,脂肪系数为84.93。比利时杜鹃ANS蛋白为不稳定带负电荷的酸性蛋白质。
2.3.3 RhANS蛋白疏水性分析 采用ProtScale对RhANS蛋白进行疏水性分析(图7)。结果显示,ANS蛋白质存在明显的疏水区和亲水区,其中第191位疏水区最高为2.456;第45和第46位亲水区最低,为-3.000。综上可知,RhANS蛋白质为亲水性蛋白质。
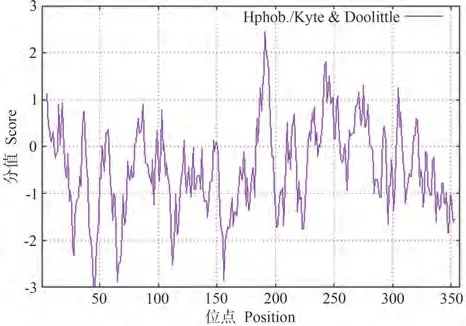
图7 比利时杜鹃花ANS蛋白质疏水性/亲水性预测Fig.7 Prediction of the hydrophobic/hydrophilic of ANS in Rhododendron hybridum Hort.
2.3.4 RhANS蛋白磷酸化位点分析 利用NetPhos 进行推测,结果显示比利时杜鹃花ANS蛋白质存在30个磷酸化位点,其中包含12个丝氨酸(Ser),12个苏氨酸(Thr),6个酪氨酸(Tyr)(图8)。
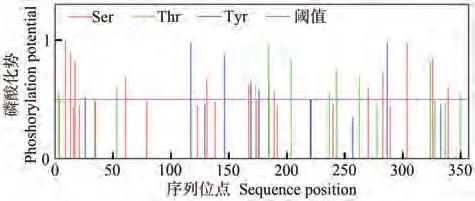
图8 比利时杜鹃花ANS蛋白质氨基酸翻译后磷酸化修饰预测Fig.8 Prediction of phosphorylation site after amino acid translation of ANS protein in Rhododendron hybridum Hort.
2.3.5 RhANS蛋白质结构预测 利用SOPMA 对RhANS蛋白质进行二级结构预测,结果如图9所示。有121个氨基酸参与形成α-螺旋,占总氨基酸的33.89%;有58个氨基酸参与形成延伸链,占总氨基酸的16.25%;有19个氨基酸参与β-转角,占总氨基酸的5.32%;有159个氨基酸参与形成无规则卷曲,占总氨基酸的44.54%。结果表明,比利时杜鹃花ANS蛋白主要由不规则卷曲、α-螺旋和延伸链结构组成。
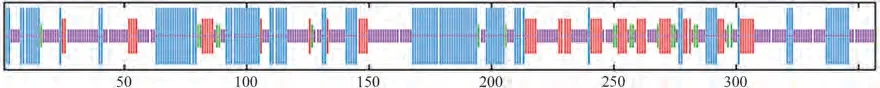
图9 比利时杜鹃花ANS蛋白二级结构预测Fig.9 Predicted secondary structure of ANS protein in Rhododendron hybridum Hort.
采用Swiss Model对RhANS蛋白质进行三级结构预测(图10),在蛋白质数据库中选择与ANS蛋白质序列一致性最高的蛋白质为模板进行蛋白质结构预测,得到杜鹃ANS蛋白质的结构模型。结果表明,比利时杜鹃花ANS蛋白质三级结构与二级结构预测结果相符,主要是由α-螺旋和不规则卷曲构成。
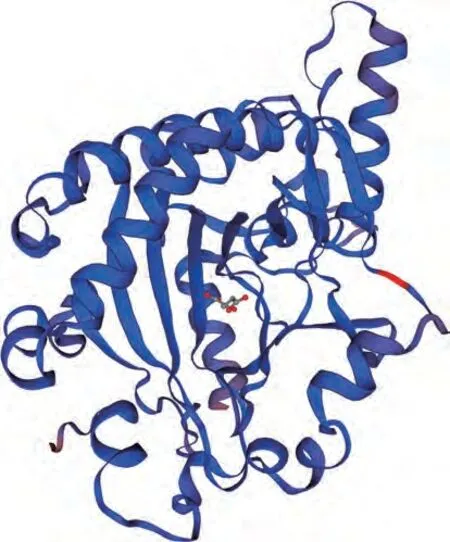
图10 比利时杜鹃花ANS蛋白质三级结构预测Fig.10 Prediction of the three level structure of ANS protein in Rhododendron hybridum Hort.
2.4 比利时杜鹃花不同时期花瓣以及根、茎和叶中ANS基因的表达量分析
为探究RhANS对花青素合成的影响,通过qRTPCR分析RhANS在比利时杜鹃花花瓣不同发育阶段以及根、茎和叶中的表达量。如图11所示,RhANS在比利时杜鹃花花瓣发育不同时期以及根、茎、叶中均有表达。在4个花期的花瓣中,随花瓣的发育ANS基因的表达水平呈上升趋势,在S4时期表达量达到最高,是S1时期的6.39倍。RhANS基因在比利时杜鹃花花瓣中的表达量均比根、茎和叶组织中表达量高。在不同组织器官中,ANS在叶中表达量最高,茎和根中表达量无显著差异。随花瓣的发育RhANS表达量与花青素含量均呈上升趋势,推测RhANS基因表达量影响花青素的合成。
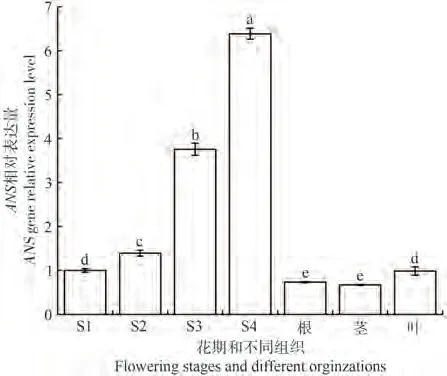
图11 比利时杜鹃花不同发育阶段花瓣及不同组织的ANS基因表达量Fig.11 Expression of ANS genes in petals and tissues at different developmental stages of Rhododendron hybridum Hort.
2.5 RhANS蛋白制备、纯化及体外酶活性分析
将测序正确的重组质粒pET-28-RhANS和空载质粒pET-28转入大肠杆菌(BL21)中,以不含质粒的大肠杆菌和空载质粒pET-28转入大肠杆菌作为蛋白阴性对照。如图12所示,通过10% SDS-PAGE的可溶性蛋白大小约为40 kDa,与预期大小相近,说明RhANS蛋白在大肠杆菌中成功表达。

图12 重组RhANS蛋白的10% SDS-PAGE分析Fig.12 10% SDS-PAGE analysis of recombinant RhANS protein
使用His60镍超流树脂和重力柱对6加入IPTG诱导剂的pET-28-RhANS重组质粒中进行蛋白纯化,用10% SDS-PAGE电泳分析,结果如图13所示。纯化后的RhANS蛋白大小约为40 kDa,与理论值相近。

图13 重组RhANS蛋白纯化后的10% SDS-PAGE分析Fig.13 10% SDS-PAGE analysis of recombinant RhANS protein after purification
在2-氧戊二酸(2OG)和Fe(Ⅱ)的作用下,纯化的重组pET-28a-RhANS蛋白催化底物3,4-顺式花青素,使用HPLC在530 nm处检测纯化的RhANS蛋白的活性。纯化的重组pET-28a-RhANS蛋白催化底物3,4-顺式花青素形成花青素,通过与标准品的保留时间和UV∕Vis光谱进行比较,确认其为花青素(图14-A、C);与空载体对照显示,3,4-顺式花青素未被催化为花青素(cyanidin)(图14-B)。结果表明,纯化后重组蛋白pET-28a-RhANS蛋白具有酶活性。
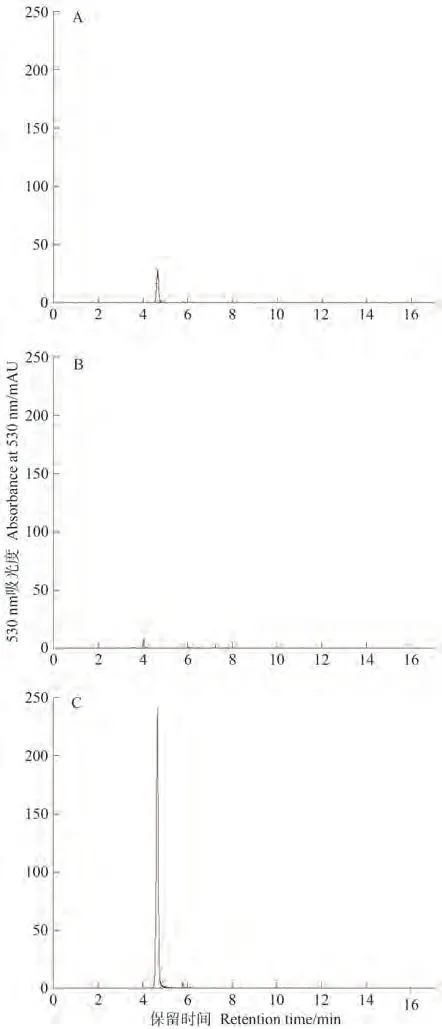
图14 3,4-顺式花青素为底物催化重组RhANS蛋白产物分析Fig.14 Analysis of 3,4-cis-anthocyanidin as substrate catalyzed recombinant RhANS protein product
3 讨论
杜鹃花作为重要的观赏性植物,花色是观赏性植物最重要的定性特征之一。花青素在花色形成中起着主导作用,但花青素的合成通路相关基因在杜鹃花花色形成过程中报道较少。为进一步探究杜鹃花花色形成的生物学特性,本研究首次从比利时杜鹃花中克隆花青素合成酶(ANS)基因,其ORF长度为1 074 bp,编码357个氨基酸。RhANS基因保守结构域分析表明,比利时杜鹃花ANS编码蛋白属于2-氧戊二酸(2OG)和Fe(Ⅱ)依赖性加氧酶超家族。李小兰等[30]预测花青素合成酶ANS基因具有Fe2+的2-酮戊二酸[2OG-Fe(Ⅱ)]双加氧酶家族,与本研究结果相符。本研究发现,比利时杜鹃花ANS蛋白包含由His236、Asp238和His292组成的铁离子结合位点(HxDxnH),以及由Arg302和Ser304构成的2-酮戊二酸的结合位点(RxS)。赵荣等[31]预测墨法师(Aeonium arboreum)AaANS1蛋白包含由His236、Asp238和His292组成的铁离子结合位点(HxDxnH)以及由Arg302和Ser304构成2-酮戊二酸的结合位点(RxS),与本研究预测结果相符。本研究发现比利时杜鹃花ANS蛋白为不稳定带负电荷的酸性亲水性蛋白质,与陈可欣等[13]预测紫薇LiANS蛋白质理化特性和蛋白疏水性结果相符。RhANS蛋白磷酸化位点分析表明,比利时杜鹃花ANS蛋白存在30个磷酸化位点,其中含有12个丝氨酸(Ser),12个苏氨酸(Thr),6个酪氨酸(Tyr),与赵荣等[31]预测墨法师AaANS1蛋白磷酸化位点存在酪氨酸(Tyr)、苏氨酸(Thr)和丝氨酸(Ser)残基的结果相似。通过对RhANS蛋白质二三级结构进行预测分析可知,比利时杜鹃花ANS蛋白主要由无规则卷曲、α-螺旋和延伸链组成,与陈可欣等[13]紫薇LiANS蛋白质二三级结构预测结果相似。通过构建系统进化树发现,杜鹃花ANS蛋白与越橘ANS蛋白(AFA53722.1)亲缘关系较最近。本研究表明,RhANS基因在花色形成过程中起重要的作用。RhANS表达量在比利时杜鹃花花瓣的不同发育时期以及根、茎、叶中均表达,在衰亡期(S4)时期表达量最高,在花苞期(S1)时期表达量最低。随着花瓣的发育,RhANS基因相对表达量与花青素含量均呈上升趋势,这与黄玲等[12]关于郁金香ANS基因表达水平和花青素苷的研究结果一致。在比利时杜鹃花不同组织器官中,叶中表达量最高,茎和根中表达量较低。衡蒙等[11]发现,在华丽龙胆中,GsANS基因在根、茎、叶中的表达量均比花冠低,其中在叶中表达量最高,茎中最低,推测比利时杜鹃花花瓣中花青素的含量与ANS基因表达量呈高度相关,ANS基因在比利时杜鹃花花青素合成中发挥关键作用。本研究发现,比利时杜鹃花RhANS蛋白纯化前可溶性重组蛋白大小约为40 kDa。His60镍超流树脂和重力柱纯化后的RhANS蛋白大小约为40 kDa,与生物信息学预测的RhANS蛋白大小相近。体外酶活测定发现,目的蛋白具有ANS酶活性,这与Ye等[23]、Pang等[24]和姜翠翠等[29]关于ANS蛋白大小及体外酶活的研究结果基本一致。由此推测比利时杜鹃花RhANS蛋白具有酶活性,为进一步验证RhANS基因的功能奠定了基础。
本研究深入研究了比利时杜鹃花克隆的ANS基因,后续可以通过关键基因的过表达[32]、基因沉默[33]、RNAi介导[34]等技术实现观赏性植物花色新种质创新,进一步提高植物观赏价值和品质。此外,前人研究发现在东方百合[35]、烟草[9]中存在ANS基因家族,但在比利时杜鹃花中是否存在ANS基因家族,还需进一步研究。
4 结论
本研究首次从比利时杜鹃花中克隆出花青素合成酶(ANS)基因,全长1 074 bp,编码357个氨基酸。比利时杜鹃花ANS蛋白属于 2-氧戊二酸(2OG)和Fe(Ⅱ)依赖性加氧酶超家族,包含由His236、Asp238和His292组成的铁离子结合位点(HxDxnH)以及由Arg302和Ser304构成2-酮戊二酸的结合位点(RxS)。比利时杜鹃花ANS蛋白与越橘ANS蛋白(AFA53722.1)亲缘关系较近。比利时杜鹃花ANS蛋白为不稳定带负电荷的酸性亲水性蛋白。在比利时杜鹃花中,花青素含量和RhANS表达量都随着花瓣的发育呈上升趋势。在比利时不同组织器官中,叶中RhANS表达量最高,茎和根中表达量无显著差异。通过构建pET-28a-RhANS原核表达载体诱导的蛋白大小约为40 kDa。HPLC检测表明,RhANS蛋白具有ANS酶活性。

