粗毛纤孔菌产胞外黑色素发酵条件优化及其抗氧化活性研究
李晓敏 袁 源 薛帆正 吴小平 傅俊生 ,
(1福建农林大学生命科学学院,福建 福州 350002; 2福建农林大学菌物研究中心,福建 福州 350002)
粗毛纤孔菌[Inonotus hispidus(Bull.) P. Karst.]是一种名贵的药用真菌,收录于中国药用真菌名录,别名粗毛黄褐孔菌,隶属于担子菌门伞菌纲绣革孔菌目绣革孔菌科纤孔菌属[1-2]。粗毛纤孔菌作为传统中药“桑黄”,具有抗氧化、抗肿瘤、降血糖、保肝、增强免疫力等药理价值[3-5]。在现代药理学上,粗毛纤孔菌的药用成分也逐渐被挖掘,如多糖、多酚、黄酮、萜类等活性物质[6-8]。黑色素也是粗毛纤孔菌的活性成分之一,但关于粗毛纤孔菌黑色素的相关研究鲜有报道。
黑色素是一类分布极其广泛的天然生物色素,是一种由酚类或吲哚氧化聚合形成的大分子[9]。黑色素具有良好的抗氧化[10]、抗肿瘤[11-12]、抗辐射、抗病毒、抑菌、自由基清除能力[13-14]、保肝[15]等生物活性,可广泛应用于农业、工业、医药等领域(如农药光保护剂[16]、生物吸附剂[17]、天然药物[18]等)。有研究表明,粒毛盘菌(LachnumYM226)黑色素及其衍生物对H22荷瘤小鼠具有抗肿瘤活性[12];在食品加工方面,黑色素可作为一种天然着色剂、抗氧化剂、抑菌剂,应用于食品添加剂中起到调色、抗氧化等作用[19];在工业上,因黑色素具有较强的抗氧化性、光保护性,可应用于防晒霜、抗衰老等产品开发,如斯氏假单胞菌产生的黑色素可以提高防晒霜的防晒系数[20];在医学领域,索拉菲尼(肝癌化疗药物)与黑色素结合构建水溶性的纳米药物递送的载体可用于小鼠肿瘤的治疗[21]。
许多大型真菌都含有黑色素,这使得真菌成为获取黑色素的重要来源。目前研究较多的有短梗霉属、木耳属、粒盘菌属、层孔菌属等来源的黑色素[22]。液体发酵培养有利于快速制备发酵产物,易于产业化。在发酵培养过程中,发酵菌种、培养基配方以及培养条件等因素发挥着重要的作用[23]。培养基可以为微生物提供生长过程中所必需的营养要素,如碳源和氮源等,而发酵培养温度、转速等培养条件则会对微生物的生长速度和代谢物的合成产生影响[23]。目前国内外对粗毛纤孔菌产黑色素的液体深层发酵工艺研究的报道较少。本研究通过单因素试验结合正交试验优化粗毛纤孔菌的液体发酵培养基配方及发酵条件,以期从发酵液中获得大量的胞外黑色素,并对其抗氧化活性进行评价,为粗毛纤孔菌黑色素高效生产及天然黑色素的开发应用提供参考。
1 材料与方法
1.1 材料与试剂
粗毛纤孔菌菌株:MS-5,由福建农林大学菌物研究中心从宁夏中卫市野生枣树上生长的粗毛纤孔菌子实体分离获得(NCBI登录号:MF183947)。透析袋MD44(截留分子量为8 000~14 000 D)购于北京索莱宝科技有限公司。
试剂:葡萄糖、麦芽糖、甘露醇、果糖、木糖、蔗糖、玉米粉、淀粉、乳糖、胰蛋白胨、酵母提取粉、牛肉浸膏、硝酸钾、硝酸铵、酒石酸铵、脲、硫酸镁、维生素B1(vitamin B1,VB1)、磷酸二氢钾、氢氧化钠、盐酸、无水乙醇、水杨酸、30%过氧化氢溶液(H2O2)、硫酸亚铁溶液(FeSO4)等购自国药集团化学试剂有限公司。1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl, DPPH)、2,2’-联氮-双(3-乙基-苯并噻唑-6-磺酸)二铵盐[2,2’-azinobis-(3-ethylbenzthiazoline-6-sulphonate) diammonium salt, ABTS]等购自北京索莱宝科技有限公司。
PDB加富培养基:200 g马铃薯、20 g葡萄糖、5 g胰蛋白胨、2 g硫酸镁、1.5 g磷酸二氢钾、10 mg VB1、1 L水,pH自然。
1.2 主要仪器与设备
VS-1300-U超净工作台,安泰空气技术有限公司;LDZF-50L立式压力蒸汽灭菌器,上海申安医疗器械有限公司;SPX-250B-Z恒温培养箱,上海博迅实业有限公司医疗设备厂;EG720KG3-NR1微波炉,美的微波炉电器制造有限公司;UV-5200紫外分光光度计,上海元析仪器有限公司;Thermo Scientific Nicolet 10红外光谱仪,武汉德盟科技有限公司;Varioskan Flash多功能酶标仪,美国Thermo公司。
1.3 试验方法
1.3.1 粗毛纤孔菌发酵液黑色素(IHEM)产量的测定 参照罗青等[24]的方法,并稍作修改。将粗毛纤孔菌发酵液过滤收集滤液,使用浓度为6 mol·L-1的HCl将滤液pH值调节至1.5~2.0,置于4 ℃静止过夜。次日,将酸化过的发酵液于10 000 r·min-1离心10 min后弃上清,并使用去离子水将沉淀重复洗涤至pH呈中性,随后离心收集沉淀。将沉淀冷冻干燥即获得粗毛纤孔菌发酵 液 黑色素(extracellular melanin ofInonotus hispidus,IHEM)粗品,并称重测其IHEM含量。沉淀依次采用有机试剂氯仿、二氯甲烷、乙酸乙酯、无水乙醇、75%乙醇和蒸馏水冲洗,于10 000 r·min-1离心5 min,去上清。将 沉 淀先 用0.1 mol·L-1NaOH复溶,再用0.1 mol·L-1HCl将溶液pH调节至中性,流水透析48 h,将其冷冻干燥获得IHEM纯品,用于检测IHEM的光谱特征及化学抗氧化试验。后续单因素试验及正交试验均以未除杂的IHEM粗品含量作为评价指标(即IHEM含量)。
1.3.2 初始培养基及发酵条件 初始培养基为PDB加富培养基,初始发酵条件为接种7片直径为0.7 cm的粗毛纤孔菌于装有100 mL培养基的250 mL三角瓶中,每组试验设定3个生物学重复,并将三角瓶置于25 ℃、160 r·min-1摇床中发酵培养10 d,培养结束后收集粗毛纤孔菌发酵液,并按照1.3.1的方法对其黑色素进行提取。
1.3.3 单因素试验 (1)碳源筛选试验:以PDB加富培养基作为基础培养基,碳源分别替换为甘露醇、玉米粉、蔗糖、果糖、淀粉、乳糖、木糖、葡萄糖和麦芽糖,以不添加碳源为对照组,氮源为胰蛋白胨,pH自然(pH值5.7),置于25 ℃、160 r·min-1的摇床中黑暗培养10 d,测定IHEM含量。
(2)氮源筛选试验:以上述筛选的碳源培养基为基础,氮源分别替换为酵母提取粉、胰蛋白胨、牛肉浸膏、硝酸钾、硝酸铵、酒石酸铵和脲,以不添加氮源为对照组,碳氮比为4∶1,pH自然(pH值5.7),置于25 ℃、160 r·min-1的摇床中黑暗培养10 d,测定IHEM含量。
(3)碳氮比试验:以上述筛选的碳源、氮源为条件,碳氮比分别设定为4∶1、5∶1、10∶1、20∶1、30∶1、40∶1、50∶1、60∶1、70∶1和80∶1,以碳氮比4∶1为对照组,置于25 ℃、160 r·min-1的摇床中黑暗培养10 d,测定IHEM含量。
(4)维生素筛选试验:以上述筛选的碳源、氮源、碳氮比为条件,维生素分别替换为VB1、叶酸(vitamin B9,VB9)、生物素(vitamin H,VH)、维生素B6(vitamin B6,VB6)、核 黄 素(riboflavin∕vitamin B2,VB2)、抗坏 血酸(vitamin C,VC)、尼克酸(nicotinic acid,Vpp),以不添加维生素为对照组,置于25 ℃、160 r·min-1的摇床中黑暗培养10 d,测定IHEM含量。
(5)pH值筛选试验:以上述筛选的碳源、氮源、碳氮比和维生素为条件,设定培养基pH值依次为5、5.5、6、6.5、7、7.5和8,以初始pH自然为对照组(pH值5.7),置于25 ℃、160 r·min-1的摇床中黑暗培养10 d,测定IHEM含量。
(6)摇床转速筛选试验:以上述筛选的碳源、氮源、碳氮比、维生素、pH值为条件,以转速160 r·min-1为对照组,将粗毛纤孔菌分别置于25 ℃,120、140、160、180和200 r·min-1的摇床中黑暗培养10 d,测定IHEM含量。
(7)温度筛选试验:基于上述配方继续优化,将粗毛纤孔菌分别置于24、25、26、27和28 ℃的摇床中,以培养温度25 ℃作为对照组,在160 r·min-1条件下黑暗培养10 d,测定IHEM含量。
1.3.4 正交试验 基于单因素试验结果,以IHEM含量为评价指标,对碳源、氮源、pH值和转速进行正交优化,每个分组设定3个重复,详见表1。

表1 正交试验因素及水平Table 1 Factors and levels of orthogonal experiment
1.3.5 IHEM紫外全吸收光谱检测 称取1 mg IHEM,溶解于浓度为0.1 mol·L-1的NaOH溶液中,50~60 ℃水浴加热并充分混匀,30 min后黑色素完全溶解,于3 000 r·min-1条件下离心10 min,将上清液置于200~700 nm波长范围内测定紫外全吸收光谱[25]。
1.3.6 IHEM红外光谱检测 参考李琦等[26]的方法,采用溴化钾压片法,在模具中加入1~2 mg纯化后的IHEM粉末和200 mg KBr纯品粉末,使用油压机将其压成透明薄片,在波数范围4 000~400 cm-1、扫描次数32、分辨率4 cm-1参数下测定其红外吸收光谱。
1.4 IHEM化学抗氧化活性测定
1.4.1 DPPH自由基清除率测定 参照Ai等[27]的方法并稍作修改。在96孔板中依次滴加100 µL不同浓度的可溶性IHEM溶液(0.012 5、0.025、0.05、0.25、0.5、1、2、5 mg·mL-1)和120 µmol·L-1DPPH溶液,室温黑暗反应30 min,在波长517 nm处测定吸光度值,记为AX。分 别 以100 µL无水乙醇 代 替IHEM溶液 和DPPH溶液,测定波长517 nm下的吸光度值,记作A0和AX0。同时,以VC作为阳性对照组,采用同样的方法测定其DPPH清除率。试验设定3个重复,取平均值。清除率计算公式如下:
1.4.2 ABTS自由基清除率测定 参照王荣等[28]的方法并稍作修改。将7.0 mmol·L-1ABTS溶液与2.45 mmol·L-1过硫酸钾水溶液充分混匀,25 ℃黑暗保存12~16 h,获得ABTS+母液。用去离子水将ABTS+母液稀释至734 nm处吸光值为(0.70±0.02),30 ℃水浴30 min获得ABTS+工作液。在96孔板中分别滴加100 µL不同浓度的可溶性IHEM溶液(0.012 5、0.025、0.05、0.25、0.5、1 mg·mL-1)和ABTS+工作液,将其混匀后25 ℃避光反应20 min,在734 nm波长处测定其吸光度值,记为AX。分别以100 µL去离子水代替IHEM溶液和ABTS+工作液,测定734 nm波长下的吸光度值,记为A0和AX0。采用同样的方法对VC的ABTS清除率进行测定并作为对照组。试验设定3个重复,取平均值,清除率计算同公式(1)。
1.4.3 羟基自由基清除率测定 参照白生文等[29]的方法并稍作修改。在96孔板中依次加入9 mmol·L-1的水杨酸-乙醇溶液、9 mmol·L-1的FeSO4溶液、不同浓度(0.012 5、0.025、0.05、0.25、0.5、1、2、5 mg·mL-1)的可溶性IHFM溶液和8.8 mmol·L-1的H2O2溶液各15 µL,最后加入165 µL去离子水,混合均匀并置于37 ℃恒温水溶锅中水浴15 min,测定510 nm波长下的吸光度值,记为AX。以15 µL去离子水替代样品溶液和H2O2测定吸光度,测定510 nm波长下的吸光度值,记为A0和AX0。试验设定3个重复,取平均值,清除率计算同公式(1)。
1.5 数据分析
用SPSS 25.0统计软件对试验数据进行分析。数据表示为平均值±标准差。采用t检验进行差异显著性分析,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 主要营养要素筛选结果
由图1-A可知,相比未添加碳源的对照组,添加甘露醇、玉米粉可以极显著提高发酵液中黑色素的含量(P<0.01),添加蔗糖和果糖也显著提高了发酵液中黑色素的含量(P<0.05),其中甘露醇促进效果最好。因此选择甘露醇作为碳源继续进行优化试验。
由图1-B可知,相比未添加氮源的对照组,酵母提取粉极显著促进了粗毛纤孔菌发酵液产黑色素,胰蛋白胨次之,牛肉浸膏第三。硝酸铵、酒石酸铵等无机氮源添加处理的IHEM含量与对照无显著差异。综上所述,酵母提取粉为最适氮源。
以PDB加富培养基中的碳氮比4∶1作为对照组。由图1-C可知,发酵液中黑色素的含量随着碳氮比的增加而减少,当碳氮比为4∶1(即甘露醇20 g,酵母提取粉5 g)时,IHEM的含量最高,因此选择碳氮比4∶1继续进行优化试验。
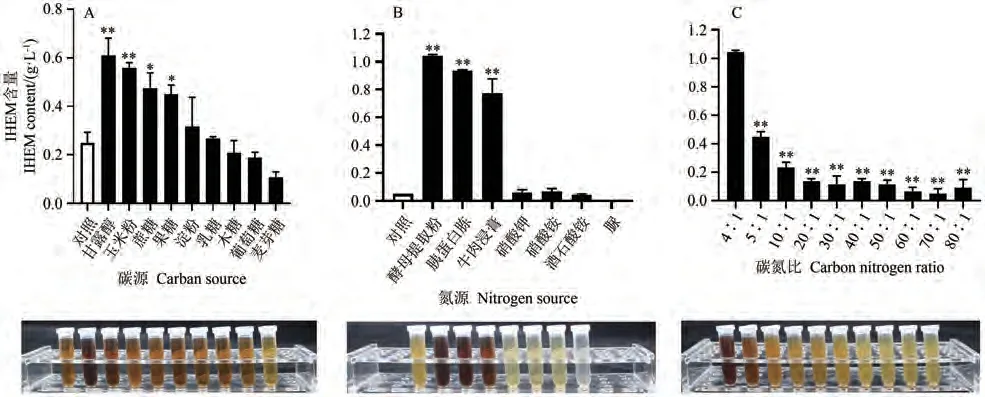
图1 碳源、氮源及碳氮比对IHEM含量的影响Fig.1 Effects of carbon source, nitrogen source and carbon nitrogen ratio on IHEM content
2.2 生长因子筛选结果
由图2可知,相比未添加维生素的对照组,添加VB1的发酵液颜色深于对照组的发酵液,且VB1极显著提高了IHEM含量,而其他维生素均显著或极显著降低了IHEM含量。因此,粗毛纤孔菌发酵培养基的最适维生素为VB1。
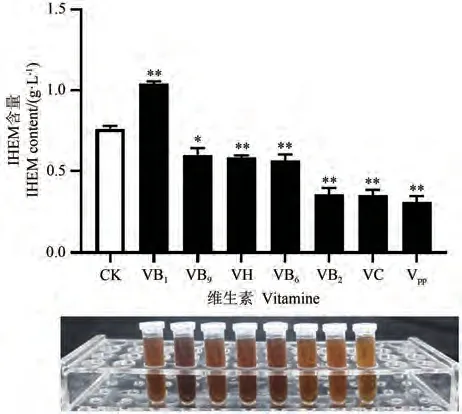
图2 维生素对IHEM含量的影响Fig.2 Effect of vitamin on IHFM content
2.3 培养条件筛选结果
由图3-A可知,初始pH自然条件下的IHEM含量最高,调节培养基的pH会不同程度地降低发酵液中IHEM的含量,其中pH自然条件下发酵液颜色最深,故而选择pH自然继续进行优化试验。
由图3-B可知,发酵液中IHEM的含量在转速为160 r·min-1时最高,而后随 着转速 升 高,发 酵液中IHEM的含量降低,故选择160 r·min-1继续进行优化试验。
由图3-C可知,发酵液中IHEM的含量随着温度升高呈先升高后降低的趋势,在温度为25 ℃时最高,故选择25 ℃继续进行优化试验。
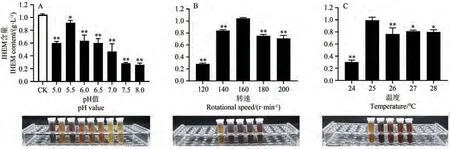
图3 不同培养条件对IHEM含量的影响Fig.3 Effects of different culture conditions on IHEM content
2.4 正交试验结果
基于单因素试验结果,选择碳源、氮源、pH值、转速较佳的前三种方案开展三水平四因素的正交优化试验,以IHEM含量为指标,探究促进粗毛纤孔菌高产黑色素的最优培养条件。
通过对正交试验结果进行直观分析(表2),发现在4个单因素的各均值中,碳源为甘露醇的均值最大,氮源为牛肉浸膏的均值最大,pH值为6的均值最大,转速为180 r·min-1的均值最大。在此条件下,第3个优化组合的IHEM含量最高,达到3.29 g·L-1。如图4所示,观察比较各组合发酵液的颜色,同样发现第3个优化组合的发酵液颜色最黑,由此表明粗毛纤孔菌在该配方下可获得较高含量的IHEM。通过对极差(R)进行比较分析,发现4个因素的极差由大到小依次为转速>碳源>氮源>pH值,说明转速是影响IHEM含量的主要因素。方差分析结果表明(表3),4个因素的F值从大到小依次为转速>碳源>氮源>pH值,与直观分析结果一致。
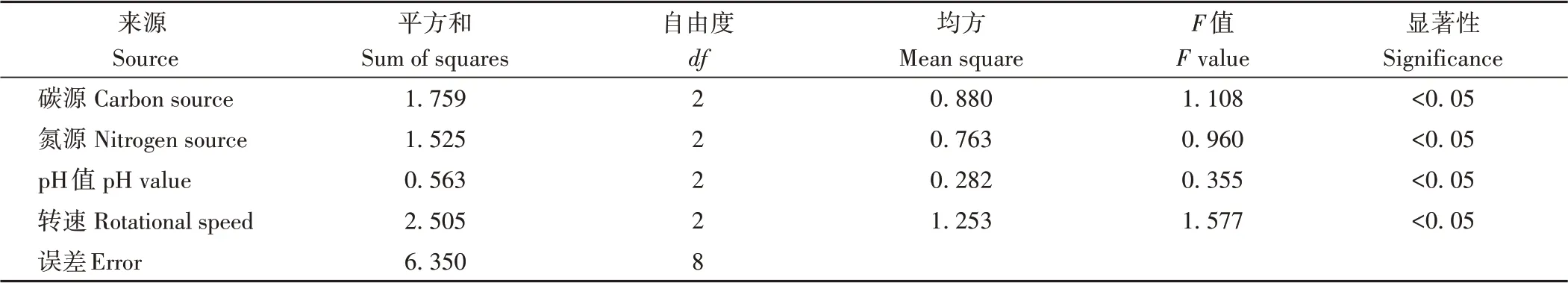
表3 方差分析Table 3 Variance analysis

图4 正交试验中各种配方对应的粗毛纤孔菌发酵液Fig.4 The fermentation broth of Inonotus hispidus corresponding to each recipe in the orthogonal test
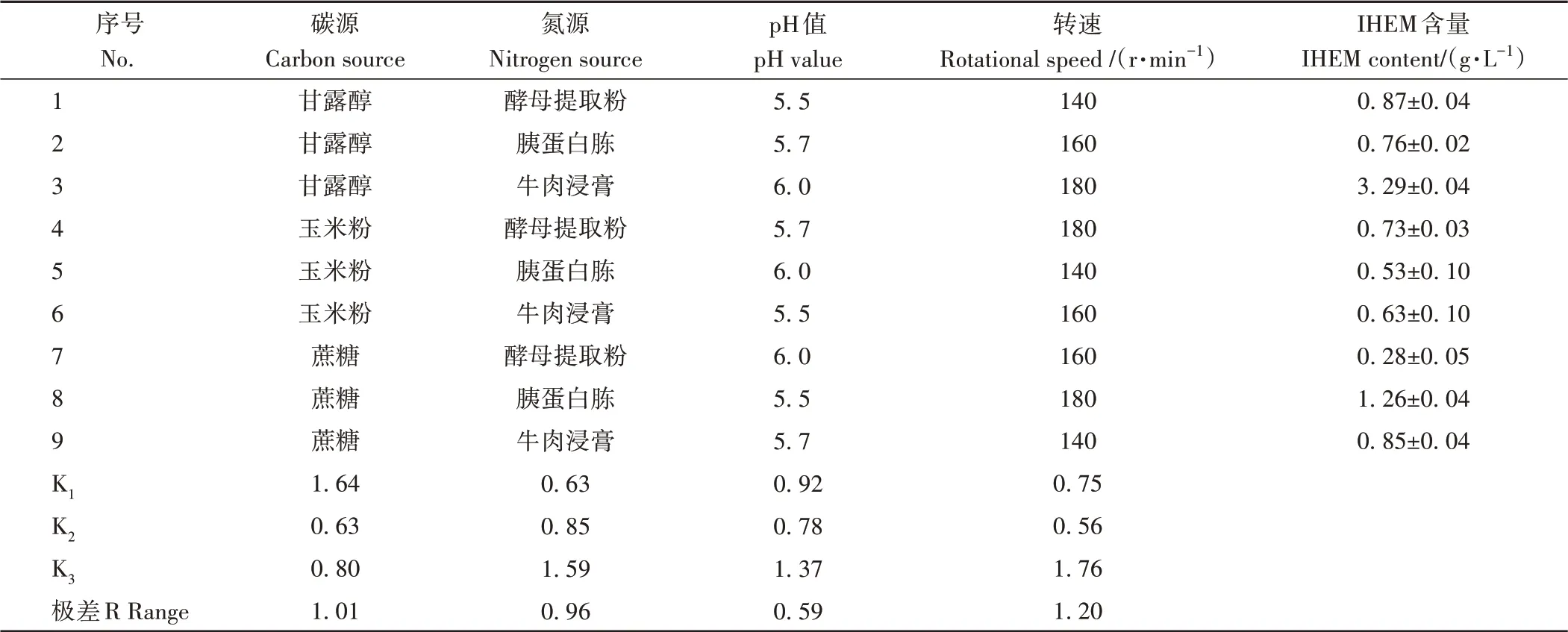
表2 IHEM含量正交试验结果直观分析Table 2 Intuitionistic analysis of IHEM content by orthogonal test
2.5 IHEM紫外全吸收光谱和红外光谱分析
紫外全吸收光谱和红外光谱是鉴定黑色素基本特征的重要途径[30]。如图5-A所示,IHEM在紫外光区210 nm波长处具有最大吸收峰,其吸光值向可见光区逐渐下降,该特征符合黑色素的吸收特征[31]。在260 nm及280 nm处无吸收峰,表明IHEM纯品无核酸和蛋白质,提取的IHEM纯品相对较纯。如图5-B所示,IHEM在波数3 430.887 cm-1处具有较强且宽的特征吸收,与吲哚环内-OH基团连接的-NH基团相对应,宽而强的吸收峰可能与-NH、-OH中形成了氢键有关[31]。2 923.679 cm-1对应脂肪族-CH,1 637.337 cm-1对应C=O拉伸或芳香C=C拉伸[32]。1 540.910 cm-1的峰值与-NH弯曲振动有关,1 438.697 cm-1左右的峰值则与-CN拉伸峰有关,说明其具有典型的黑色素吲哚结构[32]。632.564 cm-1处吸收带较弱,说明芳香环已被取代形成共轭体系[33]。以上结果表明,通过提取纯化获得的IHEM符合传统黑色素的结构特征。
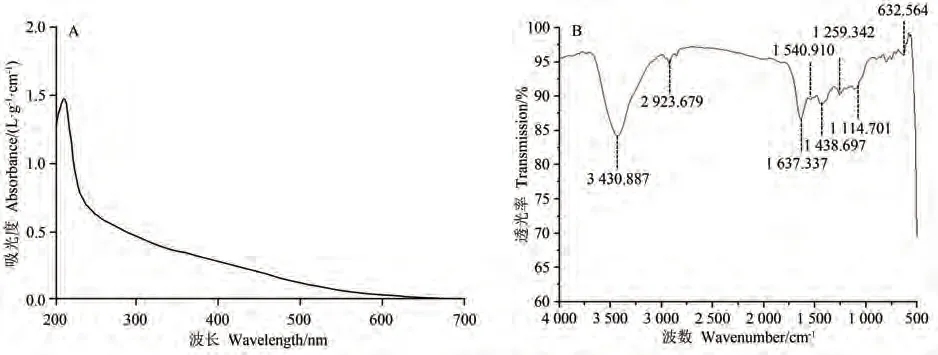
图5 IHEM光谱特性分析Fig.5 Spectral properties analysis of IHEM
2.6 IHEM体外抗氧化活性分析
在明确IHEM为黑色素后,研究其抗氧化活性。VC是一种强抗氧化剂,能有效抵御自由基对人体的伤害,降低脂质过氧化等作用。由图6可知,IHEM对ABTS自由基的清除效果最好,其次是清除DPPH自由基的能力,清除羟基自由基的效果较弱,其半最大效应浓度(concentration for 50% of maximal effect, EC50)依 次 为0.019、0.170和1.932 mg·mL-1。当IHEM浓度为0.25 mg·mL-1时,其对ABTS自由基的清除效果与VC无显著差异,表明可溶性IHEM具有良好的体外抗氧化活性。
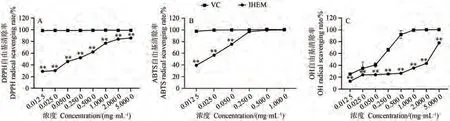
图6 IHEM的抗氧化活性Fig.6 The antioxidant activity of IHEM
3 讨论
在活性物质研究中,研究较多的是来源于子实体活性物质的生物学活性。药用真菌发酵液中含有丰富的代谢产物,结构多样,且发酵液比子实体更易获取,周期更短,是活性物质的重要来源之一[34]。黑色素作为粗毛纤孔菌的活性成分之一,存在于子实体和发酵液中,但对于液体发酵黑色素的研究鲜有报道。液体发酵在微生物工业生产中发挥着重要作用,通过优化培养基配方来提高黑色素的生物产量,可以为黑色素在工业、农业、食品、医药等领域的开发利用奠定基础。
本研究单因素试验结果表明,甘露醇作为碳源可显著提高IHEM含量,这与其具有调节渗透压、抗逆性等活性相关[35]。甘露醇可通过调节粗毛纤孔菌的渗透压来促进粗毛纤孔菌的代谢,进而提高IHEM的含量。氮源可分为有机氮源和无机氮源。本试验发现,酵母提取粉、胰蛋白胨和牛肉浸膏等有机氮源均能显著提高IHEM含量,但硝酸钾、硝酸铵、酒石酸铵、脲等无机氮源未显著提高IHEM含量,表明有机氮能为IHEM的产生提供优质的有机营养;当脲为氮源时,粗毛纤孔菌几乎不产黑色素,可能是因为脲作为一元碱影响了培养基的pH值,从而不利于粗毛纤孔菌的正常生长。IHEM含量随着碳氮比的增加而逐渐减少,当碳氮比为4∶1时,IHEM含量最高,可能与氮源及粗毛纤孔菌黑色素合成途径相关。维生素作为一种生长因子[36],不同维生素可能具有不同作用,本研究发现,添加VB1可显著提高IHEM含量,而其他维生素对IHEM产生有一定的抑制作用,这可能是因为VB1能促进菌体的生长,从而促进黑色素的生成,这与唐少军等[7]的研究结果相似。同时,培养条件也会影响微生物的生长情况和代谢产物的合成[26]。本研究结果表明,培养基pH值为5.5、5.7(自然)和6时的IHEM含量均较高,推测粗毛纤孔菌在弱酸性条件下更易产生黑色素,而强酸或强碱条件可能会影响菌丝的细胞膜透性;摇床转速亦会影响IHEM含量,随着培养转速的增加,IHEM含量呈先增后减的趋势,转速为140、160、180 r·min-1时的IHEM含量较高,表明适当加快转速有利于增加发酵液中的溶解氧含量,以促进黑色素的产生,但转速过大会对菌丝体造成机械损伤,不利于菌丝体的生长及黑色素的产生,转速过低可能会导致发酵液中的溶解氧含量不足以供给粗毛纤孔菌生长所需;粗毛纤孔菌在25 ℃时的IHEM含量最高,可能是由于温度过高会影响真菌细胞内的酶活力及粗毛纤孔菌的生长与代谢。
通过测定IHEM清除自由基的能力,发现IHEM具有良好的抗氧化活性,这与袁源等[37]报道的黑木耳黑色素具有良好抗氧化性的结果基本一致。表明IHEM可以作为新型抗氧化剂应用在食品、化妆品等领域。本研究为粗毛纤孔菌黑色素的开发及应用提供了新思路。
4 结论
本研究通过单因素试验探索了碳源、氮源、碳氮比、温度等因素对粗毛纤孔菌产胞外黑色素的影响,在此基础上以正交试验优化了发酵培养基和发酵条件。结果表明,粗毛纤孔菌高产胞外黑色素的最佳培养基配方为甘露醇20 g·L-1、牛肉浸膏5 g·L-1、碳氮比4∶1、维生素B110 mg·L-1,最优发酵条件为初始pH值6、转速180 r·min-1以及发酵温度25 ℃,在此培养条件下,IHEM含量高达3.29 g·L-1,较优化前提高了17.32倍,表明该培养配方可作为大量生产IHEM的有效配方。以紫外全吸收光谱和红外光谱对胞外黑色素进行鉴定,光谱特征符合黑色素的吸收特征。黑色素抗氧化试验结果表明,黑色素具有良好的抗氧化活性。

